
- •Дипломна робота бакалавра
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2 30
- •1. Огляд літератури
- •1.1. Аутологічні антитіла, їх продукція та характеристики
- •1.2. Функціональна активність аутоантитіл у нормі та при аутоімунних захворюваннях
- •1.3. Аутоімунні захворювання
- •1.3.1. Системний червоний вовчак – системна імунопатія
- •1.3.2. Розсіяний склероз
- •1.4. Антитіла із каталітичною ензимоподібною активністю – абзими
- •Полісахарид-гідролізуючі абзими;
- •Абзими, що володіють сіалідазною активністю.
- •1.5. Роль процесів сіалування/десіалування у функціонуванні імунної системи
- •1.5.1. Структура та функції сіалових кислот
- •1.5.1.1. Структура сіалових кислот
- •1.5.1.2. Значення сіалових кислот для функціонування імунної системи
- •1.5.2. Вплив процесів сіалування-десіалування на структуру та функції імуноглобулінів
- •1.5.3. Анти-сіалільні антитіла у нормі та при патології
- •1.5.3.1. Абзими, що володіють сіалідазною активністю
- •2. Матеріали і методи досліджень
- •2.1. Реактиви і матеріали
- •2.2. Методи досліджень
- •2.2.1. Очищення антисіалільних IgG-антитіл із сироватки крові хворих на счв та рс
- •2.2.2. Одержання (Fab)2 антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2
- •2.2.4. Визначення сіалідазної (нейрамінідазної) активності IgG після ренатурації із пааг
- •2.2.5. Інгібування сіалідазної активності антисіалільних IgG-антитіл інгібіторами клітинних сіалідаз
- •2.2.6. Електрофоретичне розділення білків у пааг.
- •3. Результати досліджень та їх обговорення
- •3.1. Виділення та очистка IgG із сироватки крові хворих на счв та визначення їхньої сіалідазної активності
- •3.2. Виділення та очистка антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •3.3. Дослідження сіалідазної активності та субстратної специфічності антисіалільних IgG-антитіл
- •3.4. Інгібування сіалідазної активності антисіалільних IgG-антитіл
- •3.5. Визначення сіалідазної активності антисіалільних IgG-антитіл, ренатурованих з пааг
- •3.6. Одержання (Fab)2 антисіалільних IgG-антитіл
- •3.7. Визначення сіалідазної активності (Fab)2 антисіалільних IgG-антитіл
- •3.8. Дослідження сіалідазної активності антитіл сироватки крові хворих на розсіяний склероз
- •4. Охорона праці Вступ
- •4.1. Аналіз стану умов праці
- •4.1.1. Характеристика лабораторії
- •4.1.2.Аналіз методів дослідження та характеристика обладнання
- •4.1.3. Характеристика об'єкту дослідження, речовин, їхніх небезпечних властивостей
- •4.2. Організаційно–технічні заходи
- •4.2.1.Організація робочого місця і роботи
- •4.2.2. Санітарно–гігієнічні вимоги до умов праці
- •4.2.3. Заходи щодо безпеки під час роботи з обладнанням, об'єктом дослідження і речовинами
- •4.3. Безпека у надзвичайних ситуаціях
- •4.3.1. Протипожежні та проти вибухові заходи
- •4.3.2. Організація евакуації працівників
1.5.3.1. Абзими, що володіють сіалідазною активністю
У сироватці крові дітей, хворих на гостру лімфобластну лейкемію, виявлено IgG- та IgM-антитіла, здатні зв’язувати О-ацетильовану сіалову кислоту. Такі антитіла можуть зумовлювати аглютинацію еритроцитів, що містять 9-О-ацетильовану сіалову кислоту на своїй поверхні. Окрім того, вони викликають комплемент-незалежний (10,2-17,4% клітин) та комплемент-залежний (51,0-77,0% клітин) цитоліз лімфобластів [21, 46].
Нещодавно ми встановили, що в сироватці крові хворих на множинну мієлому присутні IgG-антитіла, здатні гідролізувати синтетичні субстрати дії сіалідаз (2'-(4-метилумбелліферил)-α-D-N-ацетилнейрамінову кислоту) та відщеплювати сіалільні залишки глікопротеїнів і гангліозидів плазматичних мембран клітин крові людини [18]. Антитіла із сіалідазною активністю не було виявлено в сироватці крові клінічно здорових донорів, а також у хворих на ревматоїдний артрит. Також ми показали, що десіалування глікоротеїнів плазматичних мембран еукаріотичних клітин стимулює їхній фагоцитоз макрофагами [18]. Отримані дані вказують, що сіаліл-гідролізуючі IgG-антитіла сироватки крові можуть бути залучені у кліренсі апоптичних і некротичних клітин у хворих на деякі автоімунні і гематоонкологічні захворюваннями. На сьогодні походження цих каталітичних антитіл залишається не з’ясованим.
2. Матеріали і методи досліджень
2.1. Реактиви і матеріали
При виконанні роботи використовувались наступні реактиви:
Акриламід Serva
Амоній персульфат Bio-Rad
Амоній сульфат Sigma
Білкові маркери Fermentas
Бромфеноловий синій Invitrogen
Гліцерол Serva
Гліцин Merck
Кальцій хлорид Merck
Магній хлорид Sigma
Натрій азид Flucka
Натрій ацетат Sigma
Натрій додецил сульфат Sigma
Натрій карбонат Merck
Натрій хлорид Sigma
Натрій 4-метилумбеліферилнейрамінат Sigma
Озельтамівір Sigma
Пепсин Sigma
Перекис водню Тернофарм
Твін 20 Sigma
Трис Ultra Pure ICN Biomedicals, Inc
N',N'-метиленбісакриламід Reanal
N,N,N’,N’-Тетраметилетан-1,2-діамін Sigma
β-меркаптоетанол Sigma
Coomassiе Blue R-250 Reanal
Coomassiе Blue G-250 Reanal
Ponceau Red Reanal
У роботі використано сорбент протеїн G-сефарозу (Sigma). Сорбенти муцин-сефароза та трансферин-сефароза виготовлено у відділі регуляції проліферації клітин та апоптозу ІБК НАН України із комерційно доступної активованої сефарози та препаратів муцину і трансферину, відповідно.
Сироватки крові здорових донорів і хворих на аутоімунні захворювання надано у рамках договору про співпрацю д.м.н. Негрич Т. І. (Львівський національний медичний університет ім. Данила Галицького).
2.2. Методи досліджень
2.2.1. Очищення антисіалільних IgG-антитіл із сироватки крові хворих на счв та рс
IgG виділяли за тристадійною схемою (рис. 1). Для цього 1 мл сироватки крові центрифугували при 5000 g протягом 5 хв, АТ осаджували 50% розчином (NH4)2SO4 [1]. Осад діалізували проти 0,15 М NaCl у 20 мМ трис-HCl (pH 7,5) протягом 18 год і очищали методом афінної хроматографії на колонці, наповненій сорбентом муцин-сефарозою. IgG елюювали з колонки 0,1 М гліцин-НСl (рН 2,6) та нейтралізували 1,5 М трис-HCl (pH 8,8), після чого АТ діалізували проти розчину 20 мМ трис-HCl (pH 7,5) протягом 18 год. Далі імуноглобуліни вносили на колонку із сорбентом протеїн G-сефарозою для виділення IgG-антитіл. Процедура виділення та діалізу аналогічна до попередньої. Концентрацію білка у зразках вимірювали на спектрофотометрі NanoDrop ND-1000 (NanoDrop, США).
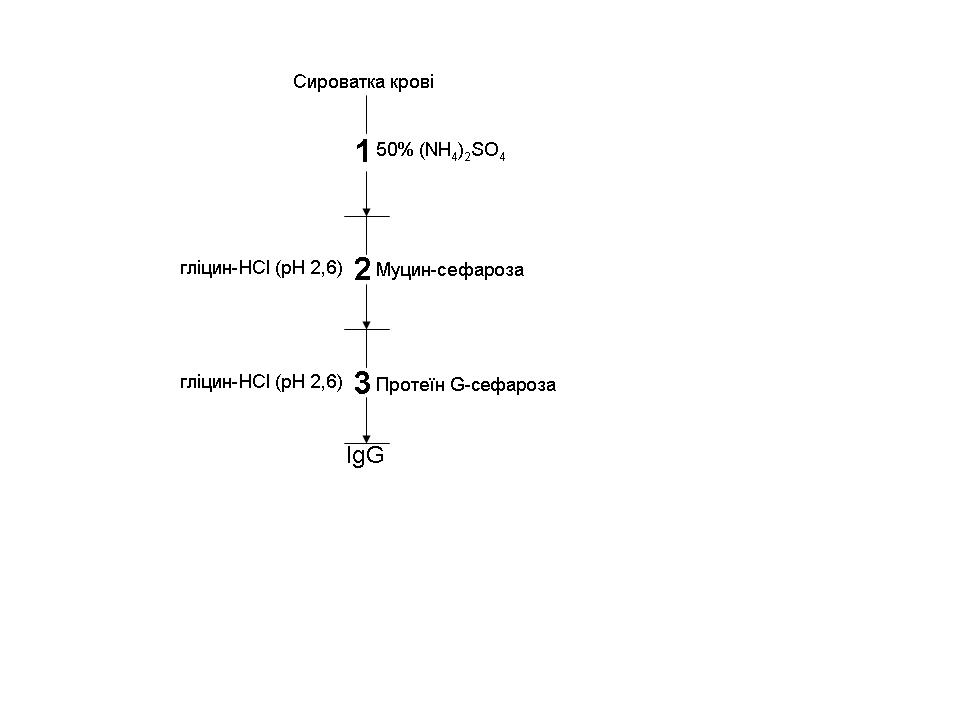
Рис. 1. Схема очищення антисіалільних IgG-антитіл із сироватки крові хворих на СЧВ
