
- •1. Основное кинетическое уравнение массопередачи. Коэффициент массопередачи и движущая сила процесса.
- •2. Движущая сила моссообменного процесса при нелинейной равновесной зависимости. Число единиц переноса и его физический смысл.
- •3. Выражение для средней движущей силы и числа единиц переноса при линейной равновесной зависимости.
- •4. Модифицированные уравнения массопередачи. Число единиц переноса. Высота эквивалентная единице переноса.
- •5. Материальный баланс массообменного процесса. Рабочая линия массообменного процесса.
- •6. Массообмен в системах без твердой фазы. Молекулярная и конвективная диффузия.
- •7. Дифференциальные уравнения молекулярной и конвективной диффузии. Числа подобия диффузионных процессов, их физический смысл.
- •8. Молекулярная диффузия. Первый закон Фика. Коэффициент диффузии и его физический смысл.
- •9. Уравнение Щукарева. Коэффициент массоотдачи и его физический смысл. Сопоставление с коэффициентом массопередачи.
- •10. Выражения коэффициента массопередачи через коэффициенты массоотдачи.
- •11. Равновесие в системах газ-жидкость. Закон Генри. Уравнение равновесной зависимости. Влияние давления и температуры на абсорбцию.
- •12. Равновесие в процессах пар-жидкость для идеальных смесей. Закон Рауля. Диаграммы t-X,y и y-X.
- •13.Принципиальная схема противоточной абсорбции и графическое изображение процесса.
- •14.Принципиальная схема абсорбции с рециркуляцией жидкости и графическое изображение процесса.
- •15. Схема ректификационной установки непрерывного действия. Материальный баланс ректификационной колонны. Флегмовое число.
- •16.Уравнение рабочих линий процесса ректификации для непрерывно действующей ректификационной колонны. Минимальное и оптимальное флегмовое число.
- •17.Изображение рабочих линий ректификации в диаграмме y-X.
- •18.Влияние флегмового числа на размеры ректификационной колонны и расход тепла при ректификации. Оптимальное флегмовое число.
- •19.Схема периодически действующей ректификационной установки. Рабочие линии процессов с переменным и постоянным флегмовым числом.
- •20.Схема периодически действующей ректификационной установки. Изображение процесса в y-X диаграмме при постоянном составе дистиллята.
- •21.Тепловой баланс процесса ректификации.
- •22.Построение кинетической кривой и определение реального числа тарелок.
- •23. Порядок расчета ректификационной тарельчатой колонны.
- •27.Непрерывная противоточная экстракция .Материальный баланс.Графическое изображение процесса.
- •28. Ступенчатая противоточная экстракция. Принципиальная схема. Графическое изображение процесса.
- •29. Многократная экстракция с противотоком растворителя.
- •30. Массопередача в системах с твердой фазой. Массопроводность. Дифференциальные уравнения массопроводности.
- •Процесс сушки. Технические способы проведения процесса. Виды связи влаги с материалом.
- •32.Основные способы сушки. Материальный баланс конвективной сушки.
- •33.Диаграмма состояния влажного воздух (диаграмма Рамзина).
- •34.Изображение в диаграмме н-х процессов изменения параметров влажного воздуха: температура точки росы, охлаждение, нагревание, смешение.
- •36. Тепловой баланс воздушной сушки. Уравнение рабочей линии процесса сушки.
- •37. Параметры, влияющие на процесс сушки. Способы интенсификации сушки.
- •38. Сушка с многократным промежуточным подогревом воздуха. Принципиальная схема. Изображение в н-х диаграмме.
- •39. Сушка с частичным возвратом отобранного воздуха. Принципиальная схема. Изображение в н-х диаграмме.
- •40. Сушка с замкнутой циркуляцией сушильного агента. Принципиальная схема. Изображение в н-х диаграмме.
- •41. Процесс адсорбции. Динамическая и статическая активность адсорбентов. Условия, влияющие на проведение процесса адсорбции.
- •42. Физическая сущность процесса адсорбции. Адсорбенты. Условия, способствующие протеканию процесса адсорбции.
- •43. Ионообменные процессы – основные закономерности, область применения. Регенерация ионитов.
- •44. Кристаллизация. Основные способы проведения кристаллизация. Равновесие в процессах кристаллизации.
- •45. Мембранные процессы. Классификация мембранных процессов в зависимости от их механизма. Область применения.
- •46. Влияние различных параметров на селективность и проницаемость мембран.
- •47. Материальный и тепловой баланс изогидрической кристаллизации
- •48. Материальный и тепловой баланс кристаллизации с удалением части растворителя (это изотермическая кристаллизация).
12. Равновесие в процессах пар-жидкость для идеальных смесей. Закон Рауля. Диаграммы t-X,y и y-X.
Если жидкую идеальную бинарную смесь в течение значительного времени выдержать в замкнутом объёме при кипении в условиях постоянной температуры и постоянного давления, то система, состоящая из пара и жидкости, придёт в состояние равновесия. В условиях равновесного состояния потоки компонентов из фазы в фазу будут одинаковы, при этом состав пара будет отличаться от состава жидкости.
Введём обозначения: компонент А имеет меньшую температуру кипения tкА и называется низкокипящим или легколетучим; компонент В имеет большую температуру кипения tкВ и называется высококипящим или труднолетучим.
Идеальные смеси подчиняются закону Рауля: рА=РАх; рВ=РВ(1-х)
Формулировка: парциальное давление компонента в паровой среде над раствором равно давлению его чистых насыщенных паров, умноженное на мольную долю компонента в растворе.
В то же время парциальные давления компонентов в системе следуют закону Дальтона: рА=Ру; рВ=Р(1-у)
Формулировка: парциальное давление компонента в газовой (паровой) смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси.
РА, РВ – давления паров чистых компонентов А и В;
рА, рВ – парциальные давления А и В;
Р - общее давление в системе;
х, (1-х) – мольные доли А и В в жидкой смеси;
у, (1-у) – мольные доли А и В в паровой смеси.
Для установившегося равновесия: РАх=Ру; Рв(1-х)=Р(1-у)
Отсюда следует: у=(РА/Р) х или 1-у=(РВ/Р)(1-х)
Обычно процесс ректификации проводят при Р=const
X=(Р-РВ)/(РА- РВ)
Диаграмма t-x,у , характеризующая равновесие в системе изображена на рис. 1. Нижняя ветвь на диаграмме будет отвечать температурам кипения жидкой смеси, верхняя - температурам конденсации паровой фазы. По этой диаграмме по составу жидкой фазы х1 можно найти равновесный ей состав пара у1 и температуру в системе t1.
Для анализа процессов ректификации более удобна диаграмма у – х (рис.2) , построенная на основе t-х,у. Кривая зависимости ур=f(х) отвечает уравнению:
У=(РА/Р)х=РАх/(РВ+(РА-РВ)х)
РА/РВ=α-относительная летучесть компонента А
У=αх/(1+(α-1)х).
Изменение давления существенно влияет на положение равновесной зависимости ур=f(x) (рис. 3).
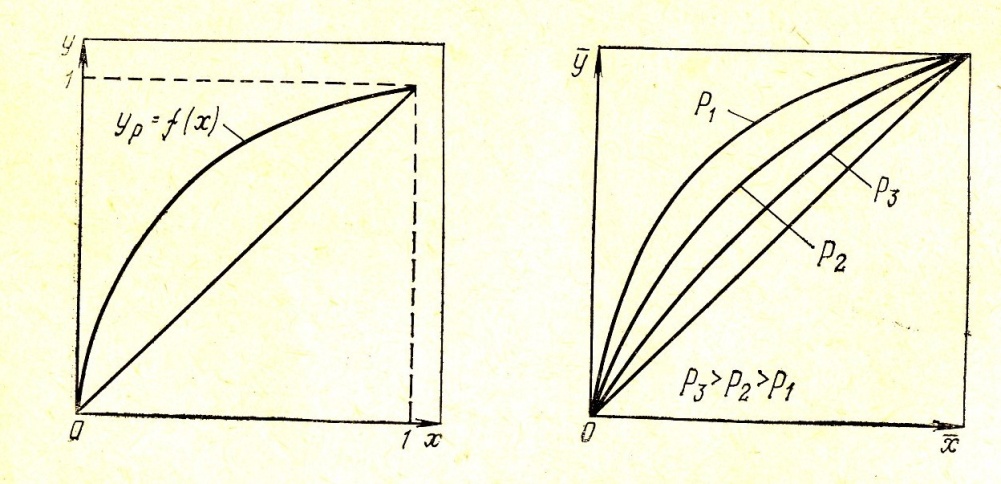
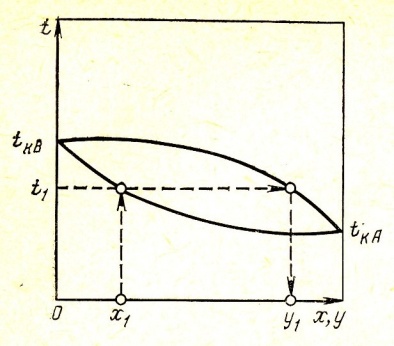
Рис.1 – зависимость температуры паро-жидкостной системы от состава фаз в условиях равновесия;
Рис.2-диаграмма равновесных составов;
Рис.3-влияние изменения давления на положение равновесной кривой.
13.Принципиальная схема противоточной абсорбции и графическое изображение процесса.
Абсорбция – поглощение газов или паров из газовых или паровых смесей жидкими поглотителями, называемыми абсорбентами. Процесс абсорбции обратим, обратный ему – десорбция. Ж→Г,П
Два вида: 1) физическая абсорбция (растворение газа не сопровождается химической реакцией); 2) хемосорбция (абсорбируемый компонент вступает в хим. реакцию в жидкой фазе.)
В химической технике используют следующие принципиальные схемы абсорбционных процессов: прямоточные, противоточные, одноступенчатые с рециркуляцией и многоступенчатые с рециркуляцией.
Противоточная схема показана на рис.1 . По этой схеме в одном конце аппарата приводятся в контакт газ и жидкость, имеющие большие концентрации распределенного вещества, а в противоположном конце – меньшие.
Движущая сила больше всегда при прямотоке. Более низкие концентрации в целевом продукте можно получить только при противоточной абсорбции. Меньший расход адсорбента.
