
- •1. Основное кинетическое уравнение массопередачи. Коэффициент массопередачи и движущая сила процесса.
- •2. Движущая сила моссообменного процесса при нелинейной равновесной зависимости. Число единиц переноса и его физический смысл.
- •3. Выражение для средней движущей силы и числа единиц переноса при линейной равновесной зависимости.
- •4. Модифицированные уравнения массопередачи. Число единиц переноса. Высота эквивалентная единице переноса.
- •5. Материальный баланс массообменного процесса. Рабочая линия массообменного процесса.
- •6. Массообмен в системах без твердой фазы. Молекулярная и конвективная диффузия.
- •7. Дифференциальные уравнения молекулярной и конвективной диффузии. Числа подобия диффузионных процессов, их физический смысл.
- •8. Молекулярная диффузия. Первый закон Фика. Коэффициент диффузии и его физический смысл.
- •9. Уравнение Щукарева. Коэффициент массоотдачи и его физический смысл. Сопоставление с коэффициентом массопередачи.
- •10. Выражения коэффициента массопередачи через коэффициенты массоотдачи.
- •11. Равновесие в системах газ-жидкость. Закон Генри. Уравнение равновесной зависимости. Влияние давления и температуры на абсорбцию.
- •12. Равновесие в процессах пар-жидкость для идеальных смесей. Закон Рауля. Диаграммы t-X,y и y-X.
- •13.Принципиальная схема противоточной абсорбции и графическое изображение процесса.
- •14.Принципиальная схема абсорбции с рециркуляцией жидкости и графическое изображение процесса.
- •15. Схема ректификационной установки непрерывного действия. Материальный баланс ректификационной колонны. Флегмовое число.
- •16.Уравнение рабочих линий процесса ректификации для непрерывно действующей ректификационной колонны. Минимальное и оптимальное флегмовое число.
- •17.Изображение рабочих линий ректификации в диаграмме y-X.
- •18.Влияние флегмового числа на размеры ректификационной колонны и расход тепла при ректификации. Оптимальное флегмовое число.
- •19.Схема периодически действующей ректификационной установки. Рабочие линии процессов с переменным и постоянным флегмовым числом.
- •20.Схема периодически действующей ректификационной установки. Изображение процесса в y-X диаграмме при постоянном составе дистиллята.
- •21.Тепловой баланс процесса ректификации.
- •22.Построение кинетической кривой и определение реального числа тарелок.
- •23. Порядок расчета ректификационной тарельчатой колонны.
- •27.Непрерывная противоточная экстракция .Материальный баланс.Графическое изображение процесса.
- •28. Ступенчатая противоточная экстракция. Принципиальная схема. Графическое изображение процесса.
- •29. Многократная экстракция с противотоком растворителя.
- •30. Массопередача в системах с твердой фазой. Массопроводность. Дифференциальные уравнения массопроводности.
- •Процесс сушки. Технические способы проведения процесса. Виды связи влаги с материалом.
- •32.Основные способы сушки. Материальный баланс конвективной сушки.
- •33.Диаграмма состояния влажного воздух (диаграмма Рамзина).
- •34.Изображение в диаграмме н-х процессов изменения параметров влажного воздуха: температура точки росы, охлаждение, нагревание, смешение.
- •36. Тепловой баланс воздушной сушки. Уравнение рабочей линии процесса сушки.
- •37. Параметры, влияющие на процесс сушки. Способы интенсификации сушки.
- •38. Сушка с многократным промежуточным подогревом воздуха. Принципиальная схема. Изображение в н-х диаграмме.
- •39. Сушка с частичным возвратом отобранного воздуха. Принципиальная схема. Изображение в н-х диаграмме.
- •40. Сушка с замкнутой циркуляцией сушильного агента. Принципиальная схема. Изображение в н-х диаграмме.
- •41. Процесс адсорбции. Динамическая и статическая активность адсорбентов. Условия, влияющие на проведение процесса адсорбции.
- •42. Физическая сущность процесса адсорбции. Адсорбенты. Условия, способствующие протеканию процесса адсорбции.
- •43. Ионообменные процессы – основные закономерности, область применения. Регенерация ионитов.
- •44. Кристаллизация. Основные способы проведения кристаллизация. Равновесие в процессах кристаллизации.
- •45. Мембранные процессы. Классификация мембранных процессов в зависимости от их механизма. Область применения.
- •46. Влияние различных параметров на селективность и проницаемость мембран.
- •47. Материальный и тепловой баланс изогидрической кристаллизации
- •48. Материальный и тепловой баланс кристаллизации с удалением части растворителя (это изотермическая кристаллизация).
43. Ионообменные процессы – основные закономерности, область применения. Регенерация ионитов.
Это разновидность адсорбции. Ионообменные процессы – массообменные процессы, при которых жидкие электролиты взаимодействуют с твердыми веществами (ионитами), способными заменять имеющиеся у них свободные ионы на ионы находящиеся в растворе.
Область применения: умягчение воды, для опреснения воды, очистка сточных вод, разделение растворов, в аналитической химии, производство ряда пищевых продуктов.
Иониты: природные: (глина, уголь, апотиты). Недостаток: не стойки в щелочах и кислотах, что ограничивают и применение.
Искусственные: (молекулярные сито, синтетические смолы, плавленые цеолиты, гидрооксиды железа алюминия)
R+М+ Rа-А-
R+ - катионит, Rа- - анионит, М+1 - обмениваемый катион, М+2 – удаляемый из раствора электролита катион, А-1 – обмениваемый анион, А-2 – удаляемый из раствора электролита анион.
1) Удаление из раствора посторонних катионов
М+2 + R+М+1 ↔ М+1 + R+М+2
2) Удаление из раствора посторонних анионов
А-2+ Rа-А-1↔ А-1+ Rа-А-2
3)Удаление из раствора соли
М+2 А-2+ R+М+1 ↔ М+1 А-2+ R+М+2
М+1 А-2+ Rа-А-1↔ М+1 А-1+ Rа-А-2
4)Получение особо чистой воды (это вещество, где на 1млн чистого вещества приходится 1 часть пыли)
М+2 А-2+ R+Н+↔ Н+ А-2+ R+М+2
Н+ А-2+ Rа-ОН-↔ Rа-А-2+Н2О
Регенерация ионитов
Регенерация — это восстановление первоначальных свойств и состава отработанных продуктов после завершения технологического процесса.
Для регенерации катионита, насыщенного извлекаемыми из электролита катионами, используют растворы кислот:
R+ М+2 +НСl (8-10%)↔ R+ H++ М+2Сl-
а регенерация анионита осуществляется раствором щелочи:
Rа-А-2+NaOH(8-10%)↔ Rа-OH-+Na+ А-2
После регенерации ионитов необходима тщательная отмывка их водой от следов регенерирующих растворов.
Кинетика ионного обмена
-природа вещества (поглощаемого)
-температура
-концентрация извлекаемого компонента
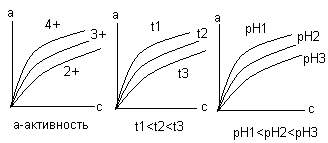
Активность от давления не зависит.
Материальный баланс: Lda=G(-dc), L(aк-ан)=G(сн-ск)
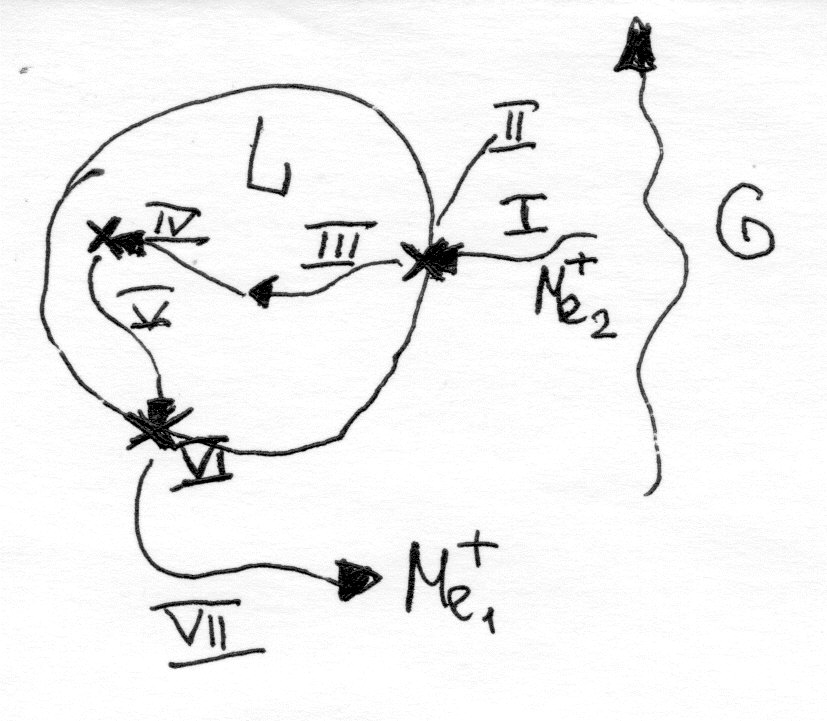
Процесс состоит из 7 стадий: I- перемещение извлекаемого катиона из среды к пов-ти раздела фаз; II- прохождение извлекаемого катиона через пов-ть раздела фаз; III- перемещение ивлек. катиона в теле ионита; IV- химич. реакция замены катиона извлекаемого на катион свободный; V- перемещение свободного иона в теле ионита к пов-ти раздела фаз; VI- переход свободного иона через границу раздела фаз; VII- перемещение свободного иона в поток омывающего ионит вещества. Лимитирующая стадия – VII – по ней рассчитывается кинетика процесса ионообмена.
GdM/Vdτ=βV(c-cp)dFdτ
NuдV=mRen , NuдV=βVd2зер/Dc, Re=wdзер/νс
dзер – среднеквадратичный диаметр зерна ионита.
Стадии: 1) процесс ионообмена; 2) регенерация; 3) отмывка ионообменного вещества от регенерирующего раствора.
Преимущество имеют аппараты с неподвижным псевдоожижженым слоем.
44. Кристаллизация. Основные способы проведения кристаллизация. Равновесие в процессах кристаллизации.
Кристаллизация – массообменный процесс извлечения твёрдой фазы из растворов, расплавов или паров. Ж → Тв
Равновесие в процессах кристаллизации. Все процессы рассматриваются в диаграммах состояния, на которых графически изображаются равновесие между различными фазами данной системы. Связь между числом компонентов К, числом фаз Ф и числом степеней свободы S данной системы устанавливается правилом фаз Гиббса: S=К-Ф+2. Число степеней свободы S данной системы соотв. числу независимых параметров, характеризующих эту систему (температура, давление, концентрация).
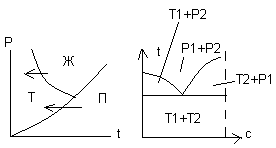
Фазовое равновесие однокомпонентной системы определяется двумя параметрами: температурой и давлением. S=1 при условии равновесия двух фаз – значит только один параметр может независимо меняться без изменения числа фаз – давление или температура. В тройной точке S=0. На фазовое равновесие двухкомпонентных систем оказывают влияние три параметра: температура, давление и концентрация. Поскольку давление незначительно влияет на равновесие между Ж и Тв фазами, фазовые превращения могут быть представлены на диаграмме температура-концентрация.
Правило рычага:
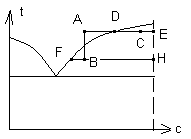
АВ-изогидрическая кристаллизация; АС-изотермическая кристаллизация.
1) изогидрическая кристаллизация МКР/ММ.Р.=FB/BH
2) изотермическая кристаллизация МКР/ММ.Р.=DC/CE МКР/МИСХ. Р-РА =DC/AE
МКР – масса кристаллов, ММ.Р – масса маточного или насыщенного раствора.
Основные способы проведения кристаллизация:
1) изогидрическая кристаллизация – за счет понижения температуры;
2) изотермическая - при постоянной температуре. Происходит изменение агрегатного состояния (удаление части растворителя);
3) выщелачивание (добавляется третье вещ-во, которое смещает растворимость в сторону пересыщения и происходит выделение растворенного вещества в виде твердых частиц);
4) химическая реакция.
Материальный баланс.
1) для изотермической кристаллизации
GН=GК + L + W
GН – исходный р-р, GК – маточный р-р, L – кол-во кристаллов, W – поток выпаренной воды.
GНХН=GКХК+Lλ
λ – отношение массы твердого вещества в кристалле к массе кристаллогидрата
2) для изогидрической кристаллизации: W=0
Тепловой баланс.
1) изогидрическая кристаллизация
GНСНtН+WОХЛСОХЛtН ОХЛ+LqКР= GКСКtК+LCКРtК+ WОХЛСОХЛtК ОХЛ, WОХЛ=…
WОХЛ – охлаждающая среда (вода), qКР – тепловой эффект кристаллизации. CКР – теплоемкость кристаллов, СОХЛ – охл. воды, СН – исх. раствора, СК – маточного раствора.
Тепловые потери играют положительную роль.
2) изотермическая кристаллизация.
GНСНtН+ LqКР+DНГР= GКСКtК+LCКРtК+ WНВТ+DНКОНД+QП, D=…
D – кол-во греющего пара. НКОНД – энтальпия конденсата.
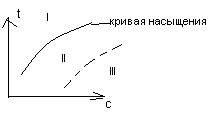 I-область
ненасыщенной концентрации, II-метастабильная
зона, III-зона кристаллизации.
I-область
ненасыщенной концентрации, II-метастабильная
зона, III-зона кристаллизации.
