
- •2.Изомерия органических соединений.
- •6.Сопряжение связей
- •11. Механизм реакций органических соединений
- •12. По электронной природе реагентов реакции (нуклеофильные, электрофильные, свободнорадикальные реакции).
- •20.Кислотно-основные свойства аминокислот
- •21.Декарбоксилирование
- •22.Аминоуксусная к-та с азотистой кислотой
- •23.Дезаминирование (удаление nh2 группы)
- •25.Первичная структура белка
- •26.Вторичная структура белка
- •27.Третичная структура белка
- •28.Четвертичная структура белка
- •29. Денатурация (денативация) и ренатурация (ренативация)
- •52.Принцип комплементарности .
- •55. Жиры.
- •63. Желчные кислоты
- •64. Житрорастворимые витамины
- •65.Водорастворимые витамины
- •65 Практика
- •66 Практика
- •67.Практика
- •68.Практика
- •69 Практика
- •70 Практика
- •71.Практика
- •72 . Практика
- •73 Практика
- •74 Практика
11. Механизм реакций органических соединений
1.
Если общая электронная пара делится
между атомами, то обра¬зуются радикалы
— частицы, имеющие неспаренные
электро-ны. Такой разрыв связи называется
радикальным, или гемолитическим:
Образующиеся радикалы взаимодействуют с имеющимися в реакционной системе молекулами или друг с другом:
СН3+Сl2СН3Сl+ .Сl
.СН3+.CН3С2Н6
По радикальному механизму протекают реакции, в которых разрыву подвергаются связи малой полярности (С—С, С—Н, N—N) при высокой температуре, под действием света или ра¬диоактивного излучения.
2.
Если при разрыве связи общая электронная
пара остается у одного атома, то
образуются ионы — катион и анион. Такой
механизм называется ионным, или
гетеролитическим. Он при¬водит к
образованию органических катионов или
анионов:
Органические
ионы вступают в дальнейшие превращения.
При этом катионы взаимодействуют с
нуклеофильными («любящими ядра»)
частицами (Н2О, NH3, Сl-, Br-, I- и другие анионы
кислот и т.п.), а органические анионы —
с электрофильными («любящими электроны»)
частицами (H+, катионы металлов, галогены
и др.), например: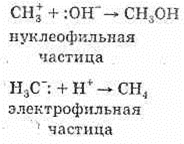
Ионный механизм наблюдается, как правило, при разрыве полярной ковалентной связи (углерод — галоген, углерод — кис-лород и др.).
Органические ионные частицы подобны ионам в неорганичес¬кой химии — имеют соответствующие заряды. Однако они и резко отличаются: ионы неорганических соединений присутствуют в водных растворах постоянно, а органические ионные частицы возникают только в момент реакции. Поэтому во многих случаях правильнее говорить не о свободных органических ионах, а о сильно поляризованных молекулах.
В.В. Марковников посвятил много лет изучению химических свойств алкенов, т.е. гомологов этилена. Им опытным путем (эмпирически) был установлен механизм протекания реакций гидратации и гидрогалогенирования несимметричных гомологов этилена. правило Марковникова: при присоединению к несимметричным алкенам молекул сложных веществ с условной формулой НХ (где Х – это атом I, Br, Cl, F или гидроксильная группа ОН-) атом водорода становится к наиболее гидрогенизированному (содержащему больше всего атомов водорода) атому углерода при двойной связи, а Х – к наименее гидрогенизированному.
Правило Марковникова: примеры
Для того чтобы вам стал понятнее смысл правила Марковникова давайте рассмотрим его на конкретных примерах.
CH3-CH=CH2 + HCl ==== CH3-CHCl-CH3
В данной реакции происходит присоединение к пропену хлороводорода с образованием 2-хлор пропана. В ходе этой реакции, произошел разрыв двойной связи и хлор присоединился к менее гидрогенизированному атому углерода, т.е. к тому у которого имеется меньше водородных связей, а водород соответственно к более гидрогенизированному.Аналогичным образом будет протеать и реакция гидротации, т.е. присоединения молекул воды.
Присоединение против правила Марковникова идет в том случае, если реакцию проводят в присутствии перекисей (Н2О2 или ROOR). Тогда реакция протекает по другому механизму (свободнорадикальное присоединение):
Н3С–СН=СН2 + НBr ROOR Н3С–СН2–СН2Br
Для сопряженных диенов характерна способность образовывать в реакциях присоединения наряду с обычными 1,2-аддуктами продукты 1,4-присоединения.
