
- •1.2 Вопрос. Белки, понятие, биологическая роль в детском организме. Физико – химические
- •3.2 Вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
- •4.2 Вопрос. Простые белки: альбумины, глобулины, гистоны, протамины. Особенности их строения, биологическая роль в детском организме.
- •6.2 Вопрос. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •7.2 Вопрос. Связи, формирующие первичную структуру полинуклеотидных цепей. Вторичная структура днк и рнк
- •5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
- •1.3. Витамины. Определение. Номенклатура и классификация. Функции витаминов. Гиповитаминозы и авитаминозы. Причины (экзо-, эндогенные). Антивитамины, механизм действия
- •3.3. Витамин рр, строение и биологическая роль. Над-зависимые дегидрогеназы.
- •5.3. Витамин в2, строение, роль (фад, фмн), суточная потребность, признаки авитаминоза.
- •7.3.. Витамин «в12», биологическая роль, явления недостаточности. Внутренний фактор Касла , его роль в усвоении витамина в12.Суточная потребность
- •1.4. Ферменты. Биологическая роль в детском организме. Классификация и номенклатура ферментов. Особенности синтеза и секреции ферментов у детей.
- •2.4.Химическая природа и строение ферментов. Активный (каталитический) и аллостерический (регуляторный) центры. Строение простых и сложных ферментов (гидролазы, дегидрогеназы, трансаминазы)..
- •4.4. Активаторы ферментов: ионы металлов, частичный протеолиз, фосфолирование и дефосфолирование
- •5.4.Ингибиторы ферментов: обратимые и необратимые,конкурентные. Лекарственные препараты как ингибиторы ферментов.
- •6.4. Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Регуляция активности по принципу обратной связи.
- •8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
- •2.5.Гормоны передней, средней и задней доли гипофиза. , особенности биологического дей ствия. Симптомы гипо- и гиперпродукции.
- •3.5.Вторичные мессенджеры (внутриклеточные посредники) гормонов. Циклический амф, его образование и распад. Аденилатциклаза и фосфодиэстераза. Действие ц-амф на протеинкиназы (адреналин, глюкагон).
- •4.5.Кальций как вторичный мессенджер гормонов. Кальмодулин. Образование и действие инозитолтрифосфата (иф3)и диацилглицерола (даг) как внутриклеточных сигнальных компонентов действия гормонов
- •5.5. Гормоны коры надпочечников. Химическое строение. Изменение метаболизма при гипер-, гипокортицизме (болезнь Аддисона, болезнь Иценко-Кушинга).
- •7.5. Половые гормоны, строение, влияние на обмен веществ и функции половых желез
- •2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
- •3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
- •V комплекс – атф-синтаза.
- •4.7.Анаэробный распад глюкозы ( гликолиз),значение анаэробного распада глюкозы. Эффект Пастера.
- •6.7. Представление о пентозофосфатном пути превращений глюкозы. Окислительная стадия (до образования рибозо-5-фосфат). Распространение и физиологическое значение у детей. Регуляция.
- •7.7. Гликоген- резервный гомополисахарид. Биосинтез гликогена. Мобилизация гликогена с образованием глюкозы в печени. Регуляция процессов. Гликогенозы.
- •Роль желчных кислот
- •2.8. Ресинтез жиров в стенке кишечника. Состав и строение транспортных форм липидо(липопротеинов ).
- •3.8.Основные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), химическое строение, биологическая роль. Жировое перерождение печени. Липотропные факторы.
- •11.8. Лпнп и лпвп – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
- •9.8. Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
- •7.8. Классификация высших жирных кислот. Биологическая роль. Ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
- •8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
- •Нейтральные жиры.
- •3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
- •9.9. Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
- •3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
- •4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
- •1.11.Потребность детского организма в воде и минеральных элементах. Обмен кальция, фосфора, калия, натрия, серы в организме. Регуляция водно – солевого обмена.
- •1.12. Моча, физико-химические свойства. Особенности состава мочи у новорожденных и детей грудного возраста. Патологические составные части. Клиническое значение анализа мочи у детей.
5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
Сложные белки содержат два компонента: белковую и небелковую части, называемые простетической группой. В зависимости от характера этой группы различают: хромопротеины, нуклеопротеины, металлопротеины, фосфопротеины, гликопротеины,липопротеины. Нуклеопротеины состоят из белков и нуклеиновых кислот. В природе обнаружено 2 типа нуклеопротеинов- дезоксирибонуклеопротеины(ДНП) и рибонуклеопротеины(РНП). Их названия отражают только природу углеводного компонента, входящего в состав нуклеиновых кислот. Доказано, что ДНП преимущественно локализованы в ядре, а РНП в цитоплазме.В тоже время ДНП открыты в митохондриях, а в ядоах и ядрышках обнаружены также высокомолекулярные РНК.
Многообразие проявлений жизни непосредственно связано с этими полимерными молекулами. Природа синтезированных в клетках белков зависит в первую очередь от природы ДНП, а точнее ДНК, а свойства живых организмов, как и структурная организация субклеточных органелл, клеток и целостного организма, определяются свойствами синтезированных белков. ДНК хранит наследственную информацию. При трансформации происходит превращение одного генетического типа клеток в другой путем изменения природы ДНК.С нуклеопротеинами и соответственно нуклеиновыми кислотами непосредственно связаны такие биологические процессы, как митоз, мейоз. Эмбриональный и злокачественный рост и др В состав хроматина входит ДНК, пять различных классов белков- гистонов и так называемых негистоновых белков.Относительно белкового состава ДНК, известно, что все 5 классов гистонов различаются по размерам, аминокислотному составу и величине заряда(всегда +).
В различных нуклеопротеинах количество нуклеиновой кислоты колеблется от 40 до 65%.
8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
Хромопротеины. Их подклассом являются гемопротеины, к которым относятся гемоглобин (Нb), миоглобин, цитохромы, каталаза.
Нb
А1 имеет четвертичную структуру. Его
молекулярная масса равна 66 000-68 000. Глобин
- это белковая часть, состоящая из 4-х
субъединиц, а каждая из субъединиц
обозначается α, β. Всего 2 α-цепи, содержащие
по 141 аминокислотному остатку и 2 β- по
146 аминокислот. Вторичные их структуры
представлены в виде спиральных сегментов
различной длины. Третичные структуры
α- и β-цепей очень сходны. Внутри каждой
субъединицы имеется гидрофобный
"карман", в котором удерживается
гем, благодаря ван-дер-ваальсовым связкам
между неполярными участками гема и
гидрофобными радикалами аминокислот
(этих связей около 60). Гем - это
тетрапиррольное соединение с атомом
Fе+2,
соединенного с азотами пирролов, 5-я
связь с имидазольным кольцом гистидина
глобина. Шестая координационная связь
Fе+2
свободна и используется для связывания
кислорода и других лигандов.
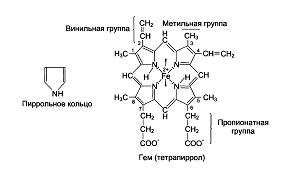
Белковая часть молекулы Нb влияет на свойства гема. Молекула Нb взаимодействует с различными лигандами. Очень высоко сродство Нb к оксиду углерода (II) - СО примерно в 300 раз больше, чем к О2, что говорит о высокой токсичности угарного газа. Эта форма носит название карбоксигемоглобина, Fe+2 не меняет валентности. При действии окислителей (например, нитрата натрия) образуется метгемоглобин, в котором Fe в степени окисления +3. Появление метгемоглобина в больших количествах вызывает кислородное голодание тканей. Наилучшим методом распознавания отдельных производных гемоглобина является исследование их спектров поглощения.
Возможно образование еще одного производного Нb - карбгемоглобина, когда Нb связывается с СО2, однако СО2 присоединяется не к гему, а к NH2 - группам глобина (НbNH2+СО2→ НbNHCOO-+Н+). Образование карбгемоглобина используется для выведения СО2 из тканей к легким. Этим путем выводится 10-15% СО2.
Гемоглобины могут различаться по белковой части, в связи с этим существуют физиологические и аномальные типы Нb.
Физиологические Нb образуются на разных этапах нормального развития организма, а аномальные - вследствие нарушений последовательности аминокислот в глобине.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей. Различают гемоглобины взрослых Нb А1 (96%), Нb А2 (2-3%), состоящий из 4 субъединиц: двух α-цепей и двух δ-цепей. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей (1-2%). Нb А2 и Нb F обладают большим сродством к кислороду, чем Нb А1.
Общая группа заболеваний, связанная с Нb, носит название гемоглобинозов. Различают среди них гемоглобинопатии, например серповидноклеточная анемия, когда происходит замена при синтезе β-цепи в 6-ом положение глутаминовой кислоты на валин в β-цепях молекулы гемоглобина S. Эритроциты приобретает форму серпа, понижается сродство к О2. Болезнь протекает остро, и дети, гомозиготные по мутатному гену, часто умирают в детском возрасте.
Талассемия - это заболевание, при котором полностью нарушается синтез либо цепи α или β (отсюда и название α-талассемия или β-талассемия). При β-талассемии в крови наряду с HbA1 появляется до 15% НЬА2 и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму.
Миоглобин имеет третичную структуру и представляет собой одну цепь Нb (153 аминокислоты). В отличие от Нb он в 5 раз быстрее связывает О2. Кривая насыщения имеет вид гиперболы. В этом кроется большой биологический смысл, поскольку миоглобин находится в глубине мышечной ткани (где низкое парциальное давление О2). Связывая О2, миоглобин создает кислородный резерв, который расходуется по мере необходимости, восполняя временную нехватку О2.
Одним из основных механизмов повреждения тканей, в частности, при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Некоторые белки в норме содержат углеводные компоненты, причем образование таких гликопротеинов протекает ферментативно. Однако в организме человека может происходить и неферментативоне взаимодействие глюкозы со свободными аминогруппами белков- неферментативное гликозилирование белков. Неферментативное гликозилирование четко связано с гипергликемией. Это бывает при нарушении углеводного обмена, когда количество глюкозы в крови значительно больше нормы и, прежде всего, при сахарном диабете. Глюкоза крови при сахарном диабете в отсутствие инсулина не может проникнуть в ткани организма и связывается (ее альдегидная форма) с различными белками. Белки в этих комплексах меняют свои физико-химические свойства, при этом уменьшаются или теряются функции, выполняемые этими белками. Известны гликозилированный гемоглобин, гликозилированный альбумин, гликозилированный коллаген, гликозилированные липопротеины.
Гликозилирование гемоглобина идет в 2 этапа:
Глюкоза неферментативно соединяется своей карбонильной группой с N-концевым остатком бета-цепей валина. Эта стадия обратима.
Гликозилированный гемоглобин подвергается переустройству с образованием кетоамина. Эта стадия необратимая.
Известно, что эритроциты больных сахарным диабетом содержат процент минорного компонента Нb, так называемый гликозилированный Нb (Нb А1с).
К патогенезу осложнения диабета можно отнести тот факт, что у больных увеличивается количество Нb А1с (до 12-15%) по сравнению с допустимой концентрацией 4-6%. Так, при недостаточно компенсированном диабете общее соединение Нb А1с превышает 12%. Гликозилированный гемоглобин отражает процент гемоглобина крови, необратимо соединённый с молекулами глюкозы. Повышение уровня глюкозы крови при сахарном диабете значительно ускоряет данную реакцию, что приводит к повышению уровня гликозилированного гемоглобина в крови. Время жизни эритроцитов, которые содержат гемоглобин, составляет в среднем 120—125 суток. Именно поэтому уровень гликозилированного гемоглобина отражает средний уровень гликемии на протяжении примерно трёх месяцев. Чем выше уровень гликозилированного гемоглобина, тем выше была гликемия за последние три месяца и, соответственно, больше риск развития осложнений сахарного диабета.
Поражение сердечно-сосудистой системы является клиническим проявлением сахарного диабета. Микроангиопатия является причиной инвалидности и смерти больных. В возникновении микроангиопатий определенную роль играет гликозилирование белков, что приводит к возникновению нефро- и ретинопатии (катаракта, нарушение функции почек)
Коллаген составляет основу базальных мембран капилляров. Повышенное содержание гликозилированного коллагена ведет к уменьшению его эластичности, растворимости, к преждевременному старению, развитию контрактур. В почках такие изменения приводят к запустению клубочков и хронической почечной недостаточности.
Гликозилированные липопротеины, накапливаясь в сосудистой стенке, приводят к развитию гиперхолестеринемии и липидной инфильтрации. Они служат основой атером, происходит нарушение сосудистого тонуса, что приводит к атеросклерозу.
