
- •1.2 Вопрос. Белки, понятие, биологическая роль в детском организме. Физико – химические
- •3.2 Вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
- •4.2 Вопрос. Простые белки: альбумины, глобулины, гистоны, протамины. Особенности их строения, биологическая роль в детском организме.
- •6.2 Вопрос. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •7.2 Вопрос. Связи, формирующие первичную структуру полинуклеотидных цепей. Вторичная структура днк и рнк
- •5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
- •1.3. Витамины. Определение. Номенклатура и классификация. Функции витаминов. Гиповитаминозы и авитаминозы. Причины (экзо-, эндогенные). Антивитамины, механизм действия
- •3.3. Витамин рр, строение и биологическая роль. Над-зависимые дегидрогеназы.
- •5.3. Витамин в2, строение, роль (фад, фмн), суточная потребность, признаки авитаминоза.
- •7.3.. Витамин «в12», биологическая роль, явления недостаточности. Внутренний фактор Касла , его роль в усвоении витамина в12.Суточная потребность
- •1.4. Ферменты. Биологическая роль в детском организме. Классификация и номенклатура ферментов. Особенности синтеза и секреции ферментов у детей.
- •2.4.Химическая природа и строение ферментов. Активный (каталитический) и аллостерический (регуляторный) центры. Строение простых и сложных ферментов (гидролазы, дегидрогеназы, трансаминазы)..
- •4.4. Активаторы ферментов: ионы металлов, частичный протеолиз, фосфолирование и дефосфолирование
- •5.4.Ингибиторы ферментов: обратимые и необратимые,конкурентные. Лекарственные препараты как ингибиторы ферментов.
- •6.4. Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Регуляция активности по принципу обратной связи.
- •8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
- •2.5.Гормоны передней, средней и задней доли гипофиза. , особенности биологического дей ствия. Симптомы гипо- и гиперпродукции.
- •3.5.Вторичные мессенджеры (внутриклеточные посредники) гормонов. Циклический амф, его образование и распад. Аденилатциклаза и фосфодиэстераза. Действие ц-амф на протеинкиназы (адреналин, глюкагон).
- •4.5.Кальций как вторичный мессенджер гормонов. Кальмодулин. Образование и действие инозитолтрифосфата (иф3)и диацилглицерола (даг) как внутриклеточных сигнальных компонентов действия гормонов
- •5.5. Гормоны коры надпочечников. Химическое строение. Изменение метаболизма при гипер-, гипокортицизме (болезнь Аддисона, болезнь Иценко-Кушинга).
- •7.5. Половые гормоны, строение, влияние на обмен веществ и функции половых желез
- •2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
- •3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
- •V комплекс – атф-синтаза.
- •4.7.Анаэробный распад глюкозы ( гликолиз),значение анаэробного распада глюкозы. Эффект Пастера.
- •6.7. Представление о пентозофосфатном пути превращений глюкозы. Окислительная стадия (до образования рибозо-5-фосфат). Распространение и физиологическое значение у детей. Регуляция.
- •7.7. Гликоген- резервный гомополисахарид. Биосинтез гликогена. Мобилизация гликогена с образованием глюкозы в печени. Регуляция процессов. Гликогенозы.
- •Роль желчных кислот
- •2.8. Ресинтез жиров в стенке кишечника. Состав и строение транспортных форм липидо(липопротеинов ).
- •3.8.Основные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), химическое строение, биологическая роль. Жировое перерождение печени. Липотропные факторы.
- •11.8. Лпнп и лпвп – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
- •9.8. Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
- •7.8. Классификация высших жирных кислот. Биологическая роль. Ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
- •8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
- •Нейтральные жиры.
- •3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
- •9.9. Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
- •3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
- •4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
- •1.11.Потребность детского организма в воде и минеральных элементах. Обмен кальция, фосфора, калия, натрия, серы в организме. Регуляция водно – солевого обмена.
- •1.12. Моча, физико-химические свойства. Особенности состава мочи у новорожденных и детей грудного возраста. Патологические составные части. Клиническое значение анализа мочи у детей.
3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
К ним относятся конечные продукты обмена: мочевина – 50%, аминокислоты – 25%, мочевая кислота, креатин, креатинин, билирубин, индикан, холин, нуклеотиды, полипептиды. Азот, входящий в состав этих соединений - «остаточный азот», т.е. остающийся в фильтрате после осаждения белков.
В норме - 14,2-28,4 ммоль/л. При некоторых заболеваниях эта величина повышается (азотемия).
Азотемия:
1.Ретенционная – почечная и внепочечная (сердечно-сосудистая недостаточность, снижение АД, снижение почечного кровотока).
2.Продукционная – усиленный распад белков тканей: злокачественные новообразования, ожоги, кахексия.
В настоящее время вместо остаточного азота крови определяют содержание мочевины и креатинина.
В норме: Мочевина- 3,3-8,3 ммоль/л
Креатинин-0,044-0,11 ммоль/л
4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
Гемоглобин, освобождающийся из эритроцитов, которые разрушаются через 120 дней, в крови соединяется с гаптоглобином –α2-глобулин и транспортируется в клетки РЭС, главным образом селезенки. Здесь Нb окисляется в метгемоглобин, а затем подвергается распаду. При этом гаптоглобин отщепляется и переходит в кровь.
Под действием гемоксигеназы происходит расщепление α-метинового мостика гема, соединяющего два соседних пиррольных кольца. Кольцевая структура гема разрывается и образуется вердоглобин. От вердоглобина отщепляется железо, которое связывается с белком – трансферином и доставляется с кровью в печень и глобин. Глобин гидролизуется катепсинами селезенки до аминокислот и в результате образуется биливердин – желчный пигмент зеленого цвета, который восстанавливается при участии биливердинредуктазы в билирубин – желчный пигмент красно-желтого цвета. Он является токсичным, неконъюгированным (не связанным с глюкуроновой кислотой), непрямым (так как не может давать прямую реакцию с диазореактивом), плохо растворим в воде и крови и поэтому, транспортируется в печень в комплексе с альбумином. Одна молекула альбумина свободно присоединяет 10-35 молекул билирубина. Вследствие прочной связи с белком, билирубин не экскретируется с мочой.
В печени под действием УДФ – глюкуронилтрансферазы билирубин взаимодействует с глюкуроновой кислотой (в составе УДФ-ГК) образуется билирубинглюкуронид – конъюгированный, прямой, нетоксичный и хорошо растворимый в воде.
Билирубинглюкурониды лишь в незначительных количествах могут диффундировать в кровеносные капилляры. Поэтому в плазме крови присутствуют две формы билирубина: неконъюгированный – 75% и конъюгированный – 25%,- которые вместе составляют общий билирубин. Концентрация общего билирубина в крови здорового человека - 3,5-19 мкмоль/л, у грудных детей – 3,4-14 мкмоль/л.
В составе желчи прямой билирубин секретируется в 12-перстную кишку, где под действием гидролаз бактерий происходит отщепление глюкуроновой кислоты.
В тонком кишечнике билирубин под действием бактерий превращается в мезобилиноген (уробилиноген). Часть мезобилиногена всасывается в кишечнике и по воротной вене поступает в печень, где полностью расщепляется до моно- и дипирролов.
Большая часть мезобилиногена из тонкой кишки поступает в толстый кишечник, где под действием анаэробных бактерий восстанавливается до стеркобилиногена, который, как и уробилиноген, бесцветен.
Основная часть стеркобилиногена, выделяемая с каловыми массами, окисляется на воздухе в стеркобилин – оранжево-желтый пигмент, определяющий цвет каловых масс. В сутки с калом выделяется до 250 мг стеркобилина. Небольшая часть стеркобилиногена всасывается в прямой кишке, через систему геморроидальных вен поступает в нижнюю полую вену и через почки выводится с мочой. Стеркобилиноген мочи окисляется в стеркобилин, частично определяя нормальный соломенно-желтый цвет мочи. В сутки с мочой выделяется 1-4 мг стеркобилина.
5.10. Желтухи: гемолитическая, обтурационная, паренхиматозная. Желтуха новорожденных. Диагностическое значения определения билирубина и других желчных пигментов в крови, моче и кале. Под влиянием различных факторов в организме может нарушаться образование и выведение билирубина и продуктов его метаболизма. Повышение содержания билирубина в крови ведет к отложению его в тканях, в том числе в слизистых оболочках и коже, вызывая их окрашивание в желтый цвет – возникновению желтухи.
В дифференциальной диагностике желтух различной этиологии важное значение имеет определение содержания желчных пигментов в крови, моче и кале.
Различают несколько видов желтух.
Гемолитическая желтуха
Возникает в результате усиленного гемолиза эритроцитов. Причины возникновения:
серповидноклеточная анемия, талассемии, стимулирующие гемолиз, переливания несовместимых групп крови и т.д. В результате при распаде Нb образуется большое количество непрямого, токсичного билирубина, который в печени не успевает конъюгироваться. Неконъюгированный билирубин не выделяется с мочой, так как он нерастворим в воде.
Для гемолитической желтухи характерны:
гипербилирубинемия за счет неконъюгированного билирубина;
увеличение содержания стеркобилина в кале и моче. В результате кал становится почти темного цвета, а моча окрашивается в интенсивно оранжево-желтый цвет.
Желтуха новорожденных
Желтуха новорожденных (гемолитическая желтуха) считается физиологической. Она возникает вследствии:
недостатка синтеза фермента конъюгации билирубина – УДФ – глюкуронилтрансферазы;
недостаточного образования УДФ – глюкуроновой кислоты;
Это приводит к повышению в крови уровня неконъюгированного, токсичного билирубина.
Желтуха обычно проходит через 3-5 дней. У недоношенных детей - продолжается дольше. Длительное повышение неконъюгированного билирубина может быть опасным, вследствие токсического действия билирубина на развивающийся мозг (билирубиновая энцефалопатия). У взрослых клетки мозга малопроницаемы для билирубина и, как правило, осложнений при гипербилирубинемии не происходит.
Обтурационная желтуха
Возникает в результате нарушения оттока желчи в кишечник.
Причины: закупорка или сдавление общего печеночного протока камнем или опухолью головки поджелудочной железы, некоторые формы вирусного гепатита и др.
Обтурационная желтуха сопровождается высоким содержанием в крови конъюгированного билирубина, вследствие того, что желчь не поступает в кишечник и билирубин всасывается из печени в кровь. Так как конъюгированный билирубин – водорастворимое соединение, он в больших количествах выделяется с мочой. Из-за этого моча имеет цвет пива с ярко-желтой пеной. Одновременно и в кале, и в моче снижается содержание стеркобилина. Кал приобретает серовато-белый, глинистый цвет.
Паренхиматозная желтуха
Возникает вследствие повреждения паренхимы печени (инфекционный и токсический гепатиты, цирроз печени и т.д.).
Повреждение гепатоцитов снижает захват ими неконъюгированного билирубина из крови и интенсивность образования в них конъюгированного билирубина. Поэтому, не смотря на нормальный гемолиз, повышается (но не так выражено, как при гемолитической желтухе) содержание неконъюгированного, а также конъюгированного билирубина (застой желчи). В каловых массах и в моче снижается содержание стеркобилина. Кал слабо окрашен. В моче появляется уробилин и небольшое содержание конъюгированного билирубина.
6.10. Свертывающая система крови. Этапы образования фибринового сгустка. Внутренний и внешний пути свертывания. Роль фибронектина и трансглутаминазы. Роль витамина К в свертывании крови. Основные механизмы фибринолиза. Противосвертывающая система. Естественные антикоагулянты крови (антитромбин, гепарин).
Система свертывания крови представляет собой каскадную цепь протеолитических реакций.
Каскадность реакций обеспечивает постепенное усиление первоначального слабого сигнала – воздействия, вызывающего активацию внутреннего и внешнего пусковых механизмов свертывания. Каждая последующая стадия приводит к образованию все больших количеств активной формы очередного фактора. Происходит лавинообразное нарастание «мощности» каждой следующей ступени каскада, в результате стадия превращения фибриногена в фибрин протекает очень быстро.
Первая стадия – сокращение поврежденного сосуда.
Вторая стадия – образование белого тромба. Протромбин (VII фактор) под действием тромбопластина (III) тромбоцитов и ионов кальция (IV) превращается в активную форму – тромбин. В этой стадии участвуют факторы внешнего пускового механизма свертывания: проконвертин (VII); проакцелерин (V); фактор Стюарта (Х), а также факторы внутреннего пускового механизма свертывания: фактор Кристмаса (IХ); фактор Розенталя (ХI); фактор Хагемана (ХII)
Третья стадия – образование красного тромба. Тромбин активирует фибриноген (I), превращая его в активную форму фибрин – мономер. Затем образуется фибрин – полимер (фибриновый гель), который не отличается прочностью. Его легко может разрушить механическое воздействие. Под действием фермента трансглутаминазы (ХIIIa) образуются прочные ковалентные связи между мономерами фибрина, а также между фибрином и белком фибронектином, стабилизируя гель фибрина.
Через час тромб сжимается (ретракция тромба). Затем происходит фибринолиз (четвертая стадия). Плазминоген под действием фермента урокиназы и тканевого активатора плазминогена (ТАП) превращается в активную форму – плазмин (частичный протеолиз), который расщепляет в фибрине – полимере пептидные связи.
Тромб в течение нескольких дней рассасывается.
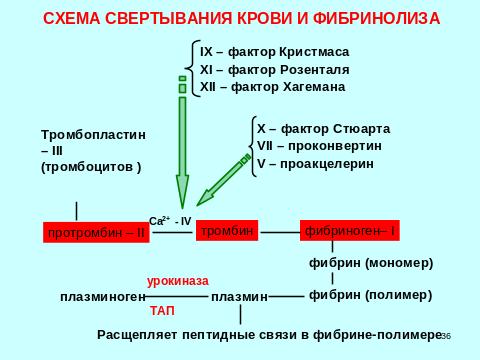
Витамин К входит в состав ферментов, катализирующих карбоксилирование глутаминовой кислоты с образованием γ-карбоксиглутаминовой кислоты, входящей в состав факторов свертывания крови: II, VII, IХ, Х.
Противосвертывающая система.
Ингибиторы факторов свертывания крови:
белок плазмы антитромбин III, инактивирующий большинство факторов свертывания крови;
другие белки – ингибиторы протеиназ (α- макроглобулин, антиконвертин, тромбомодулин).
Антикоагулянты:
гепарин, активирующий антитромбин III;
антивитамины К – дикумарин, неодикумарин и др.
