- •1.2 Вопрос. Белки, понятие, биологическая роль в детском организме. Физико – химические
- •3.2 Вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
- •4.2 Вопрос. Простые белки: альбумины, глобулины, гистоны, протамины. Особенности их строения, биологическая роль в детском организме.
- •6.2 Вопрос. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •7.2 Вопрос. Связи, формирующие первичную структуру полинуклеотидных цепей. Вторичная структура днк и рнк
- •5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
- •1.3. Витамины. Определение. Номенклатура и классификация. Функции витаминов. Гиповитаминозы и авитаминозы. Причины (экзо-, эндогенные). Антивитамины, механизм действия
- •3.3. Витамин рр, строение и биологическая роль. Над-зависимые дегидрогеназы.
- •5.3. Витамин в2, строение, роль (фад, фмн), суточная потребность, признаки авитаминоза.
- •7.3.. Витамин «в12», биологическая роль, явления недостаточности. Внутренний фактор Касла , его роль в усвоении витамина в12.Суточная потребность
- •1.4. Ферменты. Биологическая роль в детском организме. Классификация и номенклатура ферментов. Особенности синтеза и секреции ферментов у детей.
- •2.4.Химическая природа и строение ферментов. Активный (каталитический) и аллостерический (регуляторный) центры. Строение простых и сложных ферментов (гидролазы, дегидрогеназы, трансаминазы)..
- •4.4. Активаторы ферментов: ионы металлов, частичный протеолиз, фосфолирование и дефосфолирование
- •5.4.Ингибиторы ферментов: обратимые и необратимые,конкурентные. Лекарственные препараты как ингибиторы ферментов.
- •6.4. Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Регуляция активности по принципу обратной связи.
- •8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
- •2.5.Гормоны передней, средней и задней доли гипофиза. , особенности биологического дей ствия. Симптомы гипо- и гиперпродукции.
- •3.5.Вторичные мессенджеры (внутриклеточные посредники) гормонов. Циклический амф, его образование и распад. Аденилатциклаза и фосфодиэстераза. Действие ц-амф на протеинкиназы (адреналин, глюкагон).
- •4.5.Кальций как вторичный мессенджер гормонов. Кальмодулин. Образование и действие инозитолтрифосфата (иф3)и диацилглицерола (даг) как внутриклеточных сигнальных компонентов действия гормонов
- •5.5. Гормоны коры надпочечников. Химическое строение. Изменение метаболизма при гипер-, гипокортицизме (болезнь Аддисона, болезнь Иценко-Кушинга).
- •7.5. Половые гормоны, строение, влияние на обмен веществ и функции половых желез
- •2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
- •3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
- •V комплекс – атф-синтаза.
- •4.7.Анаэробный распад глюкозы ( гликолиз),значение анаэробного распада глюкозы. Эффект Пастера.
- •6.7. Представление о пентозофосфатном пути превращений глюкозы. Окислительная стадия (до образования рибозо-5-фосфат). Распространение и физиологическое значение у детей. Регуляция.
- •7.7. Гликоген- резервный гомополисахарид. Биосинтез гликогена. Мобилизация гликогена с образованием глюкозы в печени. Регуляция процессов. Гликогенозы.
- •Роль желчных кислот
- •2.8. Ресинтез жиров в стенке кишечника. Состав и строение транспортных форм липидо(липопротеинов ).
- •3.8.Основные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), химическое строение, биологическая роль. Жировое перерождение печени. Липотропные факторы.
- •11.8. Лпнп и лпвп – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
- •9.8. Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
- •7.8. Классификация высших жирных кислот. Биологическая роль. Ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
- •8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
- •Нейтральные жиры.
- •3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
- •9.9. Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
- •3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
- •4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
- •1.11.Потребность детского организма в воде и минеральных элементах. Обмен кальция, фосфора, калия, натрия, серы в организме. Регуляция водно – солевого обмена.
- •1.12. Моча, физико-химические свойства. Особенности состава мочи у новорожденных и детей грудного возраста. Патологические составные части. Клиническое значение анализа мочи у детей.
3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
Гниение белков в кишечнике: под влиянием микрофлоры нижнего отдела кишечника некоторые аминокислоты могут подвергаться превращениям до аминов, жирных кислот, спиртов, фенолов, сероводорода и др.
Общее направление этих реакций:
При декарбоксилировании аминокислот возможно образование соответствующих нередко ядовитых аминов.
При дезаминировании возникают насыщенные и ненасыщенные кислоты, кетокислоты, оксикислоты.
Путресцин образуется при декарбоксилировании орнитина, а кадаверин – из лизина. Они относятся к группе трупных ядов. Выводятся из организма через почки с мочой почти в неизменном виде. Выделение путресцина и кадаверина с мочой наблюдается при холере, дизентерии и т.д.
Фенол и крезол образуются из тирозина. После всасывания они обезвреживаются в печени. Происходит это либо за счет связывания с Н2SО4, либо с глюкуроновой кислотой. В результате образуются парные серные-, фенол- или крезолглюкуроновые кислоты. Они называются еще эфиро-серными кислотами и являются постоянными составными частями мочи. Серная кислота присоединяется в виде активной формы, формируя фосфоаденин фосфосульфат (ФАФС), глюкуроновая кислота – уридиндифосфат глюкуроновой кислоты (УДФГК).
Индол и скатол образуется при декарбоксилировании из триптофана. Они обусловливают специфический запах кала, являются ядовитыми веществами и обезвреживаются в печени. Индол связывается в виде эфирсерной кислоты калиевая соль этой кислоты получила название животного индикана, который выводится с мочой и по его количеству судят не только о скорости процесса гниения, но и о функциональном состоянии печени.
Пути использования аминокислот после всасывания:
Синтез специфических белков тканей, плазмы крови, ферментов, гормонов.
Синтез углеводов (глюконеогенез).
Синтез липидов.
Синтез гистамина, серотонина, креатина, порфиринов, холина, адреналина, пуриновых, пиримидиновых нуклеотидов.
Синтез мочевины.
Оставшиеся неиспользованные аминокислоты подвергаются распаду с выделением энергии (10-15%).
Общие пути распада аминокислот:
Декарбоксилирование;
Трансаминирование;
Дезаминирование;
4.9. Трансаминирование аминокислот. Роль трансаминаз( аланинтрансаминаза,аспартаттрансаминаза),кофермента-пиридоксальфосфата. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови в диагностике инфаркта миокарда, заболеваниях печени.
Трансаминирование – процесс переноса аминогруппы с α-аминокислоты на кетокислоту при участии ферментов трансаминаз (В6 – фосфопиридоксаль). Этому процессу подвергаются все аминокислоты, кроме лизина, треонина и пролина.
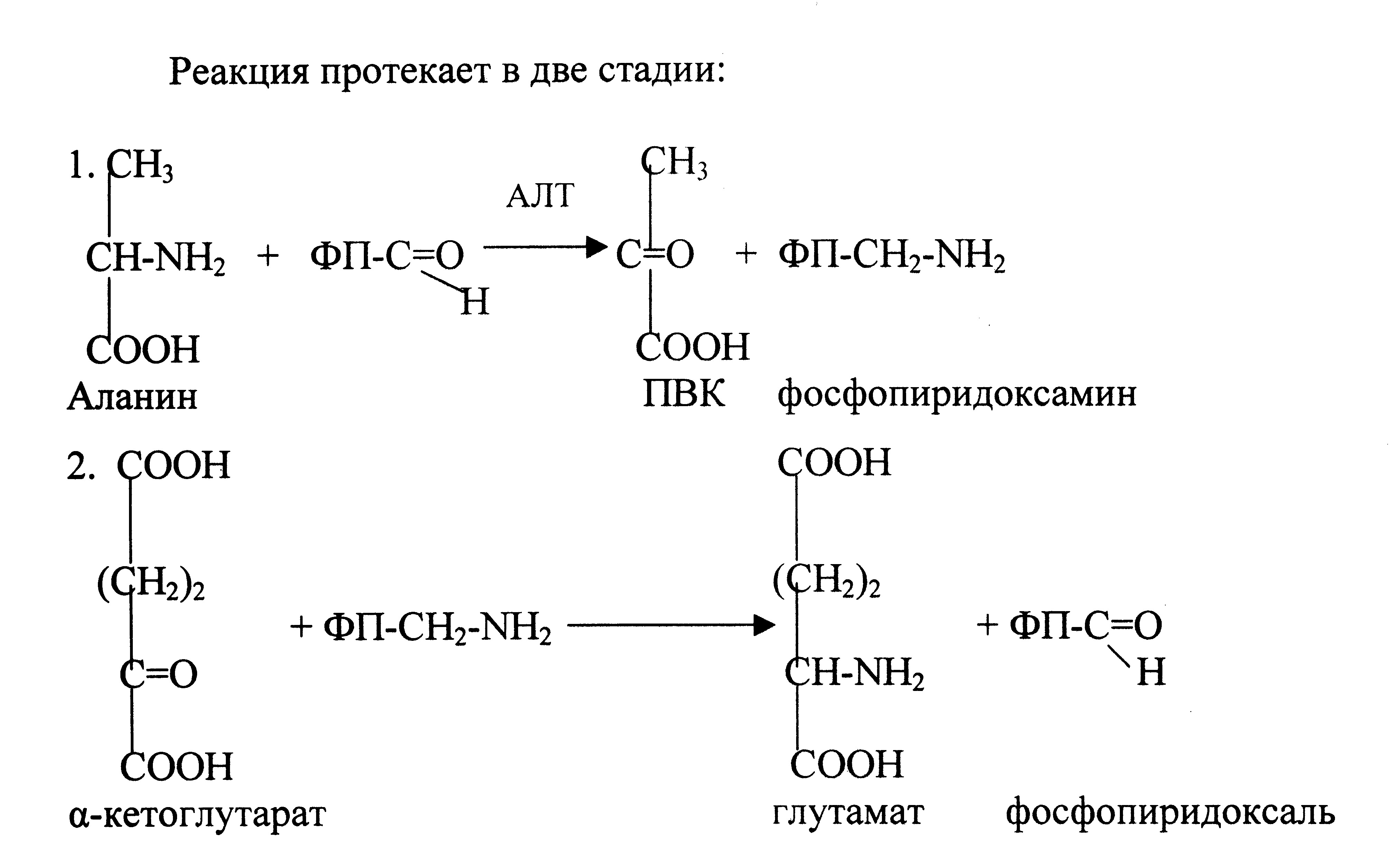
Реакцию трансаминирования катализируют высокоактивные аминотрансферазы: аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ), которые обладают субстратной специфичностью.
АЛТ и АСТ – органоспецифические ферменты, в норме в крови их активнрсть равна 5-40 ЕД/л, т.е. активность трансаминаз сравнительно низкая. При заболеваниях, сопровождающихся деструкцией (некрозом) клеток, происходит выход ферментов в кровь и повышение их активности. Определение активности АЛТ и АСТ имеет большое диагностическое значение. Для дифференциальной диагностики заболеваний печени и сердца определяют соотношение активности АСТ/АЛТ в сыворотке крови – «коэффициент де Ритиса», который в норме составляет 1,33±0,42.
При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ – в2-4 раза. «Коэффициент де Ритиса» уменьшается примерно до 0,6. Особенно важное значение для диагностики имеет повышение активности АЛТ при безжелтушных формах вирусного гепатита. У детей при гепатитах активность АЛТ возрастает еще в дожелтушный период развития болезни. Однако, при церрозе печени «Коэффициент де Ритиса» приближается к 1,0, что свидетельствует о некрозе клеток, при котором в кровь выходят обе фракции (цитоплазматическая и митохондриальная).
При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а АЛТ – в 1,5 -2,0 раза. Значение «Коэффициента де Ритиса» резко возрастает. Инфекционные и токсические миокардиты характеризуются повышением АСТ, это же самое наблюдается при операциях на сердце.
При стенокардии, пороках сердца, инфаркте легкого активность аминотрансфераз в крови не возрастает.
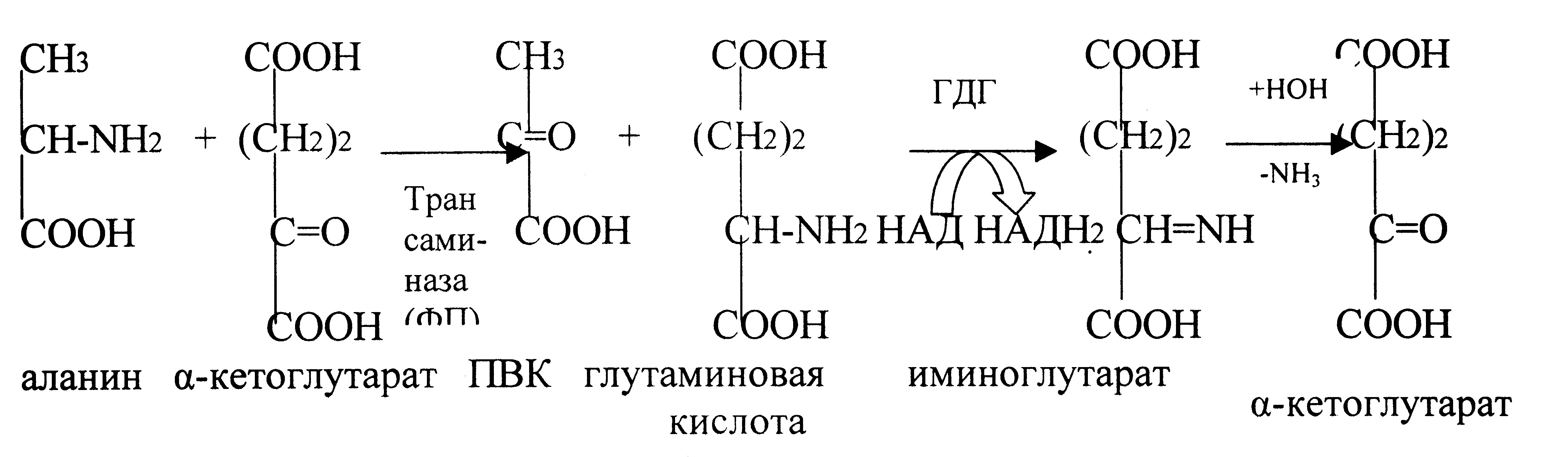
5.9.Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот( связь с трансаминированием). Дезаминирование – процесс потери аминокислотой аминогруппы. В организме подвергается этому процессу только глутаминовая кислота, т.к. в организме активен фермент глутаматдегидрогеназа (ГДГ). Фермент ГДГ активен в митохондриях клеток всех органов, кроме мышечной ткани.
1. Окислительное дезаминирование.
NН
СООН – СН2 – СН2 – С – СООН
Н
 ООС–СН2-
СН2
- СН – СООН
ООС–СН2-
СН2
- СН – СООН
 NН2
NН2
О
ГДГ +НОН СООН-СН2-СН2-С-СООН
г
 лутаминовая
кислота иминоглутарат
NН3
+ -
лутаминовая
кислота иминоглутарат
NН3
+ -
α-кетоглутаровая кислота
 НАД
НАД
НАДН2
Остальные аминокислоты подвергаются непрямому дезаминированию.
2. Непрямое дезаминирование – это процесс дезаминирования путем трансаминирования.
6.9. Основные источники аммиака в детском организме. Роль глутамина в обезвреживании и транспорте аммиака. Судьба аммиака в организме. Биосинтез мочевины( орнитиновый цикл). Нарушение синтеза и выведения мочевины. Гипераммониемия.
Аммиак в организме образуется в результате дезаминирования аминокислот, биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение). Концентрация аммиака в крови в норме – 0,4-0,7мг/л. Это токсичное соединение, поэтому аммиак не накапливается, а вступает в реакцию с глутаминовой или аспарагиновой кислотами с образованием индифферентной транспортной формы – глутамина или аспарагина.
+NН3
Н ООС-(СН2)2-СН-СООН
Н 2NОС-(СН2)2-СН-СООН
ООС-(СН2)2-СН-СООН
Н 2NОС-(СН2)2-СН-СООН
NН2 АТФ NН2
-Н 2О
глутаминовая кислота глутамин
+NН3
 НООС-СН2-СН-СООН
Н2NОС-СН2-СН-СООН
НООС-СН2-СН-СООН
Н2NОС-СН2-СН-СООН
АТФ
NН2 -Н 2О
NН2
аспарагиновая кислота аспарагин
В почках глутамин под влиянием глутаминазы расщепляется с образованием аммиака, идущего на нейтрализацию кислых соединений с образованием аммонийных солей. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов (Na+, K+) для поддержания осмотического давления. Глутамин – основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров, белков, глюкозы. Также источниками образования аммиака служат процессы:
дезаминирования биогенных аминов;
распад пиримидиновых оснований (урацил, тимин, цитозин);
дезаминирования аминокислот;
дезаминирования пуриновых оснований (гуанина и аденина).
Пути использования аммиака в организме:
Синтез аминокислот из соответствующих кетокислот:
АТФ
СН3-С-СООН + NН3 СН3-СН-СООН
О NН2
ПВК аланин
Синтез аммонийных солей в почках.
Синтез пуриновых и пиримидиновых нуклеотидов.
Синтез мочевины – основной путь обезвреживания аммиака.
ГИПЕРАММОНИЕМИЯ.
Повышение содержания аммиака в крови до 6000мкмоль/л (норма-60мкмоль/л) оказывает токсическое действие на организм.
Причины:
генетический дефект ферментов орнитинового цикла в печени;
вторичное поражение печени в результате цирроза, гепатита и др.
Симптомы: тошнота, повторяющаяся рвота, потеря сознания, отек мозга, отставание умственного развития. Все симптомы гипераммониемии – проявление действия аммиака на ЦНС.
Для диагностики производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активность ферментов печени.
Еще в прошлом веке русские ученые М.В. Ненцкий и С.С. Салазкин показали, что в печени происходит образование мочевины из углекислого газа и аммиака.
Кребс и Гензеляйт установили, что синтез мочевины представляет собой циклический процесс, в котором ключевым соединением, замыкающим цикл, является орнитин. Кохен и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата.
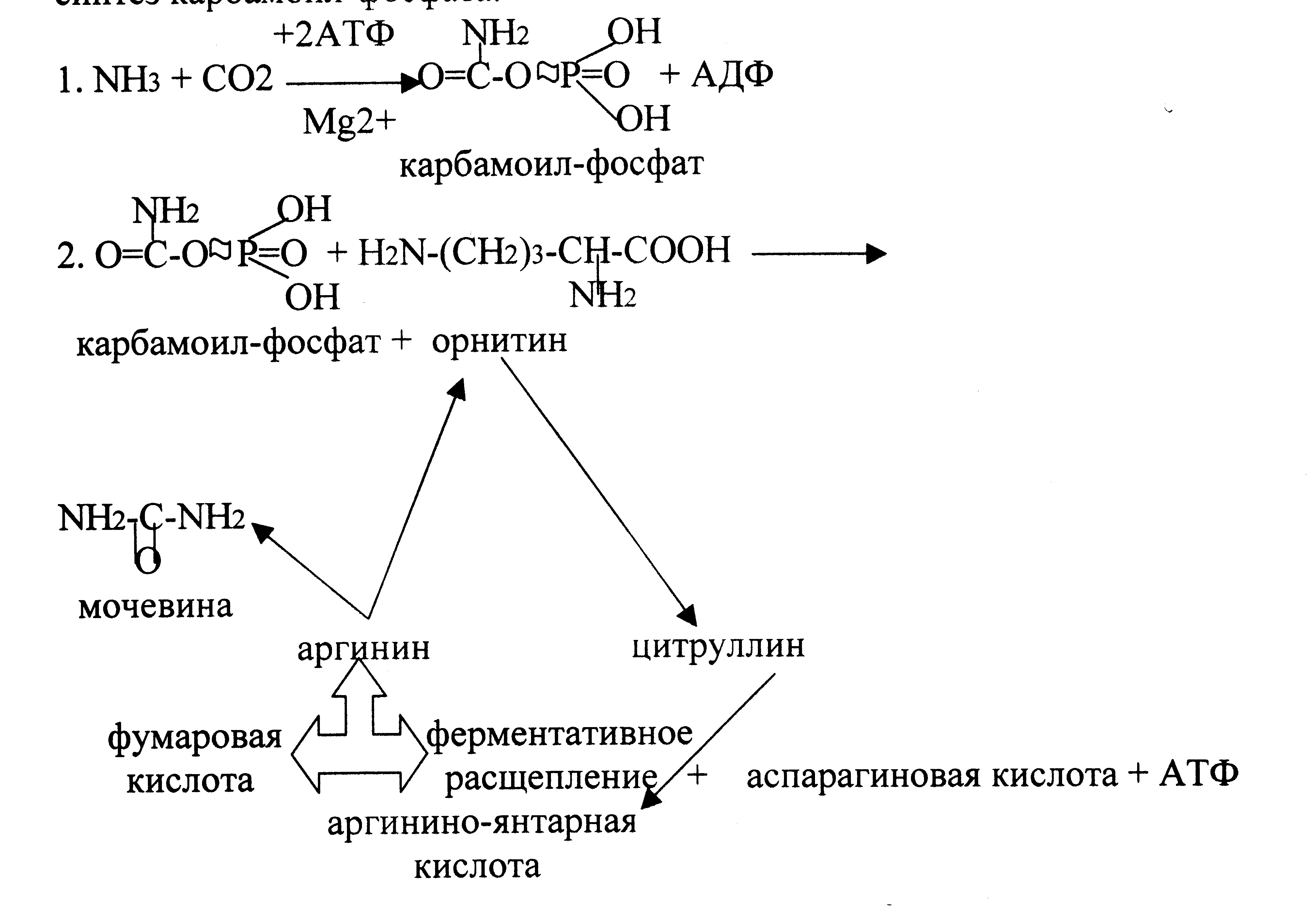
В печени аммиак связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Затем под действием орнитин-карбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на орнитин и образуется цитруллин. В следующей реакции аргининосукцинатсинтетаза связывает его с аспартатом и образуется аргининоянтарная кислота. Аспартат – источник второго атома азота мочевины. Далее происходит расщепление аргининоянтарной кислоты на аргинин и фумарат (идет в ЦТК). Аргинин гидролизуется под действием аргиназы на орнитин и мочевину. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции происходят в митохондриях гепатоцитов. Затем цитруллин транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Орнитиновый цикл в печени выполняет 2 функции:
1. превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных
продуктов - аммиака;
2. синтез аргинина и пополнение его в организме.
Отмечается, что у детей первых месяцев жизни функция печени развита недостаточно, что проявляется в том, что у ребенка количество аммиака по сравнению с взрослым человеком увеличено в 2-2,5 раза. У новорожденных – 20-30% общего азота падает на азот мочевины.
Мочевина – безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть ферменты мочевинообразования. В головном мозге имеются все ферменты синтеза мочевины, кроме карбамоилфосфатазы, поэтому в нем мочевина не образуется. Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. В норме экскрекция мочевины – 25-30 г/сут. При повышении количества потребляемых с пищей белков увеличивается выделение мочевины.
7.9. Обмен фенилаланина и тирозина. Врожденные нарушения обмена аминокислот. Фенилкетонурия, алкаптонурия, альбинизм причины проявления, их профилактика. Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, γ-аминомасляная кислота. Образование, функции. Инактивация биогенных аминов.
Причиной нарушений в обмене отдельных аминокислот служит полное или частичное выключение определенной ферментативной активности. При этом врожденном дефекте идет накопление большого количества промежуточных или побочных продуктов, оказывающих токсическое действие на организм, особенно на ЦНС. Вот почему, прежде всего, поражаются дети раннего возраста с последующим нарушением психической деятельности.
Фенилкетонурия – это наследственное заболевание, связанное с отсутствием фермента фенилаланингидроксилазы, в связи с чем фенилаланин превращает не в тирозин, а в фенилпировиноградную кислоту (ФПВК). При этом концентрация фенилаланина повышается в крови в 20-30 раз (в норме-1,0-2,0мг/дл), в моче – в 100-300 раз (норма – 30 мг/дл). Наиболее тяжелые проявления – нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. Эти проявления связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина. При отсутствии лечения больные не доживают до 30 лет. Заболевание наследуется по аутосомно-рецессивному типу.
Ф


 енилаланин
фен-ала тирозин
енилаланин
фен-ала тирозин
гидроксилаза
ФПВК
Из аминокислоты тирозина образуются: тироксин, норадреналин, адреналин, меланин и др. При отсутствии ферментов, расщепляющих тирозин, наблюдается следующая патология:
Альбинизм – наследственное заболевание, связанное с отсутствием фермента тирозиназы. Тирозин не превращается в дезоксифенилаланин (ДОФА), следовательно, не образуется пигмент меланин. Клиническое проявление – отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь.
тирозин


Д ОФА
ОФА
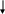 дофамин
гомогентизиновая
кислота
дофамин
гомогентизиновая
кислота


меланин норадреналин ацетоуксусная фумаровая
кислота кислота
адреналин
Алкаптонурия («черная моча») – заболевание, связанное с отсутствием фермента диоксигеназы, расщепляющего гомогентизиновую кислоту. Она выводится с мочой и при соприкосновении с воздухом моча приобретает темную окраску. Клиническими проявлениями болезни также являются пигментация соединительной ткани (охроноз) и артрит.
8.9. Нуклеопротеины. Переваривание в желудочно-кишечном тракте. Распад нуклеиновых кислот (нуклеазы).Распад пуриновых нуклеотидов. Подагра, применение аллопуринола для лечения подагры. Синдром Леша-Нихана. Представление о биосинтезе пуриновых нуклеотидов. Инозиновая кислота как предшественник адениловой и гуаниловой кислот.
Нуклеопротеины – сложные белки, состоящие из белков и нуклеиновых кислот. Существует два типа нуклеопротеинов, которые отличаются друг от друга по составу, размерам и физико-химическим свойствам: дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП).
Нуклеопротеины пищи подвергаются перевариванию в ЖКТ, образуя ряд низкомолекулярных продуктов, всасывающихся в тонком кишечнике.
1 этап – это отщепление нуклеиновой кислоты от белковой части нуклеопротеина. Этот разрыв связи между белком и простетической группой происходит как в желудке, так и в кишечнике. В желудке этот процесс происходит под действием пепсина, в кишечнике – под действием трипсина. Затем белок в ЖКТ подвергается обычным превращениям.
Расщепление нуклеиновых кислот, содержащихся в пище, происходит в результате переваривания в тонком кишечнике под действием нуклеаз: РНК-азы и ДНК-азы. Всасывание продуктов гидролиза нуклеиновых кислот происходит в виде нуклеотидов и нуклеозидов, а также в виде азотистых оснований, пентозы и остатка фосфорной кислоты.
Аденозин и гуанозин, которые образуются при гидролизе пуриновых нуклеотидов, подвергаются ферментативному распаду с образованием конечного продукта – мочевой кислоты, которая выводится с мочой из организма.
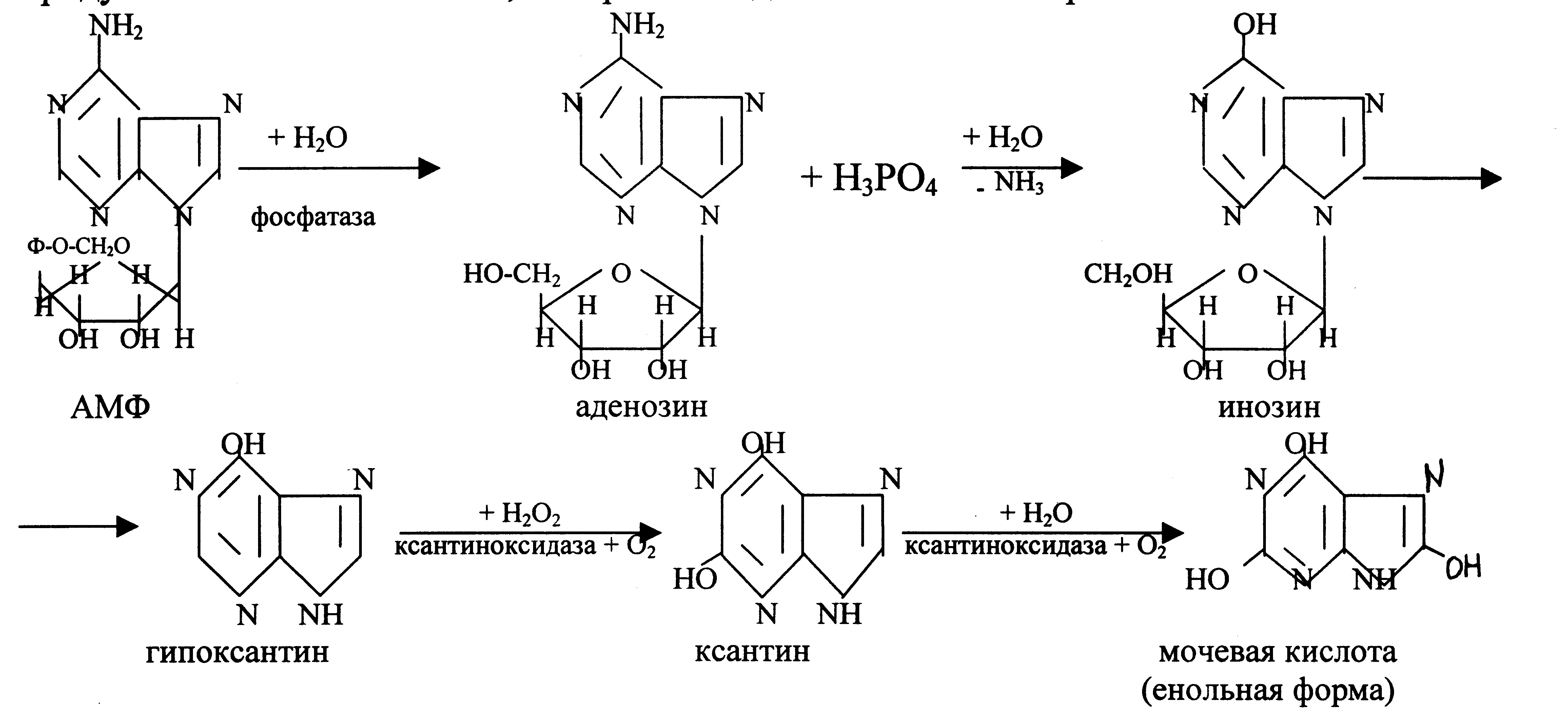
Гиперурикемия – повышение в плазме крови концентрации мочевой кислоты. Вследствие гиперурикемии может развиться подагра.
Подагра – заболевание, вызванное нарушением обмена нуклеиновых кислот. В хрящах, сухожилиях, в суставных сумках, иногда в почках, коже, мышцах откладываются кристаллы мочевой кислоты и уратов. Вокруг этих отложений образуется воспаление и грануляционный вал, который окружает омертвевшую ткань, при этом образуются подагрические узлы - тофусы (в суставах пальцев рук, ног, в хрящах ушной раковины), что сопровождается деформацией и болезненностью пораженных суставов. К характерным признакам подагры относятся повторяющиеся приступы острого воспаления суставов (чаще всего мелких) – острого подагрического артрита. Обычно больные склонны к атеросклерозу и гипертонии. В их крови наблюдается большая концентрация мочевой кислоты – гиперурикемия. В течение нескольких дней перед приступом подагры увеличивается выделение воды и хлорида натрия с мочой, т.е. сдвигается водно-солевой баланс. Вследствие этого возрастает концентрация мочевой кислоты в крови и отложение ее в тканях. Как правило, подагра генетически детерминирована и носит семейный характер. Она вызвана нарушениями в работе фосфорибозилдифосфата (ФРДФ) синтетазы или гипоксантингуанин- или аденинфосфорибозилтрансфераз. К другим характерным проявлениям относят нефропатию, при которой наблюдают образование уратных камней в мочевыводящих путях.
Синдром Леша-Нихена – тяжелая форма гиперурикемии, которая наследуется как рецессивный признак, сцепленный с Х-хромосомой. Проявляется только у мальчиков. Кроме симптомов подагры наблюдаются церебральные параличи, нарушение интеллекта, попытки наносить себе раны (укусы губ, пальцев). Связана болезнь с дефектом фермента гипоксантин-гуанин-фосфорибозилтрансферазы, которая катализирует превращение гипоксантина и гуанина в гуанинимонофосфат (ГМФ), поэтому они превращаются в мочевую кислоту. В первые месяцы жизни неврологические расстройства не обнаруживаются, но на пеленках отмечают розовые пятна, вызванные присутствием в моче кристаллов мочевой кислоты. При отсутствии лечения больные погибают в возрасте до 10 лет из-за нарушения функции почек.
Основной препарат для лечения гиперурикемии – аллопуринол (структурный аналог гипоксантина).
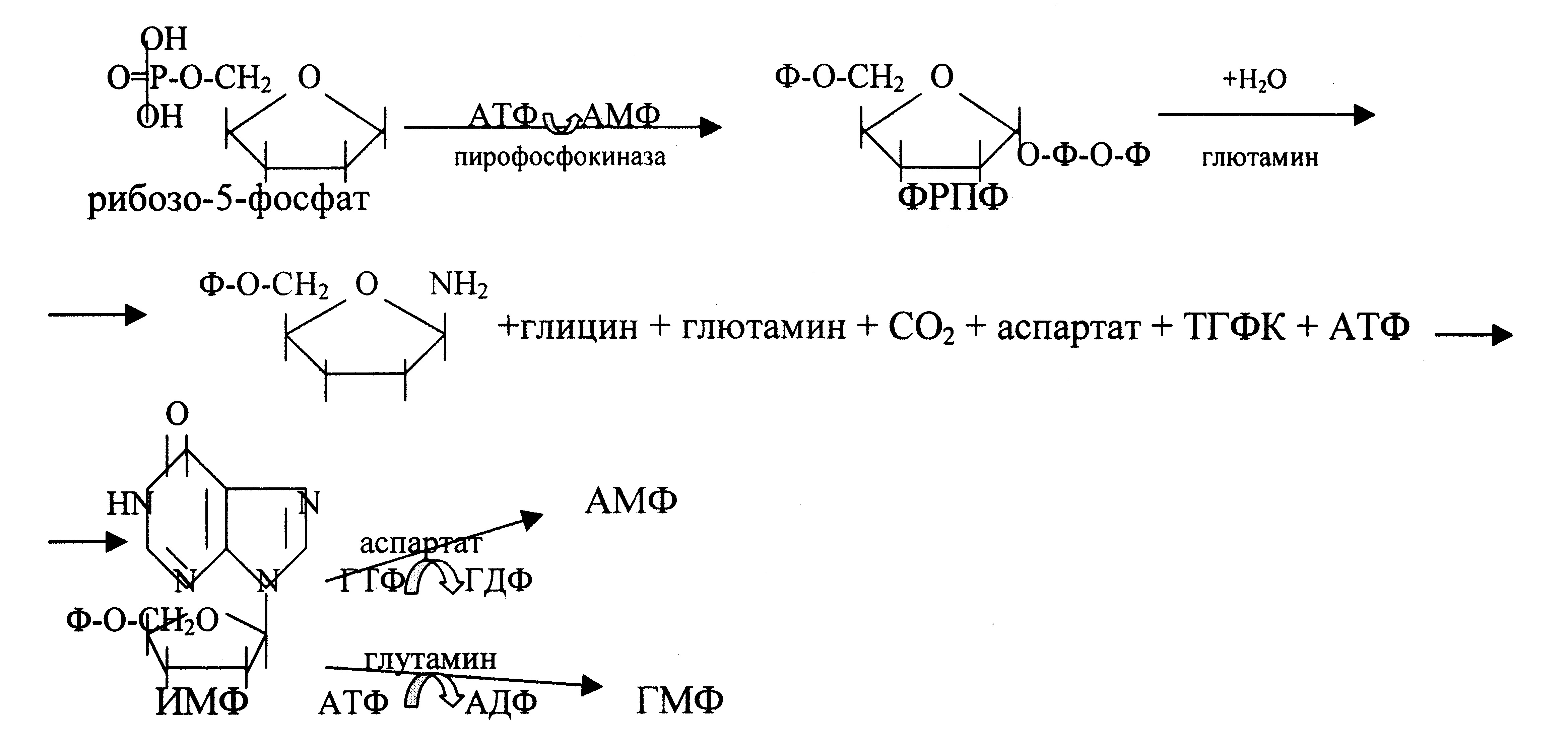
Биосинтез пуриновых мононуклеотидов.
Первоначальным соединением синтеза служит Д-рибозо-5-фосфат, который является продуктом пентозофосфатного цикла и на который переносится пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофосфат (ФРПФ) взаимодействует с глутамином, который является донором NН2-группы в результате чего образуется β-5-фосфорибозил-амин. Эта стадия становится ключевой в синтезе пуринов. Затем присоединяется молекула глицина к свободной NН2-группе β-5-фосфорибозил-амина с образованием глицинамидрибонуклеотида. Еще через несколько стадий образуется первый пуриновый нуклеотид инозинмонофосфат (ИМФ), из которого затем синтезируются остальные нуклеозидфосфаты.
Схема: