
- •1.2 Вопрос. Белки, понятие, биологическая роль в детском организме. Физико – химические
- •3.2 Вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
- •4.2 Вопрос. Простые белки: альбумины, глобулины, гистоны, протамины. Особенности их строения, биологическая роль в детском организме.
- •6.2 Вопрос. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •7.2 Вопрос. Связи, формирующие первичную структуру полинуклеотидных цепей. Вторичная структура днк и рнк
- •5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
- •1.3. Витамины. Определение. Номенклатура и классификация. Функции витаминов. Гиповитаминозы и авитаминозы. Причины (экзо-, эндогенные). Антивитамины, механизм действия
- •3.3. Витамин рр, строение и биологическая роль. Над-зависимые дегидрогеназы.
- •5.3. Витамин в2, строение, роль (фад, фмн), суточная потребность, признаки авитаминоза.
- •7.3.. Витамин «в12», биологическая роль, явления недостаточности. Внутренний фактор Касла , его роль в усвоении витамина в12.Суточная потребность
- •1.4. Ферменты. Биологическая роль в детском организме. Классификация и номенклатура ферментов. Особенности синтеза и секреции ферментов у детей.
- •2.4.Химическая природа и строение ферментов. Активный (каталитический) и аллостерический (регуляторный) центры. Строение простых и сложных ферментов (гидролазы, дегидрогеназы, трансаминазы)..
- •4.4. Активаторы ферментов: ионы металлов, частичный протеолиз, фосфолирование и дефосфолирование
- •5.4.Ингибиторы ферментов: обратимые и необратимые,конкурентные. Лекарственные препараты как ингибиторы ферментов.
- •6.4. Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Регуляция активности по принципу обратной связи.
- •8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
- •2.5.Гормоны передней, средней и задней доли гипофиза. , особенности биологического дей ствия. Симптомы гипо- и гиперпродукции.
- •3.5.Вторичные мессенджеры (внутриклеточные посредники) гормонов. Циклический амф, его образование и распад. Аденилатциклаза и фосфодиэстераза. Действие ц-амф на протеинкиназы (адреналин, глюкагон).
- •4.5.Кальций как вторичный мессенджер гормонов. Кальмодулин. Образование и действие инозитолтрифосфата (иф3)и диацилглицерола (даг) как внутриклеточных сигнальных компонентов действия гормонов
- •5.5. Гормоны коры надпочечников. Химическое строение. Изменение метаболизма при гипер-, гипокортицизме (болезнь Аддисона, болезнь Иценко-Кушинга).
- •7.5. Половые гормоны, строение, влияние на обмен веществ и функции половых желез
- •2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
- •3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
- •V комплекс – атф-синтаза.
- •4.7.Анаэробный распад глюкозы ( гликолиз),значение анаэробного распада глюкозы. Эффект Пастера.
- •6.7. Представление о пентозофосфатном пути превращений глюкозы. Окислительная стадия (до образования рибозо-5-фосфат). Распространение и физиологическое значение у детей. Регуляция.
- •7.7. Гликоген- резервный гомополисахарид. Биосинтез гликогена. Мобилизация гликогена с образованием глюкозы в печени. Регуляция процессов. Гликогенозы.
- •Роль желчных кислот
- •2.8. Ресинтез жиров в стенке кишечника. Состав и строение транспортных форм липидо(липопротеинов ).
- •3.8.Основные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), химическое строение, биологическая роль. Жировое перерождение печени. Липотропные факторы.
- •11.8. Лпнп и лпвп – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
- •9.8. Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
- •7.8. Классификация высших жирных кислот. Биологическая роль. Ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
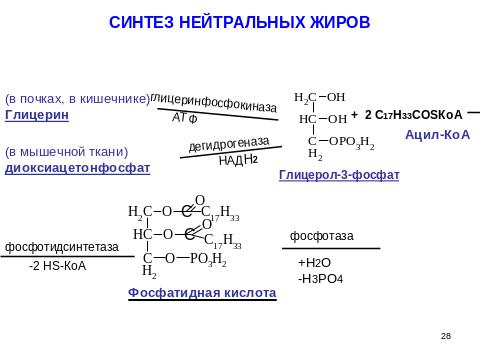
- •8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
- •Нейтральные жиры.
- •3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
- •9.9. Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
- •3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
- •4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
- •1.11.Потребность детского организма в воде и минеральных элементах. Обмен кальция, фосфора, калия, натрия, серы в организме. Регуляция водно – солевого обмена.
- •1.12. Моча, физико-химические свойства. Особенности состава мочи у новорожденных и детей грудного возраста. Патологические составные части. Клиническое значение анализа мочи у детей.
8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
Ожирение – полигенное заболевание, сопровождающееся накопление ТАГ в адипоцитах, которое является фактором риска развития инфаркта миокарда, инсульта, СД, гипертонической и желчнокаменной болезни.
Ожирение бывает:
первичное – оно развивается в результате алиментарного дисбаланса – избыточное калорийное питание по сравнению с расходованием энергии.
Причины: - генетические нарушения до 80%
- состав и количество потребляемой пищи
- система питания в семье
- уровень физической активности
- психологические факторы
Рассмотрим генетические факторы в развитии ожирения. Метаболические различия между тучными и худыми людьми. У людей, склонных к ожирению, вероятно, имеется более прочное сопряжение дыхания и окислительного фосфорилирования, т.е. более эффективный метаболизм. Возможно разное соотношение аэробного и анаэробного гликолиза. Анаэробный гликолиз (как менее эффективный) «сжигает» гораздо больше глюкозы, в результате снижается переработка в жиры.
У человека обнаружен ген ожирения. Продуктом экспрессии этого гена служит белок лептин, который содержит 167 аминокислотных остатков, взаимодействует с рецептором гипоталамуса, в результате снижается секреция нейропептида У, стимулируя пищевое поведение. У 80% больных концентрация лептина в крови тучных людей больше в 4 раза чем у нормы.
2. вторичное ожирение – ожирение развивающееся в результате какого-либо основного заболевания, чаще эндокринного. Например Иценко-Кушинга, гипофиз, гипоталамуса и др.
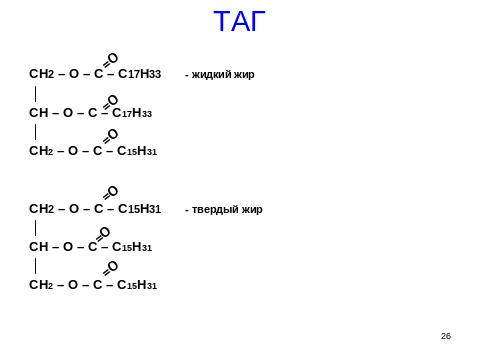
Нейтральные жиры.
В их состав входит 3х атомный спирт глицерин и высшие жирные кислоты: олеиновая кислота 55%, пальмитиновая 20%, линолевая 10%.
 1.9.
Белки, биологическая роль. Нормы белка
в питании для детского организма.
Азотистый баланс, коэффициент изнашивания,
физиологический минимум. Заменимые и
незаменимые аминокислоты. Биологическая
ценность белков. Белковая недостаточность.
Квашиоркор..
1.9.
Белки, биологическая роль. Нормы белка
в питании для детского организма.
Азотистый баланс, коэффициент изнашивания,
физиологический минимум. Заменимые и
незаменимые аминокислоты. Биологическая
ценность белков. Белковая недостаточность.
Квашиоркор..
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот, связанных пептидными связями, - являются носителями жизни. Роль белков: транспортная, защитная, каталитическая, структурная, сократительная, регуляторная, рецепторная, энергетическая.
Состояние белкового обмена организма зависит не только от количества принимаемого белка, но и от его качественного состава. Те белки, которые по аминокислотному составу близки к аминокислотному составу организма, лучше подвергаются гидролизу в ЖКТ, т.е. степень их усвоения большая. Эти белки являются биологически более ценными. Они содержат более полный ассортимент незаменимых аминокислот. Под биологической ценностью индивидуального белка понимают его относительно питательную ценность по сравнению со стандартным белковым препаратом с учетом фактора перевариваемости и аминокислотного состава. Стандартным белковым препаратом, содержащим все незаменимые аминокислоты и легко перевариваемым, является, например лактальбумин. Белки, не содержащие какую-либо незаменимую аминокислоту, не обладают биологической ценностью. Растительные белки менее ценны, чем животные (мясо, рыба, молоко и т.д.), так как бедны лизином, метионином и триптофаном, а также труднее перевариваются. В организме могут синтезироваться только некоторые аминокислоты (заменимые), а те которые не синтезируются, называются незаменимыми. Для детей до 3-месячного возраста их 10: лейцин, изолейцин, лизин, треонин, триптофан, фенилаланин, гистидин, цистин, аргинин, валин. У взрослого организма 8 аминокислот являются незаменимыми (аргинин и гистидин – условно заменимые).
Основная масса азота в пище приходится на белки. При обмене белка, содержащийся в нем азот выделяется из организма в виде азотистых веществ. Для изучения и понимания хода и состояния обмена белков большое значение имеет определение азотистого баланса – это разница между количеством поступившего в организм азота и выведенного в виде конечных азотистых продуктов.
Виды азотистого баланса:
«положительный» – если азота выведено меньше, чем введено, т.е. азот задерживается в организме (в норме это имеет место у беременных, в растущем организме). При этом происходит накопление белков в тех или иных органах и тканях.
«нулевой» – азотистое равновесие.
«отрицательный» – если азота выведено больше, чем введено. Это значит, что в организме идет распад белков органов и тканей (сахарный диабет, ожоги, злокачественные новообразования и др.), который не компенсируется белками пищи. Он наблюдается при заболеваниях, связанных с усиленным распадом белков тканей, в старческом возрасте.
Коэффициент изнашивания – это результат ежесуточного распада тканевого белка, который равняется 23,2 г. Определен он был на добровольцах, у которых на 8-10 день безбелковой диеты начинает выделяться постоянное количество азота (53 мг в сутки на 1 кг массы тела).
Определив физиологический минимум белка, равный 30-45 г в сутки, при котором в организме устанавливается азотистое равновесие, ученые научно обосновали и рекомендовали суточную потребность белка, равную 100-120 г. Одинаково она зависит от многих факторов: возраста, вида выполняемой работы, физиологических и патологических состояний и т.д. Потребность в белке у детей: 1-3 года – 4,0 г/кг массы, 11-13 лет – 2,5 г/кг массы, 14-17 лет – 1,8 г/кг массы.
При тяжелых формах пищевых дистрофий, например, при «квашиоркоре» (в переводе «золотой или красный мальчик») – заболевании, которое распространено среди детей развивающихся стран, наблюдаются тяжелые поражения печени, остановка роста, отечность, атония мышц, анемия, резкое снижение сопротивляемости организма инфекциям. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Болезнь часто заканчивается летальным исходом.
При белковой недостаточности наблюдается резкое снижение интенсивности процессов дезаминирования, трансаминирования, биосинтеза аминокислот и синтеза мочевины в печени. Эти нарушения обусловлены нарушением ферментативных функций печени и других органов. Следствием их являются накопление аминокислот в крови, экскреция с мочой свободных аминокислот (до 10-20 г/сут, в норме – 1г/сут) и резкое снижение образования и выделения мочевины с мочой.
Аминоацидурия – дефект белков одной из транспортных систем аминокислот в почках, где происходит их реабсорбция, сопровождающийся потерей их с мочой в 3-5 раз больше нормы.
Цистинурия – дефект белка, транспортирующего цистин, приводит к повышенному выделению с мочой преимущественно цистина и образованию цистиновых камней в почках.
Кетонурия – болезнь, сопровождающаяся появлением мочи с запахом ''кленового сиропа'', является следствием недостаточности декарбоксилазы кетопроизводных аминокислот, т.е. валина, лейцина и изолейцина. В результате нарушения окислительного декарбоксилирования происходит повышение содержания в крови этих аминокислот и их кетопроизводных, а также выделение их с мочой. Моча таких больных имеет характерный запах ''кленового сиропа''. Клинически у таких детей наблюдается рвота, периодические судороги, мышечная ригидность.
2.9. Особенности процессов переваривания белков у детей. Эндопептидазы – пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Экзопептидазы: карбоксипептидаза, аминопептидазы, дипептидазы. Роль соляной кислоты в процессе пищеварения.
Переваривание белков в ЖКТ следует рассматривать как начальный этап обмена веществ, при котором белки лишаются видовой специфичности и в виде аминокислот усваиваются организмом. Фермент ЖКТ осуществляет поэтапное расщепление пептидных связей белковой молекулы.
Протеазы, гидролизующие пептидные связи внутри белковой молекулы относятся к эндопептидазам: пепсин, ренин (у детей) гастриксин, трипсин, химотрипсин, эластаза – синтезируются в неактивной форме. Механизм активирования связан с отщеплением концевого пептида, приводящее к формированию трехмерной структуры и образованию активного центра ферментов. Трипсин разрывает пептидные связи, образованные основными аминокислотами: лизином и аргинином, пепсин – между циклическими аминокислотами, ренин створаживает молоко.
Ферменты, гидролизующие пептидную связь, образованную концевыми аминокислотами относятся к экзопептидазам: карбоксипептидазы синтезируются в виде предшественников в поджелудочной железе, содержат Zn, разрывают пептидные связи, образованные ароматическими аминокислотами.
Переваривание белков начинается в желудке. Большую роль в этом процессе занимает соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов – гастринов, которые вызывают секрецию соляной кислоты (образуется в обкладочных клетках желудочных желез) и профермента пепсиногена. Под действием соляной кислоты происходит денатурация белков пищи, не подвергшихся термической обработке. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Она активирует пепсиноген и создает оптимум рН для действия пепсина.
Желудочное содержимое (химус) в процессе перевариваня поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение секретина, поступающего в кровь. Он стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3- , что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина (рН резко возрастает от 1,5-2,0 до 7,0).
Поступление пептидов в тонкий кишечник вызывает секрецию холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5 – 8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Под влиянием протеолитических ферментов образуются аминокислоты, которые всасываются в кишечнике, либо диффузно, либо путем активного транспорта.
