
- •1.2 Вопрос. Белки, понятие, биологическая роль в детском организме. Физико – химические
- •3.2 Вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
- •4.2 Вопрос. Простые белки: альбумины, глобулины, гистоны, протамины. Особенности их строения, биологическая роль в детском организме.
- •6.2 Вопрос. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •7.2 Вопрос. Связи, формирующие первичную структуру полинуклеотидных цепей. Вторичная структура днк и рнк
- •5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
- •1.3. Витамины. Определение. Номенклатура и классификация. Функции витаминов. Гиповитаминозы и авитаминозы. Причины (экзо-, эндогенные). Антивитамины, механизм действия
- •3.3. Витамин рр, строение и биологическая роль. Над-зависимые дегидрогеназы.
- •5.3. Витамин в2, строение, роль (фад, фмн), суточная потребность, признаки авитаминоза.
- •7.3.. Витамин «в12», биологическая роль, явления недостаточности. Внутренний фактор Касла , его роль в усвоении витамина в12.Суточная потребность
- •1.4. Ферменты. Биологическая роль в детском организме. Классификация и номенклатура ферментов. Особенности синтеза и секреции ферментов у детей.
- •2.4.Химическая природа и строение ферментов. Активный (каталитический) и аллостерический (регуляторный) центры. Строение простых и сложных ферментов (гидролазы, дегидрогеназы, трансаминазы)..
- •4.4. Активаторы ферментов: ионы металлов, частичный протеолиз, фосфолирование и дефосфолирование
- •5.4.Ингибиторы ферментов: обратимые и необратимые,конкурентные. Лекарственные препараты как ингибиторы ферментов.
- •6.4. Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Регуляция активности по принципу обратной связи.
- •8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
- •2.5.Гормоны передней, средней и задней доли гипофиза. , особенности биологического дей ствия. Симптомы гипо- и гиперпродукции.
- •3.5.Вторичные мессенджеры (внутриклеточные посредники) гормонов. Циклический амф, его образование и распад. Аденилатциклаза и фосфодиэстераза. Действие ц-амф на протеинкиназы (адреналин, глюкагон).
- •4.5.Кальций как вторичный мессенджер гормонов. Кальмодулин. Образование и действие инозитолтрифосфата (иф3)и диацилглицерола (даг) как внутриклеточных сигнальных компонентов действия гормонов
- •5.5. Гормоны коры надпочечников. Химическое строение. Изменение метаболизма при гипер-, гипокортицизме (болезнь Аддисона, болезнь Иценко-Кушинга).
- •7.5. Половые гормоны, строение, влияние на обмен веществ и функции половых желез
- •2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
- •3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
- •V комплекс – атф-синтаза.
- •4.7.Анаэробный распад глюкозы ( гликолиз),значение анаэробного распада глюкозы. Эффект Пастера.
- •6.7. Представление о пентозофосфатном пути превращений глюкозы. Окислительная стадия (до образования рибозо-5-фосфат). Распространение и физиологическое значение у детей. Регуляция.
- •7.7. Гликоген- резервный гомополисахарид. Биосинтез гликогена. Мобилизация гликогена с образованием глюкозы в печени. Регуляция процессов. Гликогенозы.
- •Роль желчных кислот
- •2.8. Ресинтез жиров в стенке кишечника. Состав и строение транспортных форм липидо(липопротеинов ).
- •3.8.Основные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), химическое строение, биологическая роль. Жировое перерождение печени. Липотропные факторы.
- •11.8. Лпнп и лпвп – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
- •9.8. Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
- •7.8. Классификация высших жирных кислот. Биологическая роль. Ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
- •8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
- •Нейтральные жиры.
- •3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
- •9.9. Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
- •3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
- •4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
- •1.11.Потребность детского организма в воде и минеральных элементах. Обмен кальция, фосфора, калия, натрия, серы в организме. Регуляция водно – солевого обмена.
- •1.12. Моча, физико-химические свойства. Особенности состава мочи у новорожденных и детей грудного возраста. Патологические составные части. Клиническое значение анализа мочи у детей.
V комплекс – атф-синтаза.
Это интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из двух белковых комплексов.
Гидрофобный комплекс F◦ погружен в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране.
Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.
Комплекс F1 выступает в матрикс. Он состоит из 9 субъединиц. Между α- и β- субъединицами располагаются три активных центра, в которых происходит синтез АТФ.
Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμН+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под действием ΔμН+ происходят конформационные изменения в парах α- и β- субъединиц белка F1 , в результате чего из АДФ и Н3РО4 образуется АТФ. Электрохимический потенциал, генерируемый в 3 пунктах сопряжения в ЦПЭ, используется для синтеза одной молекулы в каждом пункте.
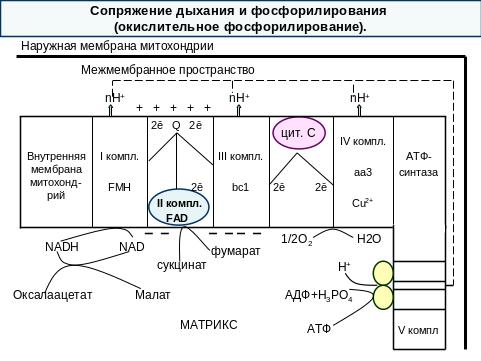
Отношение количества Н3РО4, использованной на фосфорилирование АДФ, к атому поглощенного кислорода, называют коэффициентом окислительного фосфорилирования и обозначают Р/О.
Для субстратов, которые отдают протоны и электроны на НАД-зависимые дегидрогеназы, коэффициент фосфорилирования равен 3/1=3АТФ, так как протоны и электроны транспортируются через 3 пункта сопряжения (I, III, IV комплексы).
Например, изоцитрат, малат, ПВК и др.
Для субстратов, которые отдают протоны и электроны на ФАД-зависимые дегидрогеназы и сукцинат-фумарат-дегидрогеназу (II комплекс), коэффициент фосфорилирования равен 2/1=2АТФ, так как электроны поступают на III комплекс, минуя первый пункт сопряжения (I комплекс). Например, сукцинат, глицерол-3-фосфат и др.
Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем.
6.6.Разобщение окисления и фосфорилирования, разобщающие факторы. Биологическая роль термогенина бурой жировой ткани в детском организме. Гипоэнергетические состояния как результат гипоксии, голодания, авитаминозов и других. причин. Микросомальное окисление. Биологическая роль.
На синтез молекулы АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется на поддержание температуры тела. Дополнительное образование теплоты происходит при разобщении дыхания и фосфорилирования, которое может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры у новорожденных, у зимнеспящих животных и у всех млекопитающих в процессе адаптации к холоду. У них существует бурый жир – особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования. Бурый жир содержит много митохондрий. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) – термогенин.
Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода.
Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем.
Некоторые химические вещества (протонофоры) могут переносить протоны и другие ионы (ионофоры) из мембранного пространста через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается, что приводит к возрастанию скорости окисления НАДН и ФАДН2, возрастает и количество поглощенного кислорода, но энергия выделяется в виде тепла, и коэффициент Р/О резко снижается (свободное окисление).
Разобщители – липофильные вещества, легко проходящие через липидный слой мембраны:
- 2,4-динитрофенол,
- дикумарол (антивитамин вит. К);
- билирубин (продукт распада гема);
- тироксин (гормон щитовидной железы).
Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Для постоянного синтеза АТФ клетками необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряженных с синтезом АТФ.
Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки.
Состояния, при которых синтез АТФ снижен, объединяют термином «гипоэнергетические».
Причины «гипоэнергетических состояний»:
Голодание (недостаток субстратов дыхания);
Гиповитаминозы В1, В2, В3, РР – эти витамины входят в состав ферментов, участвующих в транспорте электронов на кислород.
Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях легких и нарушении легочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей; при наследственных и приобретенных нарушениях структуры гемоглобина (анемии) и др.
Протекает в микросомах эндоплазматического ретикулума.
10% молекулярного кислорода не является акцептором протонов Н+ , а непосредственно включается в молекулу субстрата;
В процессе микросомального окисления АТФ не синтезируется.
Функции.
Детоксикационная (обезвреживающая) функция. В реакциях микросомального окисления субстраты гидроксилируются, повышается их растворимость, что способствует их выведению или снижению их токсичности (вывод лекарственных веществ из организма, избытка холестерина и т.д.);
Пластическая функция – синтез различных соединений:
- из холестерина образуются желчные кислоты, стероидные гормоны (гормоны коры надпочечников, половые гормоны);
- из пролина оксипролин;
- из лизина оксилизин;
из лизина оксилизин;
- из фенилаланина тирозин и др.
В реакциях микросомального окисления участвуют ферменты- гидроксилазы (оксигеназы), которые делятся на монооксигеназы, катализирующие включение одного атома кислорода в молекулу субстрата и диоксигеназы- включение двух атомов кислорода в молекулу субстрата.
7.6.Образование токсических форм кислорода ( супероксиданион, гидроксилрадикал, пероксид водорода), их повреждающее действие. Антиоксиданты (витамины Е,А,С, убихинон и др.) и антиоксидантные ферменты (супероксиддисмутаза, каталаза, пероксидаза).
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбужденном состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамическую стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
ē
О 2 О2ˉ - супероксид
+ē , Н+
О 2- Н2О2 - пероксид
+ē , Н+ +ē , Н+
Н 2О2 Н2О + ОН- 2Н2О
гидроксильный радикал
Супероксид, пероксид и гидроксильный радикал- активные окислители, представляют серьезную опасность для многих структурных компонентов клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции. Активные формы О2 вызывают окисление липидов, белков мембраны клеток, ДНК, РНК. Все это приводит к разрушению клеток.
Большая часть активных форм О2 образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QН2– дегидрогеназного комплекса. Это происходит в результате неферментативного переноса («утечки») электронов с QН2 на кислород.
Супероксид может образовываться:
При спонтанном окислении гемоглобина. В норме гемоглобин обратимо связывает кислород в оксигемоглобин, однако оксигемоглобин превращается в метгемоглобин (Fе3+) и супероксид О2ˉ.
Вирус гриппа взаимодействует с нейтрофилами легочной ткани и образует О2ˉ, который поддерживает воспаление, деструктивные процессы.
Нейтрофилы, в избытке накапливающиеся в воспаленных суставах, также образуют О2ˉ, которые участвуют в развитии артритов.
В организме существуют защитные механизмы:
- гемсодержащие ферменты: пероксидаза, которая расщепляет Н2О2:
пероксидаза
Н 2О2
Н2О+О
2О2
Н2О+О
В организме существуют защитные механизмы:
- гемсодержащие ферменты: каталаза, которая расщепляет Н2О2:
каталаза
2 Н2О2
2Н2О
+ 2О2
Н2О2
2Н2О
+ 2О2
- супероксиддисмутаза (СД), глутатионпероксидаза, обезвреживающие О2ˉ:
СД
2 О2-
+ 2Н+
2Н2О2
+ О2
О2-
+ 2Н+
2Н2О2
+ О2
каталаза
2 Н2О2 2Н2О + 2О2
- антиоксиданты, обезвреживающие свободные радикалы – витамины Е, А, С; глутатион, цистеин, биофлавоноиды, Q10 , мочевая кислота, янтарная кислота, селенит натрия и др.
1.7.Углеводы, классификация: моносахариды (глюкоза, фруктоза, галактоза, рибоза, и их производные (аминосахара, уроновые кислоты, фосфорные эфиры);дисахариды (сахароза, лактоза, мальтоза); гомополисахариды, гетерополисахариды. Химическое строение, биологическая роль.
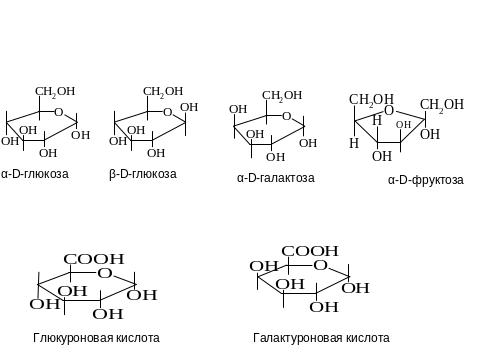
Углеводы вместе с белками, липидами и нуклеиновыми кислотами входят в состав живых организмов и определяют специфичность их строения и функционирования. На долю углеводов приходится около 75% массы пищевого рациона и более 50% от суточного количества необходимых калорий. Углеводы являются поставщиками энергии и выполняют структурную роль. Из углеводов в процессе метаболизма образуются вещества, которые служат исходными субстратами для синтеза липидов, аминокислот, нуклеотидов.
Углеводы – это альдегидо- или кетоноспирты.
Функции углеводов:
Энергетическая;
Углеводы ( рибоза, дезоксирибоза) входят в состав нуклеиновых кислот, свободных мононуклеотидов (АТФ, ГТФ, цАМФ и др.), коферментов (НАД, НАДФ, ФАД);
Структурная: гликопротеины – коллаген; белки-рецепторы; гликокаликс, белки определяющие принадлежность к группе крови; факторы свертывания крови; ферменты, гормоны; гликозаминогликаны и др;
Защитная: иммуноглобулины, интерферон, муцины, фибриноген, гликозаминогликаны и др.;
Дезинтоксикационная - входят в состав ФАФС (фосфоаденозинфосфосульфат) и УДФГК (уридиндифосфоглюкуроновая кислота).
Суточная потребность – 500 грамм.
Классификация:
Моносахариды – производные многоатомных спиртов, содержащих альдегидную или кетонную группу. В
зависимости от количества углеродных атомов моносахариды делятся на:
Истинные:
- триозы
- тетрозы
- пентозы (рибоза, дезоксирибоза)
- гексозы (глюкоза, галактоза, фруктоза) и др.
Производные моносахаридов:
- уроновые кислоты – если вместо СН2ОН группы в 6 положении – СООН группа (у глюкозы – глюкуроновая
кислота; у галактозы – галактоуроновая кислота). Они входят в состав гликозаминогликанов;
- аровые кислоты – если в 6 и 1 положениях – СООН группы (у глюкозы – глюкаровая, у галактозы –
галактаровая);
- аминосахара – если во 2 положении – NН2группа (у глюкозы – глюкозамин, у галактозы – галактозамин). Они
входят в состав гликозамингликанов;
- N-гликозиды (рибоза, дезоксирибоза, соединенные с азотистым основанием в нуклеотиде - N-гликозидной
связью). Входят в состав РНК, ДНК, АТФ, НАД, ФАД и др.;
- фосфорные эфиры моносахаридов – замещение атомов Н на остатки фосфорной кислоты: глюкозо-6-фосфат;
фруктозо-1,6-дифосфат; рибозо-5-фосфат и др.
2. Олигосахариды (в их состав входят от 2 до 10 остатков моносахаридов)
Дисахариды:
- мальтоза состоит из 2 молекул α-Dглюкозы, соединенных α-1,4-гликозидной связью. Она имеет свободный
полуацетальный гидроксил, обладает восстанавливающими свойствами;
- лактоза (молочный сахар) состоит из β-Dгалактозы и α-Dглюкозы соединенные β-1,4-гликозидной связью.
Имеет свободный полуацетальный гидроксил и обладает восстанавливающими свойствами.
- сахароза состоит из α-Dглюкозы и β-Dфруктозы, соединенные α-1,2-гликозидной связью. Свободного
полуацетального гидроксила не имеет, поэтому не обладает восстанавливающими свойствами.
3. Полисахариды:
- гомополисахариды (крахмал, клетчатка, гликоген);
- гетерополисахариды (гликопротеины, протеогликаны, гликолипиды).).
2.7. Особенности переваривания и всасывания углеводов у детей. Роль клетчатки. Нарушения переваривания углеводов. Мальабсорбция. Лактазная недостаточность удетей, причины, проявления. Общая схема источников и путей расходования глюкозы в организме.
Попадая в желудочно-кишечный тракт, углеводы под действием ферментов распадаются на моносахариды и всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны этих клеток (путем облегченной диффузии и активного транспорта).
В ротовой полости пища измельчается при пережевывании, смачиваясь при этом слюной, рН которой равна 6,8. Под влиянием α-амилазы слюны (эндоамилаза) происходит расщепление в крахмале α-1,4-гликозидных связей. Она не расщепляет α-1,6-гликозидные связи в крахмале, поэтому крахмал переваривается лишь частично с образованием крупных фрагментов – декстринов и небольшого количества мальтозы. α-амилаза не гидролизует гликозидные связи в дисахаридах.
В желудке действие амилазы слюны прекращается, т.к. рН желудочного сока равен 1,5-2,5. Однако, внутри
пищевого комка активность амилазы может некоторое время сохранятся, пока рН не изменится в кислую
сторону.
В 12-перстной кишке рН равна 7,5-8,0. Из поджелудочной железы в кишечник поступает панкреатическая α-амилаза. Этот фермент также является эндогликозидазой т.к. расщепляет α-1,4-гликозидные связи в крахмале и декстринах. Продукты переваривания: олигосахариды, содержащие 3-8 остатков глюкозы, мальтоза, изомальтоза – дисахарид, состоящий из 2 молекул α-Dглюкозы, соединенных α-1,6-гликозидной связью. Дальнейшее их переваривание происходит в нижних отделах тонкого кишечника под действием мальтазы, изомальтазы. Дисахариды пищи сахароза и лактоза также расщепляются в тонком кишечнике сахаразой и лактазной (полостное пищеварение).
Процесс переваривания заканчивается на поверхности эпителиальных клеток кишечника (мембранное,
пристеночное пищеварение). Эпителиальные клетки покрыты микроворсинками, над которыми располагается
волокнистая сеть - гликокаликс (гликопротеин). В нем располагаются ферменты гидролизующие мальтозу,
сахарозу, лактозу, которые не расщепилисьв полости кишечника.
Скорость всасывания моносахаридов различна, глюкоза и галактоза всасываются быстрее, чем другие
моносахариды. Транспорт моносахаридов в клетке слизистой оболочке кишечника может осуществляться
различными способами: путем облегченной диффузии и активного транспорта. При высокой концентрации
глюкозы в просвете кишечника она транспортируется в клетку путем облегченной диффузии. При низкой
концентрации – глюкоза всасывается путем активного транспорта.
Механизм активного транспорта.
Глюкоза и Nа+ соединяются с разными участками белка-переносчика. При этом Nа+ поступает в клетку по градиенту концентрации и одновременно транспортируется глюкоза против градиента концентрации. Чем больше градиент Nа+, тем больше поступления глюкозы в энтероциты. Если концентрация Nа+ уменьшается, транспорт глюкозы снижается. Свободная энергия, необходимая для активного транспорта образуется благодаря гидролизу АТФ, связанному с натриевым насосом, который «откачивает» из клетки Nа+ в обмен на К+. Глюкоза соединяется с другим белком-переносчиком путем облегченной диффузии всасывается в кровь.
Мальабсорбция – группа заболеваний, связанная с нарушением:
переваривания углеводов в ЖКТ (дефект ферментов);
нарушение всасывания продуктов распада моносахаридов.
Примером первой группы заболеваний является лактазная недостаточность (дисахаридазная).
У детей различают 2 формы:
- транзиторная (до года жизни), связанная с незрелостью фермента лактазы;
- генетическая – мутация гена, ответственного за синтез фермента лактазы.
У взрослых:
- дефект лактазы вследствие экспрессии гена лактазы возрастного характера, при этом непереносимость молока у лиц африканского и азиатского происхожде6ния. Средняя частота данной формы в странах Европы – 7-12%, в Китае 80%, в отдельных районах Африки – 97% (исторически сложившийся рацион питания);
- приобретенного характера- при кишечных заболеваниях (гастриты, колиты, энтериты). Как известно, активность лактазы ниже, чем других дисахаридаз, поэтому понижение её активности становится более заметным.
Проявление во всех случаях: осмотическая диарея, которую вызывают нерасщепленные дисахариды и невсосавшиеся моносахариды, поступающие в дистальные отделы кишечника, изменяют осмотическое давление, частично подвергаются ферментативному расщеплению микроорганизмами, с образованием кислот, газов, усиливается приток воды в кишечник, увеличивается объем кишечного содержимого, увеличивается перистальтика, появляются метеоризм и боли.
3.7.Катаболизм глюкозы. Аэробный распад – основной путь катаболизма глюкозы у человека. Последовательность реакций, распространение и физиологическое значение аэробного распада глюкозы. АЭРОБНЫЙ ГЛИКОЛИЗ – процесс окисления глюкозы до СО2 и Н2О, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции находятся в цитозоле клетки.
Выделяют 2 этапа:
Подготовительный – глюкоза фосфорилируется и расщепляется на 2 молекулы фосфотриоз. Используются 2 молекулы АТФ.
Этап, сопряженный с синтезом АТФ. Фосфотриозы превращяются в ПВК, которая далее окисляется до СО2 и Н2О ( ЦТК). Таким образом, выход АТФ – 38 молекул.
Основное физиологическое значение – использование энергии, которая освобождается в этом процессе для синтеза АТФ. Метаболиты гликолиза используются для синтеза новых соединений (фр-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата – структурного компонента нуклеозидов; 3-фосфоглицерат включается в синтез аминокислот: серин, глицин, цистеин). Являются субстратами для НАД-зависимых дегидрогеназ дых. цепи (глицеральдегид -3-фосфат, пируват, изоцитрат, α-кетоглутарат, малат). В печени и жировой ткани ацетил-КоА, образующийся из ПВК, используется как субстрат при биосинтезе жирных кислот, холестерина
