
- •1.2 Вопрос. Белки, понятие, биологическая роль в детском организме. Физико – химические
- •3.2 Вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
- •4.2 Вопрос. Простые белки: альбумины, глобулины, гистоны, протамины. Особенности их строения, биологическая роль в детском организме.
- •6.2 Вопрос. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •7.2 Вопрос. Связи, формирующие первичную структуру полинуклеотидных цепей. Вторичная структура днк и рнк
- •5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
- •1.3. Витамины. Определение. Номенклатура и классификация. Функции витаминов. Гиповитаминозы и авитаминозы. Причины (экзо-, эндогенные). Антивитамины, механизм действия
- •3.3. Витамин рр, строение и биологическая роль. Над-зависимые дегидрогеназы.
- •5.3. Витамин в2, строение, роль (фад, фмн), суточная потребность, признаки авитаминоза.
- •7.3.. Витамин «в12», биологическая роль, явления недостаточности. Внутренний фактор Касла , его роль в усвоении витамина в12.Суточная потребность
- •1.4. Ферменты. Биологическая роль в детском организме. Классификация и номенклатура ферментов. Особенности синтеза и секреции ферментов у детей.
- •2.4.Химическая природа и строение ферментов. Активный (каталитический) и аллостерический (регуляторный) центры. Строение простых и сложных ферментов (гидролазы, дегидрогеназы, трансаминазы)..
- •4.4. Активаторы ферментов: ионы металлов, частичный протеолиз, фосфолирование и дефосфолирование
- •5.4.Ингибиторы ферментов: обратимые и необратимые,конкурентные. Лекарственные препараты как ингибиторы ферментов.
- •6.4. Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Регуляция активности по принципу обратной связи.
- •8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
- •2.5.Гормоны передней, средней и задней доли гипофиза. , особенности биологического дей ствия. Симптомы гипо- и гиперпродукции.
- •3.5.Вторичные мессенджеры (внутриклеточные посредники) гормонов. Циклический амф, его образование и распад. Аденилатциклаза и фосфодиэстераза. Действие ц-амф на протеинкиназы (адреналин, глюкагон).
- •4.5.Кальций как вторичный мессенджер гормонов. Кальмодулин. Образование и действие инозитолтрифосфата (иф3)и диацилглицерола (даг) как внутриклеточных сигнальных компонентов действия гормонов
- •5.5. Гормоны коры надпочечников. Химическое строение. Изменение метаболизма при гипер-, гипокортицизме (болезнь Аддисона, болезнь Иценко-Кушинга).
- •7.5. Половые гормоны, строение, влияние на обмен веществ и функции половых желез
- •2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
- •3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
- •V комплекс – атф-синтаза.
- •4.7.Анаэробный распад глюкозы ( гликолиз),значение анаэробного распада глюкозы. Эффект Пастера.
- •6.7. Представление о пентозофосфатном пути превращений глюкозы. Окислительная стадия (до образования рибозо-5-фосфат). Распространение и физиологическое значение у детей. Регуляция.
- •7.7. Гликоген- резервный гомополисахарид. Биосинтез гликогена. Мобилизация гликогена с образованием глюкозы в печени. Регуляция процессов. Гликогенозы.
- •Роль желчных кислот
- •2.8. Ресинтез жиров в стенке кишечника. Состав и строение транспортных форм липидо(липопротеинов ).
- •3.8.Основные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), химическое строение, биологическая роль. Жировое перерождение печени. Липотропные факторы.
- •11.8. Лпнп и лпвп – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
- •9.8. Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
- •7.8. Классификация высших жирных кислот. Биологическая роль. Ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
- •8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
- •Нейтральные жиры.
- •3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
- •9.9. Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
- •3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
- •4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
- •1.11.Потребность детского организма в воде и минеральных элементах. Обмен кальция, фосфора, калия, натрия, серы в организме. Регуляция водно – солевого обмена.
- •1.12. Моча, физико-химические свойства. Особенности состава мочи у новорожденных и детей грудного возраста. Патологические составные части. Клиническое значение анализа мочи у детей.
2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
АТФ – является макроэргическим соединением, содержащим макроэргические связи; при гидролизе концевой фосфатной связи выделяется около 20 кдж/моль энергии.
К макроэргическим соединениям относятся ГТФ, ЦТФ, УТФ, креатинфосфат, карбамоилфосфат и др. Они используются в организме для синтеза АТФ. Например, ГТФ + АДФ ГДФ + АТФ
Этот процесс называется субстратное фосфорилирование – экзоргонические реакции. В свою очередь все эти макроэргические соединения образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, энергия АТФ используется для совершения различных видов работ в организме:
- механической (мышечное сокращение);
- электрической (проведение нервного импульса);
- химической (синтез веществ);
-осмотической (активный транспорт веществ через мембрану) – эндергонические реакции.
Таким образом, АТФ- главный, непосредственно используемый донор энергии в организме. АТФ занимает центральное место между эндергоническими и экзергоническими реакциями.
В организме человека образуется количество АТФ, равное массе тела и за каждые 24 часа вся эта энергия разрушается. 1 молекула АТФ «живет» в клетке около минуты.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счет энергии окисления органических соединений. Цикл АТФ-АДФ – основной механизм обмена энергии в биологических системах, а АТФ – универсальная «энергетическая валюта».
Каждая клетка обладает электрическим зарядом, который равен
[АТФ] + ½[АДФ]
[АТФ] + [АДФ] + [АМФ]
Если заряд клетки равен 0,8-0,9, то в клетке весь адениловый фонд представлен в виде АТФ (клетка насыщена энергией и процесс синтеза АТФ не происходит).
По мере использования энергии, АТФ превращается в АДФ, заряд клетки становится равным 0, автоматически начинается синтез АТФ.
Катаболизм – процесс расщепления органических веществ до конечных продуктов (СО2 , Н2О и мочевины). В этот процесс включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток.
Процессы катаболизма в клетках организма сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате реакций катаболизма происходит выделение энергии (экзергонические реакции), которая необходима организму для его жизнедеятельности.
Анаболизм – синтез сложных веществ из простых. В анаболических процессах используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
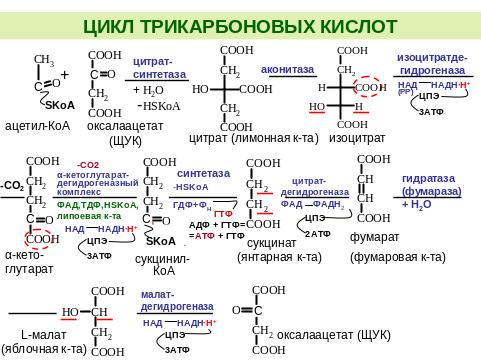
Цикл Кребса открыт Гансом Кребсом в 1937г. (цикл трикарбоновых кислот), за открытие этого цикла Кребс в 1953г. получил Нобелевскую премию.
В ЦТК включается ацетил-КоА, который образуется в результате окисления жирных кислот, отдельных аминокислот и др. Некоторые метаболиты (глюкоза, глицерин и др.) превращаются в ПВК, из которой образуется ацетил-КоА в процессе окислительного декарбоксилирования:
пируватдегидрогеназный
комплекс
П ВК
ацетил-КоА
ВК
ацетил-КоА
НАД (РР), ФАД (В2), ТДФ (В1),
HS- КоА (В3), липоевая кислота
Функции ЦТК.
Интегративная функция (объединяющая обмен белков, жиров и углеводов через образование ацетил-КоА).
Водородгенерирующая функция – образуется 4 пары протонов Н+.
Энергетическая функция – образуется 1 молекула АТФ между сукцинил-КоА и сукцинат (субстратное фосфорилирование).
Анаболическая (пластическая) – метаболиты ЦТК используются для синтеза других веществ:
- ацетил-КоА – в синтезе холестерина и его производных (желчных кислот, стероидных гормонов, провитамина Д3), высших жирных кислот, кетоновых тел, ацетилхолина и др;
- α-кетоглутаровая кислота – глутаминовая, глутамин, ГАМК, пролин, аргинин;
- сукцинил-КоА – гем;
- СО2 – глюкоза, высшие жирные кислоты, пуриновые и пиримидиновые нуклеотиды;
- фумаровая кислота – в синтезе мочевины;
- ЩУК – аспарагиновая кислота, аспарагин, глюкоза, метионин, треонин.
Субстраты ЦТК: изоцитрат, α-кетоглутарат и малат отдают протоны и электроны на НАД-зависимые дегидрогеназы, которые транспортируют протоны и электроны в ЦПЭ на I комплекс, следовательно протоны и электроны проходят все три пункта сопряжения (I, III, IV комплексы). Коэффициент окислительного фосфорилирования для:
- изоцитрат – 3/1=3АТФ;
изоцитрат – 3/1=3АТФ;
- α-кетоглутарат – 3/1=3АТФ; 9АТФ в ЦПЭ
- малат – 3/1=3АТФ
Субстрат ЦТК: сукцинат отдает протоны и электроны на сукцинат-фумарат-дегидрогеназу (II комплекс), которая переносит протоны и электроны на убихинон, минуя I комплекс ЦПЭ, следовательно, электроны проходят два пункта сопряжения (III, IV комплексы).
Коэффициент окислительного фосфорилирования для сукцинат – 2/1=2АТФ.
Между сукцинил-КоА и сукцинат образуется 1 молекула АТФ (субстратное фосфорилирование).
Энергетический баланс ЦТК= 9АТФ (ЦПЭ) + 2АТФ (ЦПЭ) + 1АТФ (субстратное фосфорилирование) = 12 молекул АТФ.
4.6. Биологическое окисление, особенности. Структурная организация дыхательной цепи. Последовательность расположения комплексов. Структура и роль их компонентов (ФМН, убихинон, цитохромы). Понятие о редокс-потенциалах.
Биологическое окисление – совокупность протекающих в каждой клетке ферментативных процессов, в результате которых молекулы углеводов, жиров и аминокислот расщепляются, в конечном счете, до углекислоты и воды, а освобождающаяся энергия запасается клеткой в виде аденозинтрифосфорной кислоты (АТФ) и затем используется в жизнедеятельности организма (биосинтез молекул, процесс деления клеток, сокращение мышц, активный транспорт, продукция тепла и др.).
Особенности биологического окисления:
Протекает при температуре тела;
В присутствии Н2О;
Протекает постепенно через многочисленные стадии с участием ферментов-переносчиков, которые снижают энергию активации, происходит уменьшение свободной энергии, в результате чего энергия выделяется порциями. Поэтому окисление не сопровождается повышением температуры и не приводит к взрыву.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в АТФ, а часть рассеивается в виде тепла. Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нем участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего переносчика и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О. Убихинон - кофермент Q. Это небелковый переносчик. Он является жирорастворимым соединением. Структура КоQ сходна с витаминами К, Е. Убихинон выполняет коллекторную функцию, присоединяя ē и протоны от НАДН-дегидрогеназы (I комплекс), сукцинат-фумаратдегидрогеназы (II комплекс) и ФАД- зависимых дегидрогеназ, он обратимо восстанавливается в гидрохинон (QН2).Содержание убихинона значительно превосходит количество других компонентов ЦПЭ. Например, на 1 молекулу НАД+ приходится 50молекул КоQ.От убихинона происходит транспорт только электронов на цитохромы. Цитохромы имеют ряд особенностей: 1)Цитохромы в ЦПЭ располагаются в порядке возрастания окислительно-восстановительного потенциала (редокс-потенциала); 2)Железо в цитохромах способно изменять свою степень окисления, поэтому цитохромы в ЦПЭ транспортируют только электроны. В транспорте двух электронов принимают участие две молекулы каждого вида цитохромов, так как одна молекула цитохрома может переносить только один электрон.
5.6.Окислительное фосфорилирование. Сопряжение окисления (дыхания) и фосфорилирования (теория Митчелла).Vкомплекс-АТФ-аза. Коэффициент окислительного фосфорилирования Р/О. Дыхательный контроль. Так как электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, их транспорт по ЦПЭ к кислороду сопровождается относительно большим снижением свободной энергии.
В ЦПЭ можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии. Это количество свободной энергии необходимо для синтеза АТФ из АДФ и фосфата (фосфорилирование).
Процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены.
Синтез АТФ из АДФ и Н3РО4 за счет энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
Механизм сопряжения окончательно не выяснен, наиболее обоснованной является хемиосмотическая теория Митчелла, предложенная в 1961г.
Перенос электронов по ЦПЭ от НАДН к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство.
Протоны, перенесенные из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана не проницаема для протонов.
Таким образом, создается протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несет положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд – на внутренней стороне, положительный заряд – на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ.
Энергия электрохимического потенциала (ΔμН+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы (V комплекс).
Наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+ происходит на участках ЦПЭ, соответствующих расположению комплексов I, III, IV. Эти участки называют пунктами сопряжения дыхания и фосфорилирования, где и происходит синтез АТФ.
