
- •1.2 Вопрос. Белки, понятие, биологическая роль в детском организме. Физико – химические
- •3.2 Вопрос. Четвертичная структура. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков- гемоглобина и миоглобина.
- •4.2 Вопрос. Простые белки: альбумины, глобулины, гистоны, протамины. Особенности их строения, биологическая роль в детском организме.
- •6.2 Вопрос. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •7.2 Вопрос. Связи, формирующие первичную структуру полинуклеотидных цепей. Вторичная структура днк и рнк
- •5.2 Вопрос. Сложные белки: строение,характеристика тодельных групп, биологическая роль. Нуклеопротеины, химическое строение днк, рнк, биологическая роль.
- •8.2 Вопрос.Гемопротеины, химическое строение гемоглобина и миоглобина. Физиологические и аномальные гемоглобины (серповидноклеточная анемия, талассемии) Гликозилированный гемоглобин.
- •1.3. Витамины. Определение. Номенклатура и классификация. Функции витаминов. Гиповитаминозы и авитаминозы. Причины (экзо-, эндогенные). Антивитамины, механизм действия
- •3.3. Витамин рр, строение и биологическая роль. Над-зависимые дегидрогеназы.
- •5.3. Витамин в2, строение, роль (фад, фмн), суточная потребность, признаки авитаминоза.
- •7.3.. Витамин «в12», биологическая роль, явления недостаточности. Внутренний фактор Касла , его роль в усвоении витамина в12.Суточная потребность
- •1.4. Ферменты. Биологическая роль в детском организме. Классификация и номенклатура ферментов. Особенности синтеза и секреции ферментов у детей.
- •2.4.Химическая природа и строение ферментов. Активный (каталитический) и аллостерический (регуляторный) центры. Строение простых и сложных ферментов (гидролазы, дегидрогеназы, трансаминазы)..
- •4.4. Активаторы ферментов: ионы металлов, частичный протеолиз, фосфолирование и дефосфолирование
- •5.4.Ингибиторы ферментов: обратимые и необратимые,конкурентные. Лекарственные препараты как ингибиторы ферментов.
- •6.4. Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Регуляция активности по принципу обратной связи.
- •8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
- •2.5.Гормоны передней, средней и задней доли гипофиза. , особенности биологического дей ствия. Симптомы гипо- и гиперпродукции.
- •3.5.Вторичные мессенджеры (внутриклеточные посредники) гормонов. Циклический амф, его образование и распад. Аденилатциклаза и фосфодиэстераза. Действие ц-амф на протеинкиназы (адреналин, глюкагон).
- •4.5.Кальций как вторичный мессенджер гормонов. Кальмодулин. Образование и действие инозитолтрифосфата (иф3)и диацилглицерола (даг) как внутриклеточных сигнальных компонентов действия гормонов
- •5.5. Гормоны коры надпочечников. Химическое строение. Изменение метаболизма при гипер-, гипокортицизме (болезнь Аддисона, болезнь Иценко-Кушинга).
- •7.5. Половые гормоны, строение, влияние на обмен веществ и функции половых желез
- •2.6. Анаболизм. Катаболизм. Макроэргические соединения (атф,утф,цтф, креатин-фосфат), химическое строение, биологическая роль.
- •3.6.Цикл трикарбоновых кислот (цтк). Последовательность реакций. Связь с процессами окислительного фосфорилирования. Понятие о субстратном фосфорилировании. Энергетический эффект. Функции цтк.
- •V комплекс – атф-синтаза.
- •4.7.Анаэробный распад глюкозы ( гликолиз),значение анаэробного распада глюкозы. Эффект Пастера.
- •6.7. Представление о пентозофосфатном пути превращений глюкозы. Окислительная стадия (до образования рибозо-5-фосфат). Распространение и физиологическое значение у детей. Регуляция.
- •7.7. Гликоген- резервный гомополисахарид. Биосинтез гликогена. Мобилизация гликогена с образованием глюкозы в печени. Регуляция процессов. Гликогенозы.
- •Роль желчных кислот
- •2.8. Ресинтез жиров в стенке кишечника. Состав и строение транспортных форм липидо(липопротеинов ).
- •3.8.Основные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин), химическое строение, биологическая роль. Жировое перерождение печени. Липотропные факторы.
- •11.8. Лпнп и лпвп – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
- •9.8. Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
- •7.8. Классификация высших жирных кислот. Биологическая роль. Ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
- •8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. Процессов. Ожирение, причины.
- •Нейтральные жиры.
- •3.9. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
- •9.9. Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
- •3.10. Небелковые азотосодержащие вещества крови. Азотемия,виды, причины. Буферные системы крови, понятие об ацидозе и алкалозе.
- •4.10.Обмен гемоглобина, биосинтез гема и его регуляция. Распад гемоглобина. Неконъюгированный и конъюгированный билирубин.
- •1.11.Потребность детского организма в воде и минеральных элементах. Обмен кальция, фосфора, калия, натрия, серы в организме. Регуляция водно – солевого обмена.
- •1.12. Моча, физико-химические свойства. Особенности состава мочи у новорожденных и детей грудного возраста. Патологические составные части. Клиническое значение анализа мочи у детей.
8.4.. Иммобилизованные ферменты, применение в медицине. Изоферменты лактатдегидрогеназы. Значение определения изоферментов в диагностике заболеваний.
Практическое использование ферментов столкнулось с большими трудностями. Первое – это сложность и дороговизна получения достаточных количеств ферментов в чистом виде. Кроме того, ферменты быстро теряют свою активность под действием различных факторов (изменение кислотности среды, температуры, солевого состава и др.)
При использовании ферментов возникают осложнения, в первую очередь иммунологические. Также невозможно создать высокую местную концентрацию фермента при локальных поражениях, так как ферменты не обладают способностью к «направленному транспорту».
Группой под руководством отечественного ученого И. Березина впервые были созданы иммобилизованные ферменты.
Под иммобилизацией ферментов понимают их физическое (адсорбционное) или химическое (ковалентное) связывание с матрицей носителя, которая защищает фермент от инактивирующих воздействий, но в минимальной степени влияет на функционирование его активных центров. Материалом для изготовления носителя могут служить неорганические пористые стекла, силикагели, а также природные или синтетические полимеры.
Разработаны несколько видов иммобилизации.
Наиболее распространены реакции ацилирования, в которые могут вступать амино-окси- и некоторые другие группы белка, при этом чаще всего реакция протекает по аминогруппам лизиновых остатков.
Очень распространена реакция образования азаметиновой связи (оснований Шиффа) между альдегидными группами носителя и аминогруппами белка.
Относительно новый способ получения устойчивых терапевтических ферментов – иммобилизация на соединениях, характерных для самого организма или даже обладающих собственной биологической активностью, дополняющих или усиливающих действие связанного с ними фермента. Примером может служить фибринолизин, иммобилизованный на гепарине, урокиназа – на альбумине.
Наконец, растворимые препараты иммобилизованных ферментов медицинского назначения могут быть получены путем их межмолекулярного слияния. Например, слияние молекул галактозидазы обеспечивает стабилизацию фермента. Одновременно замедляется переваривание фермента и увеличивается время его нахождения в кровотоке.
Иммобилизованные ферменты имеют ряд преимуществ. Они обладают достаточно длительным сроком годности, у них снижена аллергичность и иммуногенность за счет частичной или полной блокады антигенных участков белка макромолекулой носителя, они слабо восприимчивы к действию естественных ингибиторов и проявляют терапевтическую активность в течение длительного времени. Носитель, с которым связан фермент, обеспечивает не только устойчивость, но и направленную доставку фермента предпочтительно в зону поражения, т.е. в определенный орган или ткань.
Область применения иммобилизованных ферментов очень широка. Они могут быть компонентами аналитических систем для клинического биохимического анализа, могут служить для модификации внутренних поверхностей, как различного рода протезов, так и медицинских аппаратов, могут являться компонентами перевязочных и дренирующих материалов, обеспечивающих ускорение заживления и очищения ран.
Если фермент служит для лечения местных поражений (опухолей, тромбов) и его присутствие в других органах нежелательно, то создаются биосовместимые и биоразлагаемые производные ферментов в виде микрочастиц, гранул, таблеток.
Некоторые иммобилизованные ферменты используются для наружного применения, при включении в состав различных мазей или кремов.
Изоферменты – это множественные формы одного и того же фермента. Изоферменты катализируют одну и ту же реакцию, но отличаются по аминокислотному составу и некоторым физико-химическим свойствам (молекулярной массе, электрофоретической подвижности и др.). Например, фермент лактатдегидрогеназа (ЛДГ) существует в пяти формах: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5.
ЛДГ катализирует реакцию:
Г люкоза
люкоза
 ЛДГ
4,5
ЛДГ
4,5


 ПВК
молочная кислота +
2 АТФ
ПВК
молочная кислота +
2 АТФ
ЛДГ 1,2

СО2 + Н2О + 38 АТФ
Каждая ткань имеет определенный изоферментный спектр ЛДГ: в сердечной мышце – ЛДГ1,2; в печени, скелетных мышцах – ЛДГ4,5.
Какова целесообразность синтеза фермента в нескольких молекулярных формах? В тканях с преимущественно аэробным обменом веществ (сердечная мышца), преобладают формы ЛДГ1,2, которые обеспечивают ткани большим количеством энергии. В тканях с преимущественно анаэробным обменом веществ (печень, скелетные мышцы) преобладают ЛДГ4,5, что приводит к образованию молочной кислоты и двух молекул АТФ.
Определение уровня активности изоферментов в сыворотке крови имеет важное значение в диагностике заболеваний. например, повышение активности ЛДГ1,2 наблюдается при инфаркте миокарда; ЛДГ4,5 – при заболеваниях печени (гепатит, цирроз).
При заболеваниях, сопровождающихся некрозом, маркерные (органоспецифичные) ферменты из повреждённых клеток в большом количестве поступают в кровь, и уровень их активности увеличивается, возникает гиперферментемия. Определение уровня активности маркерных ферментов в сыворотке крови имеет клиническое значение в диагностике и прогнозе ряда заболеваний.
1.5. Гормоны. Классификация, биологическая роль. Центральная регуляция эндокринной системы. Нервно-рефлекторный и эндокринный пути действия центров гипоталамуса на эндокринный аппарат. Либерины, статины. Строение, биологическая роль.
Гормоны – биологически активные вещества, образуемые железами внутренней секреции в следовых количествах, оказывающие регулирующее влияние на обмен веществ и физиологические функции.
Синтез и секреция гормонов стимулируются внешними и внутренними сигналами, поступающими в различные отделы ЦНС.
Эти сигналы по нейронам поступают в гипоталамус, где стимулируют синтез пептидных рилизинг-гормонов (от англ. release - освобождать).
7 либеринов активируют выработку гипофизарных гормонов и 3 статина, которые тормозят.
По химической природе это пептиды (состоят из 3,10,14 аминокислотных остатков).
Тиролиберин- трипептид (глутаминовая кислота, гистидин, пролин). (ТТГ и пролактин).

Соматостатин - 14 аминокислотных остатка- угнетает выработку СТГ гипофиза.
Тропные гормоны передней доли гипофиза стимулируют образование и секрецию гормонов периферических эндокринных желез, которые поступают в кровь и накапливаются в определенных органах-мишенях.
АКТГ стимулирует синтез и секрецию гормонов коры надпочечников (минерало- и глюкокортикоидов).
ТТГ- синтез и секрецию гормонов щитовидной железы;
СТГ – на растущие органы и ткани и секрецию и синтез гормонов поджелудочной железы;
Пролактин – на секрецию молочных желез;
ФСГ, ЛГ – на секрецию семенников и яичников
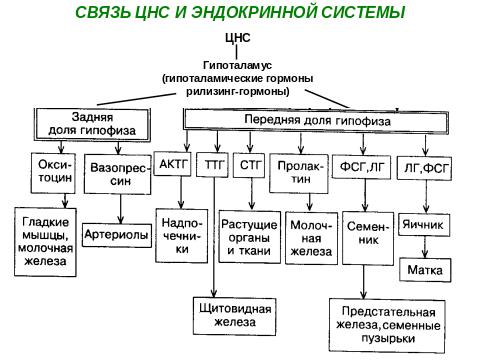
Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратной связи. Изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус; синтез и секреция тропных гормонов угнетается гормонами периферических желез.
Такие петли обратной связи действуют в системах регуляции гормонов надпочечников, щитовидной железы, половых желез.
Но не все эндокринные железы регулируются подобным образом. Например, гормоны задней доли гипофиза (вазопрессин и окситоцин) синтезируются в гипоталамусе в виде предшественников и хранятся в гранулах терминальных аксонов нейрогипофиза.
Секреция инсулина и глюкагона напрямую зависит от уровня глюкозы.
