
- •1. Внутренняя энергия.
- •2. Первое начало термодинамики.
- •3. Работа газа при изменении его объёма.
- •4. Теплоёмкость идеального газа. Уравнение Майера.
- •5. Адиабатический процесс. Уравнение адиабаты.
- •6. Работа, теплота и внутренняя энергия при изопроцессах и адиабатическом процессе.
- •7. Макро и микросостояния.
- •8. Энтропия.
- •Статистической физикой доказано, что если системе сообщается некое количество теплоты , то в ходе обратимого (обратимым является только изотермический процесс) процесса, энтропия:
- •9. Круговые процессы.
- •10. Тепловые двигатели. Цикл Карно и его кпд для идеального газа.
- •11. Второе начало термодинамики.
- •12. Реальный газ.
- •13. Изотермы Ван-дер-Ваальса и их анализ.
- •14. Внутренняя энергия реального газа.
12. Реальный газ.
Идеальный газ – есть некоторая идеализация, где не учитываются собственные объёмы молекул и взаимодействия молекул друг с другом (притяжение и отталкивание). Этой идеализацией можно пользоваться когда газ достаточно разрежен. В реальном газе надо учитывать собственные объёмы молекул и взаимодействия между молекулами.
Учёт собственных объёмов молекул сводится к учёту сил отталкивания между молекулами, поскольку именно силы вотталкивания препятствуют проникновению одной молекулы в объём, занимаемый другой молекулой.
Минимальное расстояние, на которое две молекулы могут подойти друг к другу – есть их диаметр. Поэтому, для молекулы не доступен объём, равный:

Тогда
в расчёте на одну молекулу, недоступен
объём, равный учетверённому объёму
одной молекулы (![]() ).
Значит,
).
Значит,
![]()
Учёт сил притяжения сводится к тому, что на газ оказывается дополнительное давление:
![]()
Следовательно:
![]()
Тогда уравнение состояния реального газа для одного моля:
![]() - уравнение
Ван-дер-Ваальса
- уравнение
Ван-дер-Ваальса
Поправки
![]() и
,
характеризующие данное вещество, можно
определить из уравнения, записав его
для 2-ч разных состояний.
и
,
характеризующие данное вещество, можно
определить из уравнения, записав его
для 2-ч разных состояний.
Уравнение Ван-дер-Ваальса для произвольного количества вещества:
![]()
![]()
13. Изотермы Ван-дер-Ваальса и их анализ.
Для
исследования поведения реального газа
используются изотермы Ван-дер-Ваальса
– кривые зависимости
от
![]() при заданных
,
определяемые уравнением Ван-дер-Ваальса
для моля газа:
.
при заданных
,
определяемые уравнением Ван-дер-Ваальса
для моля газа:
.
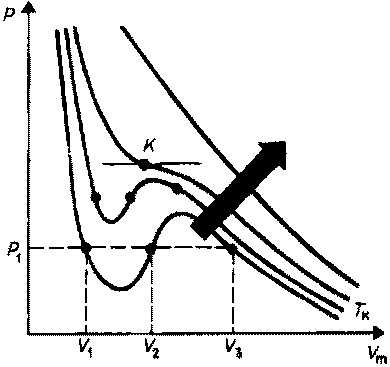
При
![]() изотерма реального газа отличается от
изотермы идеального газа только некоторым
искажением её формы, оставаясь монотонно
спадающей кривой.
изотерма реального газа отличается от
изотермы идеального газа только некоторым
искажением её формы, оставаясь монотонно
спадающей кривой.
При
некоторой температуре
![]() на изотерме имеется лишь одна точка
перегиба
на изотерме имеется лишь одна точка
перегиба
![]() .
Эта изотерма называется критической,
соответствующая ей температура –
критической температурой.
.
Эта изотерма называется критической,
соответствующая ей температура –
критической температурой.
При
![]() изотермы имеют волнообразный характер,
сначала монотонно опускаясь вниз, затем
монотонно поднимаясь вверх и снова
монотонно опускаясь.
изотермы имеют волнообразный характер,
сначала монотонно опускаясь вниз, затем
монотонно поднимаясь вверх и снова
монотонно опускаясь.
Для пояснения характера изотерм, преобразуем уравнение Ван-дер-Ваальса:
![]()
Уравнение
третьей степени относительно
![]() может иметь либо три вещественных корня,
либо один вещественный и два мнимых.
Физический смысл имеют лишь вещественные
корни. Поэтому, первому случаю соответствуют
изотермы при низких температурах (
),
т.е. три значения объёма газа
может иметь либо три вещественных корня,
либо один вещественный и два мнимых.
Физический смысл имеют лишь вещественные
корни. Поэтому, первому случаю соответствуют
изотермы при низких температурах (
),
т.е. три значения объёма газа
![]() ,
,
![]() ,
,
![]() отвечают одному значению давления.
Второму случаю отвечают изотермы при
высоких температурах.
отвечают одному значению давления.
Второму случаю отвечают изотермы при
высоких температурах.

Рассматривая
различные участки изотермы при
,
видим, что она на участках
![]() и
и
![]() при уменьшении объёма
давление возрастает, что естественно.
На участке
при уменьшении объёма
давление возрастает, что естественно.
На участке
![]() сжатие приводит к падению давления,
чего не бывает. Наличие этого участка
означает, что при изменении объёма
вещество не может долго оставаться всё
время в виде однородной среды; в некоторый
момент должно наступить скачкообразное
изменение состояния и распад вещества
на две фазы. Таким образом, истинная
изотерма будет иметь вид ломанной линии
сжатие приводит к падению давления,
чего не бывает. Наличие этого участка
означает, что при изменении объёма
вещество не может долго оставаться всё
время в виде однородной среды; в некоторый
момент должно наступить скачкообразное
изменение состояния и распад вещества
на две фазы. Таким образом, истинная
изотерма будет иметь вид ломанной линии
![]() .
Часть
.
Часть
![]() отвечает газообразному, а часть
отвечает газообразному, а часть
![]() - жидкому состояниям. В состояниях,
соответствующих горизонтальному участку
изотермы
- жидкому состояниям. В состояниях,
соответствующих горизонтальному участку
изотермы![]() ,
наблюдается равновесие жидкой и
газообразной фаз вещества. Вещество в
газообразном состоянии при температуре,
ниже критической, называется паром, а
пар, находящийся в равновесии со своей
жидкостью, называется насыщенным.
,
наблюдается равновесие жидкой и
газообразной фаз вещества. Вещество в
газообразном состоянии при температуре,
ниже критической, называется паром, а
пар, находящийся в равновесии со своей
жидкостью, называется насыщенным.
Выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами Эндрюса. Отличие экспериментальных данных от теоретических заключается в том, что превращению газа в жидкость в первом случае соответствуют в первом случае горизонтальны участки а во втором – волнообразные.
Для
нахождения критических параметров
подставим их значения в уравнение
:
![]() (1). Поскольку в критической точке все
три корня совпадают и равны, то:
(1). Поскольку в критической точке все
три корня совпадают и равны, то:
![]() или
или
![]() (2).
Из того, что уравнения 1 и 2 тождественны,
следует, что в них должны быть равны и
коэффициенты. Поэтому:
(2).
Из того, что уравнения 1 и 2 тождественны,
следует, что в них должны быть равны и
коэффициенты. Поэтому:
![]() ,
,
![]() ,
,
![]() .
Таким образом, критические параметры:
.
Таким образом, критические параметры:
![]() ,
,
![]() ,
,
![]()
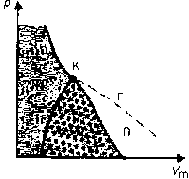
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая, ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму на три части.
Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает сжижение. Газ же при температуре выше критической не может быть превращён в жидкость ни при каком давлении.
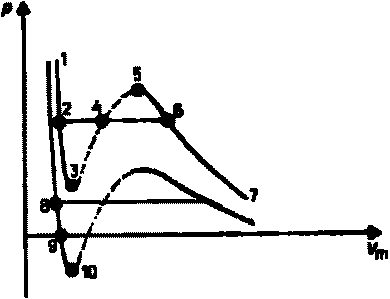
Сравнивая
изотермы Ван-дер-Ваальса и Эндрюса,
видно, что последняя имеет прямолинейный
участок
![]() ,
соответствующий двухфазным состояниям
вещества. Правда, при некоторых условиях
могут быть реализованы такие состояния,
изображаемые на кривой Ван-дер-Ваальса
участками
,
соответствующий двухфазным состояниям
вещества. Правда, при некоторых условиях
могут быть реализованы такие состояния,
изображаемые на кривой Ван-дер-Ваальса
участками
![]() и
и
![]() .
Эти неустойчивые состояния называют
метастабильными. Участок
изображает перегретую жидкость, а
- перенасыщенный пар.
.
Эти неустойчивые состояния называют
метастабильными. Участок
изображает перегретую жидкость, а
- перенасыщенный пар.
При
достаточно низких температурах изотерма
пересекает ось
,
переходя в область отрицательных
давлений. Вещество под отрицательным
давлением находится в состоянии
растяжения. При некоторых условиях
такие состояния также реализуются.
Участок
![]() на нижней изотерме соответствует
перегретой жидкости, а участок
на нижней изотерме соответствует
перегретой жидкости, а участок
![]() - растянутой жидкости.
- растянутой жидкости.
