
- •1. Внутренняя энергия.
- •2. Первое начало термодинамики.
- •3. Работа газа при изменении его объёма.
- •4. Теплоёмкость идеального газа. Уравнение Майера.
- •5. Адиабатический процесс. Уравнение адиабаты.
- •6. Работа, теплота и внутренняя энергия при изопроцессах и адиабатическом процессе.
- •7. Макро и микросостояния.
- •8. Энтропия.
- •Статистической физикой доказано, что если системе сообщается некое количество теплоты , то в ходе обратимого (обратимым является только изотермический процесс) процесса, энтропия:
- •9. Круговые процессы.
- •10. Тепловые двигатели. Цикл Карно и его кпд для идеального газа.
- •11. Второе начало термодинамики.
- •12. Реальный газ.
- •13. Изотермы Ван-дер-Ваальса и их анализ.
- •14. Внутренняя энергия реального газа.
8. Энтропия.
Статвес определяет
состояние системы, но не является
единственной величиной. Покажем это:
разделим объём на две части. Тогда
![]() ,
т.е. статвес не является аддитивной
величиной.
,
т.е. статвес не является аддитивной
величиной.
Но, можно взять
![]() .
Тогда энтропия (формула Больцмана):
.
Тогда энтропия (формула Больцмана):
![]()
где
![]() - постоянная Больцмана.
- постоянная Больцмана.
При максимальном статвесе, энтропия тоже максимальна. При необратимом процессе, система переходит из менее в более вероятное состояние, при этом увеличивается статвес, а значит и энтропия.
Находясь в равновесии, энтропия может кратковременно уменьшаться, но её можно считать постоянной в равновесии.
Закон возрастания энтропии (2-е начало термодинамики).
Энтропия в замкнутой изолированной системе (системе, предоставленной самой себе), может только возрастать или, достигнув своего максимального значения, оставаться постоянной.
![]() .
.
Статистической физикой доказано, что если системе сообщается некое количество теплоты , то в ходе обратимого (обратимым является только изотермический процесс) процесса, энтропия:
![]() .
.
Энтропия является функцией состояния (зависит от параметров системы). Поэтому, для круговых процессов энтропия:
 .
.
Состояние, которое осуществляется малым числом способов, называется упорядоченным; если большим числом, то беспорядочным. Поэтому, энтропия – это мера беспорядка в системе.
При сообщении системе кого-то количества теплоты, увеличивается мера беспорядка из-за теплового движения, т.е. увеличивается число микро и микросостояний, реализующих данное макросостояние, т.е. увеличивается статвес, а значит и энтропия.
Чес больше температура, тем больше внутренняя энергия системы, следовательно, тем меньше доля беспорядка, обусловленного сообщением системе количества теплоты .
Возрастание энтропии в замкнутой системе соответствует увеличению хаотичности молекулярного движения, следовательно, система переходит в равновесное состояние, соответствующее полному беспорядку.
Вторая формулировка 2-го начала термодинамики:
При любых процессах, происходящих в изолированной системе, система переходит из менее в более вероятные состояния.
Если количество теплоты сообщается системе в ходе необратимого процесса, то возрастание энтропии обусловлено как сообщением количества теплоты, так и необратимостью процесса. Тогда
![]() .
.
Для обратимого и необратимого процессов:
![]() ,
,
где знак
![]() соответствует необратимому процессу,
а знак равенства – обратимому.
соответствует необратимому процессу,
а знак равенства – обратимому.
Поскольку энтропия
– есть функция состояния, то её можно
выразить через параметры состояния (![]() ,
,
![]() ,
,
![]() ).
).
Третье начало термодинамики:
При
![]() всего одно микросостояние реализует
макросостояние (основное состояние),
т.е.
всего одно микросостояние реализует
макросостояние (основное состояние),
т.е.
![]() (теорема Нернста).
(теорема Нернста).
Выразим энтропию через параметры состояния:
![]() .
.
Из 1-го начала термодинамики:
 .
.
В физике часто
используют
![]() -диаграмму:
-диаграмму:
 .
.
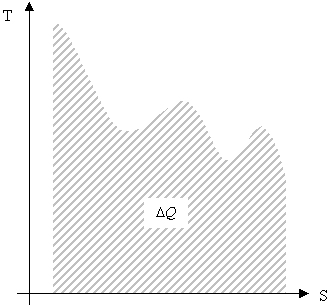
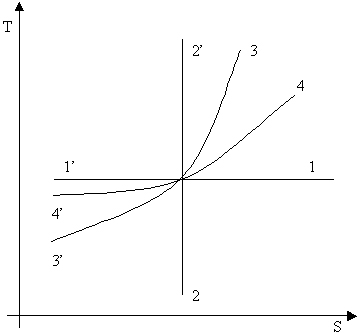
Изобразим в -координатах различные изопроцессы.
|
изотермическое расширение
|
|
изотермическое сжатие
|
|
адиабатический процесс (изоэнтропийный)
|
|
адиабатическое расширение
|
|
адиабатическое сжатие |
|
изохорное нагревание
|
|
изохорное нагревание
|
|
изобарное нагревание
|
|
изобарное охлаждение |
При циклическом
процессе
![]() .
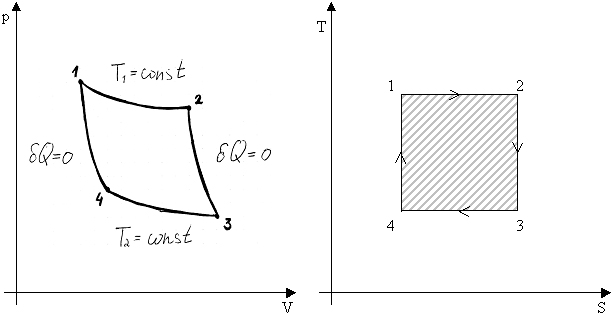
Рассмотрим цикл Карно:
.
Рассмотрим цикл Карно:
![]()
 .
.







