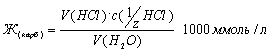- •1. Схема анализа неизвестного вещества. Дробный и систематический метода анализа. Понятие о групповом реагенте. Систематический ход анализа по кислотно-щелочному методу.
- •2. Схема анализа неизвестного вещества. Проведение предварительных испытаний и систематический ход анализа. Понятие о групповом реагенте. Систематический ход анализа по сероводородному методу.
- •3. Требования, предъявляемые к аналитическим реакциям и реагентам. Понятие о групповом реагенте. Проведение предварительных испытаний. Дробный и систематический ход анализа.
- •6.Аналогично, только для сильных оснований.
- •7. Аналогично,но для сильных кислот
- •8. Закон действующих масс и явление гидролиза солей. Константа равновесия, степень гидролиза соли, образованной слабой кислотой и сильным основанием. Вывод формулы для расчета pH
- •3) Степень гидролиза.
- •9. Для сильной кислоты и слабого основания
- •2) Вывод формулы для расчета рН.
- •11. Равновесия в водных растворах кислот и оснований. Буферные растворы, механизм действия, применение. Понятие буферной емкости. Вывод формулы для расчета pH аммонийной буферной смеси
- •12. Аналогично, но для ацетатной буферной смеси
- •17. Бебебе и определение временной жесткости воды
17. Бебебе и определение временной жесткости воды
В основе метода кислотно-основного титрования лежит реакция нейтрализации:
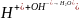 .
.
Пользуясь эти методом можно определять кроме кислот и щёлочей так и некоторые соли, имеющие сильнощелочную реакцию. Основными рабочими растворами являются кислоты, обычно серная и соляная, и щёлочи, обычно NaOH и KOH. Эти вещества не отвечают требованиям к стандартным растворам, поэтому их концентрацию приходится устанавливать. Для стандартизации кислот обычно используют буру – тетраборат натрия или безводный карбонат натрия – соду.
Индикаторы, применяемые при кислотно-основном титровании, представляют собой органические соединения, окраска которых меняется в зависимости от концентрации ионов водорода в растворе. Это так называемые кислотно-основные индикаторы, или рН-индикаторы.
Жесткость воды зависит от присутствия в ней растворимых солей кальция и магния. Смотря по тому, каковы эти соли, различают жесткость карбонатную (устранимую) и постоянную.
Карбонатная жесткость обусловлена присутствием в растворе бикарбонатов кальция и магния Са(НС03)2 и Mg(HC03)2. Если воду прокипятить, то содержащиеся в ней бикарбонаты разлагаются с образованием осадка средних солей и жесткость устраняется, например:
Са2+ + 2НС07 —> СаС03| + Н20 + C02f
Вследствие этого карбонатную жесткость называют устранимой. От выпадения осадка при кипячении воды зависит, как известно, появление накипи в паровых котлах и т. д.
Постоянная жесткость обусловлена присутствием в воде других растворимых солей кальция и магния (обычно сульфатов).
В отличие от карбонатной жесткости постоянная жесткость не может быть устранена кипячением. Сумма постоянной и карбонатной жесткости дает общую жесткость воды.
Жесткость принятовыражать числом миллиграмм-эквивалентов растворимых солей кальция и магния в 1 л воды.
Определение карбонатной жесткости. Определенный объем воды титруют соляной кислотой в присутствии метилового оранжевого, причем происходят реакции:
НС03+ Н+ —► Н2С03
Н2С03 —► Н20 + С02 (раствор)
[1/z(Са2+, Mg2+)] = (1/zHCO3-)
НСО3 + НОН Н2СО3 + ОН .
При титровании раствором соляной кислоты протекает реакция нейтрализации:
ОН + Н Н2О.
Тогда, реакция титрования выражается суммарным уравнением:
НСО3 + Н Н2О + СО2.