
- •1. Схема анализа неизвестного вещества. Дробный и систематический метода анализа. Понятие о групповом реагенте. Систематический ход анализа по кислотно-щелочному методу.
- •2. Схема анализа неизвестного вещества. Проведение предварительных испытаний и систематический ход анализа. Понятие о групповом реагенте. Систематический ход анализа по сероводородному методу.
- •3. Требования, предъявляемые к аналитическим реакциям и реагентам. Понятие о групповом реагенте. Проведение предварительных испытаний. Дробный и систематический ход анализа.
- •6.Аналогично, только для сильных оснований.
- •7. Аналогично,но для сильных кислот
- •8. Закон действующих масс и явление гидролиза солей. Константа равновесия, степень гидролиза соли, образованной слабой кислотой и сильным основанием. Вывод формулы для расчета pH
- •3) Степень гидролиза.
- •9. Для сильной кислоты и слабого основания
- •2) Вывод формулы для расчета рН.
- •11. Равновесия в водных растворах кислот и оснований. Буферные растворы, механизм действия, применение. Понятие буферной емкости. Вывод формулы для расчета pH аммонийной буферной смеси
- •12. Аналогично, но для ацетатной буферной смеси
- •17. Бебебе и определение временной жесткости воды
6.Аналогично, только для сильных оснований.
Раствор сильного однокислотного основания |
[OH–] = С(основания) pH = 14 – lgС(основания) |
Степень диссоциации (доля продиссоциировавших частиц) - отношение числа продиссоциировавших частиц к общему числу частиц, введенных в систему.
![]()
Константа диссоциаци. - константа равновесия реакции диссоциации
Основание – молекула или ион, способные принимать протон. Каждому основанию соответствует сопряженная с ним кислота. Сила оснований характеризуется константой основания К0.
7. Аналогично,но для сильных кислот
[H+] = С(кислоты)
pН = –lgС(кислоты)
Н2О ![]() Н+ +
ОН–.
Н+ +
ОН–.
8. Закон действующих масс и явление гидролиза солей. Константа равновесия, степень гидролиза соли, образованной слабой кислотой и сильным основанием. Вывод формулы для расчета pH
З.действующих масс - при установившемся хим.равновесии отношения произведения концентрации продуктов к произведению конц. реагнтов в степенях = стихиометрич.коэф.есть величина постоянная для данной р-ии в определённых условиях.
Гидролизом солей называется обменная реакция взаимодействия ионов соли с водой с образованием малодиссоциированных соединений и сопровождающаяся изменением ионного равновесия воды, что отражается на характере среды.
Гидролиз солей является обратимой химической реакцией. Количественными характеристиками его являются степень гидролиза η и константа гидролиза. Степень гидролиза соли выражается отношением числа гидролизованных молекул к общему числу молекул соли в растворе. Степень гидролиза увеличивается с повышением температуры и разбавлением.
Гидролизу подвергаются соли, образованные: а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием; в) слабым основанием и слабой кислотой.
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
K2SiO3 + НОH =>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH- => НSiO3- + 2K+ + ОН-
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
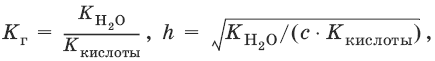
[OH¯] = ch, рOH = – lg[OH¯], рН = 14 – рOH.
3) Степень гидролиза.
Степень гидролиза соли выражается отношением числа гидролизованных молекул к общему числу молекул соли в растворе.
9. Для сильной кислоты и слабого основания
Гидролиз солей, образованных сильной кислотой и слабым основанием протекает всегда по катиону, заряд которого определяет число теоретических ступеней гидролиза. Реакция среды их водных растворов кислая (рН < 7). NH4 Cl=NH4+Cl; NH4+2H2O=NH4OH+H3O
NH4
+ H2O=NH4OH+H(+)
[H2O]*Kp=
Kгидр=Kp[H2O]
 =
=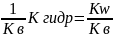
h
=

[NH4OH]=[H]= h* Cсоли
Кг
=

[NH4]= Cc - Cc.г.= Cc - h * Cc = Cc * (1-h)
h
гидр =

2) Вывод формулы для расчета рН.
[H]=[NH4OH]=Cсоли
гидр
 [H]=
[H]=
 =
=
[NH4]=Cисх – Ссоли гидр = ССоли
pH=-Lg[H]=7-1/2pKb-1/2 lgCcоли
Для солей, образованных слабым основанием и сильной кислотой

[Н+] = ch, рН = – lg[H+].
степень гидролиза h (т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
10. аналогично + усиление и подавление гидролиза. Роль гидролиза в анализе
Усилить или подавить гидролиз можно тремя способами:
1) прибавлением к раствору соли другого гидролизующегося электролита, кислоты или щелочи;
2) изменением концентрации раствора соли;
3) повышением или понижением температуры раствора соли.
Для усиления гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты, необходимо добавить основание для связывания получающихся в процессе гидролиза ионов водорода:
Kt+ + HOH 5=± KtOH + H+
При добавлении основания произойдет нейтрализация кислоты и динамическое равновесие сдвинется вправо, т. е. гидролиз усилится. Если же к раствору гидролизующейся соли типа NH4Cl прибавить кислоты, то гидролиз затормозится.
Чтобы усилить гидролиз соли, образованной анионом слабой кислоты и катионом сильного основания (например, CH3COONa), необходимо связать свободные ионы гидроксила, получающиеся в процессе гидролиза:
An"+ HOH ^=± HAn+ ОН"
Прибавление кислоты приводит к нейтрализации основания и динамическое равновесие сдвигается вправо, т. е. гидролиз усиливается. Если к раствору гидролизующейся соли рассматриваемого типа прибавить основание, то гидролиз замедлится.
Связать ионы водорода или гидроксила можно добавлением не только щелочей или кислот, но и других электролитов. Этими методами часто пользуются, когда нужно усилить или подавить гидролиз. Ионы водорода можно связать в сложные анионы (НСОз, НРОГ", H2POI и др.) или в нейтральные молекулы слабых кислот (H2CO3, H3BO3, CH3COOH и др.), действуя на растворы гидролизующихся солей солями сильных оснований и слабых кислот, например Na2CO3:
СО""+ H+ —> HCO3-
HCO8"+ H+ —> H2CO3 ^zt H2O+ CO3
Значение гидролиза в качественном анализе - Реакции гидролиза широко используются в практике качественного анализа и позволяют разобраться в целом ряде сложных процессов. Так, гидролиз сульфидов алюминия, хрома и титана практически идет до конца, поэтому при действии на их соли сульфидом аммония в присутствии аммиачной буферной смеси ( NH4OH и NH4C1) вместо сульфидов A12S3, Cr2S3 и TiS.
