- •Конструкційні матеріали
- •Розділ і Виробництво чорних металів
- •Тема 1.1. Виробництво чавуну план
- •Контрольні питання:
- •Тема 1.2. Виробництво сталі план
- •Основні реакції і процеси виробництва сталі
- •Контрольні питання:
- •Розділ іі Кристалічна будова і механічні властивості металів
- •Тема 2.1. Кристалічна будова і кристалізація металів
- •Тема 2.2. Механічні властивості металів
- •Механічні властивості металів:
- •Випробування на твердість (статичне випробування)
- •Випробування на розтяг (статичне випробування)
- •Випробування на удар (динамічне випробування)
- •Розділ ііі Основи теорії сплавів
- •Тема 3.1. Основні поняття із теорії сплавів
- •Контрольні питання:
- •Тема 3.2. Діаграми стану подвійних сплавів
- •Поняття про діаграми стану сплавів, їх побудова.*
- •Діаграми стану для випадку утворення компонентами механічної суміші, твердого розчину необмеженого і обмеженого, хімічної сполуки.**
- •Зв’язок між діаграмами стану і властивостями.**
- •Діаграма стану сплавів-механічних сумішей (і роду)
- •Правило відрізків (важеля)
- •Діаграма стану для випадку утворення компонентами необмеженого твердого розчину (іі роду)
- •Діаграма стану для випадку утворення компонентами обмеженого твердого розчину (ііі роду)
- •Діаграма стану для випадку утворення компонентами хімічної сполуки (іv роду)
- •Зв’язок між властивостями сплаву і типом діаграми стану
- •Тема 4.1. Діаграма стану залізо-цементит
- •Діаграма стану Fe-Fe3c
- •Тема 4.2. Вуглецеві сталі План.
- •Тема 4.3. Чавуни план
- •Вплив домішок на структуру і властивості чавунів:
- •Розділ V. Термічна і хіміко-термічна обробка сталі
- •Тема 5.1. Основні положення термічної обробки сталі план
- •Перетворення в сталі при нагріванні
- •Перетворення в сталі при охолодженні
- •Контрольні питання
- •Тема 5.2. Термічна обробка сталі план
- •Відпал сталі
- •Нормалізація сталі
- •Гартування сталі
- •Поверхневе гартування.
- •Відпуск сталі
- •Дефекти сталі після термообробки
- •Контрольні питання
- •Тема 5.3. Хіміко-термічна обробка сталі план.
- •Цементація сталі
- •Цементація у твердому карбюризаторі.
- •Газова цементація.
- •Азотування
- •Ціанування
- •Контрольні питання
- •Розділ vі. Леговані сталі
- •Тема 6.1. Конструкційні леговані сталі план.
- •Класифікація легованих сталей:
- •Маркування легованих сталей
- •Контрольні питання
- •Тема 6.2. Інструментальні леговані сталі план.
- •Контрольні питання
- •Тверді сплави
- •Сучасні тверді сплави
- •Контрольні питання
- •Тема 6.3. Сталі і сплави з особливими властивостями план.
- •Контрольні питання
- •Розділ vіі. Кольорові метали та їх сплави
- •Тема 7.1. Мідь та її сплави план
- •Контрольні питання
- •Тема 7.2. Магній та його сплави план
- •Тема 7.3 Алюміній та його сплави план
- •Характеристика алюмінію**.
- •Алюмінієві сплави: класифікація, марки, термічна обробка, застосування.**
- •Контрольні питання
- •Тема 7.4. Титан та його сплави план
- •Контрольні питання
- •Тема 7.5. Антифрикційні сплави план
- •Контрольні питання
- •Розділ vііі. Основи ливарного виробництва
- •Тема 8.1. Технологія виготовлення відливок в разових формах план
- •Лиття за виплавлюваними моделями
- •Тема 8.2. Технологія виготовлення відливок
- •Відцентрове лиття
- •Лиття під тиском
- •Контрольні питання
- •Розділ іх. Обробка металів тиском
- •Тема 9.1. Теоретичні основи обробки металів тиском план.
- •Контрольні питання
- •Тема 9.2. Прокатне виробництво план
- •Сортовий:
- •2) Листовий:
- •Контрольні питання
- •Тема 9.3. Кування план
- •Контрольні питання
- •Тема 9.4. Волочіння і пресування план
- •Волочіння
- •Пресування
- •Контрольні питання
- •Тема 9.5. Штампування план
Розділ ііі Основи теорії сплавів
Тема 3.1. Основні поняття із теорії сплавів
Поняття про сплав.*
Структурні утворення: твердий розчин, механічна суміш, хімічна сполука, їх характеристики.*
Поняття про компонент, фазу, систему.**
Правило фаз.***
Сплав – речовина, що складається з двох або кількох елементів, що зберігає металічні властивості.
В рідкому стані більшість металів необмежено розчиняються один в одному.
В твердому стані елементи, з яких складається сплав, утворюють такі структурні утворення:
1) твердий розчин; 2) хімічна сполука; 3) механічна суміш.
Твердий розчин–фаза, в якій один з компонентів сплаву зберігає свою криста-лічну решітку, а атоми іншого розташовуються в ній, трохи змінюючи її розміри. Розрізняють тверді розчини заміщення (рис.3.1, а) – атоми розчиненого компонента заміщають частину атомів розчинника в його кристалічній решітці та тверді розчини проникнення (рис.3.1, б) – атоми розчиненого компонента розташовуються в пустотах між атомами розчинника (утворюються тоді, коли розміри атомів розчиненого елементу невеликі і мають близьку до розчинника будову валентної оболонки електронів). Тверді розчини можуть бути необмежені і обмежені. Розчинність елементів в твердому стані залежить від типу кристалічної решітки та її параметрів. Необмежену розчинність можуть мати елементи, у яких однаковий тип кристалічної решітки, атомні розміри відрізняються не більше, як на 8-15%, які належать до однієї групи або до споріднених груп в періодичній системі елементів. Наприклад, Ag i Au; Ni i Cu; Mo i W; V i Ti. |
a)
б)
Рисунок 3.1. Твердий розчин заміщення (а) та твердий розчин проникнення (б). |
Хімічні сполуки в сплавах утворюються, коли компоненти вступають в хімічну взаємодію. Кристалічна решітка і властивості хімічної сполуки значно відрізняються від решіток і властивостей її компонентів; утворення її супроводжується значним тепловим ефектом. Утворюється хімічна сполука при певному співвідношенні компонентів, які майже завжди значно відрізняються своїми кристалічними решітками і електронною будовою атомів.
Наприклад: Fe + C → Fe3C
Cu + Al → CuAl2
Mg + Sn → Mg2Sn
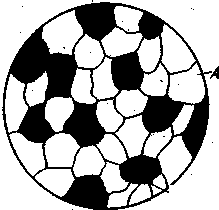
Механічна суміш (рис.3.2) утворюється, коли компоненти сплаву не розчиняються один в одному і не вступають в хімічну взаємодію; представляє собою найдрібнішу суміш кристалів компонентів (кожен зберігає свій тип кристалічної решітки). Наприклад: Pb-Sb; Sn-Zn |
|
Рисунок 3.2. Схема мікроструктури механічної суміші.
Компоненти – елементи, які утворюють сплав (метали, неметали, хімічні сполуки).
Фаза – однорідна частина системи (сплаву), відокремлена від інших частин поверхнею розділу.
Фазами можуть бути хімічні елементи, тверді і рідкі розчини, хімічні сполуки.
Система – сукупність речовин в твердому, рідкому і газоподібному стані (сукупність фаз), які знаходяться в рівновазі при певних умовах.
Правило фаз встановлює можливе число фаз і умови, за яких вони можуть існувати в даній системі.
Залежність між числом ступенів свободи, числом компонентів і числом фаз:
С = К + 2 – Ф,
де С – число ступенів свободи,
К – число компонентів, що утворюють систему,
2 – число зовнішніх факторів (температура, тиск),
Ф – число фаз, що знаходяться в рівновазі.
По відношенню до металів тиском можна знехтувати. Тоді рівняння приймає вигляд:
С = К + 1 – Ф
Розглянемо правило фаз для 1-компонентної системи.
|
1 На ділянці 0-1 існує одна фаза – рідина, тобто Ф=1, тоді С=1+1–1 =1 – за даних умов метал знаходиться в рідкому стані в певному інтервалі температур. 2 На ділянці 1-1’ відбувається кристалізація, в рівновазі існує дві фази – рідина і твердий метал, тоді С=1+1–2 =0 – перетворення відбувається при сталій температурі. 3 На ділянці 1’-2 існує одна фаза – твердий метал, тоді С=1+1–1 =1 – твердий метал може існувати в певному інтервалі температур.
|
Рисунок 3.3. Крива охолодження чистого металу. |
Число ступенів свободи – це число незалежних факторів (температура, концентрація, тиск), які можна змінювати, зберігаючи число фаз, що знаходяться в рівновазі.