
Билет №1
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
В 1869 г. Д. И. Менделеев на основе анализа свойств простых веществ и соединений сформулировал Периодический закон:
Свойства простых тел и соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
На основе периодического закона была составлена периодическая система элементов. В ней элементы со сходными свойствами оказались объединены в вертикальные столбцы —группы. В некоторых случаях при размещении элементов в Периодической системе приходилось нарушать последовательность возрастания атомных масс, чтобы соблюдалась периодичность повторения свойств. Например, пришлось "поменять местами" теллур и йод, а также аргон и калий.
Причина состоит в том, что Менделеев предложил периодической закон в то время, когда не было ничего известно о строении атома.
После того, как в XX веке была предложена планетарная модель атома, периодический закон формулируется следующим образом:
Свойства химических элементов и соединений находятся в периодической зависимости от зарядов атомных ядер.
Заряд ядра равен номеру элемента в периодической системе и числу электронов в электронной оболочке атома.
Эта формулировка объяснила "нарушения" Периодического закона. В Периодической системе номер периода равен числу электронных уровней в атоме, номер группы для элементов главных подгрупп равен числу электронов на внешнем уровне.
Причиной периодического изменения свойств химических элементов является периодическое заполнение электронных оболочек. После заполнения очередной оболочки начинается новый период. Периодическое изменение элементов ярко видно на изменении состава и свойств и свойств оксидов.
Научное значение периодического закона. Периодический закон позволил систематизировать свойства химических элементов и их соединений. При составлении периодической системы Менделеев предсказал существование многих еще не открытых элементов, оставив для них свободные ячейки, и предсказал многие свойства неоткрытых элементов, что облегчило их открытие.
Билет №2
Строение атомов химических элементов и закономерности в изменении их свойств на примере : а) элементов одного периода; б) элементов одной главной подгруппы.
Элементарные частицы обладают корпускулярно-волновым дуализмом.
Корпускула-частица, малая часть вещества ограниченная в пространстве, имеет массу и траекторию движения.
Волна- процесс который занимает большой объем в пространстве и развивается во времени. Волна имеет длину, частоту, амплитуду, скорость движения.
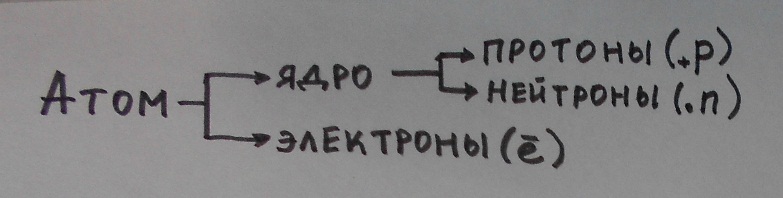
Число протонов в ядре уравновешенно числом электронов в оболочке, порядковый номер элемента показывает заряд ядра т.е число протонов.

Число нейтрона можно вычислить по формуле:

Электрон в атоме не имеет траекторию движения. Электрон движется с огромной скоростью поэтому невозможно одновременно точно указать место и время нахождения электрона. Поэтому говорят о вероятности нахождения электрона.
Атомной орбиталью называют часть пространства около ядра, где вероятность нахождения электрона не менее 90%.
Состояние электронов в атоме описывается квантовыми числами
Главное квантовое число (n)-показывает запас энергии электрона на данном уровне
Значение главного квантого числа n=1,2,3,4…
Число уровней в атоме можно определить по номеру периода
n=1; 1 уровень (2 электрона)
n=2; 2 уровень (8 электронов)
n=3; 3 уровень (18 электронов)
Максимальное
число электронов на уровне вычисляется
по формуле:
![]()
Подобное квантовое число (l)
Уровни делятся на подуровни начиная со 2-ого, орбиталь квантого числа показывает запас энергии электрона на подуровне.
Значение l
l=0,1,2,3,4…
Магнитное квантовое число (m l)
Показывает направление атомной орбитали в пространстве.
 Занимает
одно направление в пространстве ( до 2х
электронов)
Занимает
одно направление в пространстве ( до 2х
электронов)
 Р
электроны занимают 3-и направления в
пространстве (до 6 электронов)
Р
электроны занимают 3-и направления в
пространстве (до 6 электронов)
 имеют
5 направлений в пространстве (до 10
электронов)
имеют
5 направлений в пространстве (до 10
электронов)
Спиновое квантовое число (m s) обозначает момент движений электронов +1\2; -1\2
Изменения свойств в периодах и группах
А) Изменение свойств в периодах
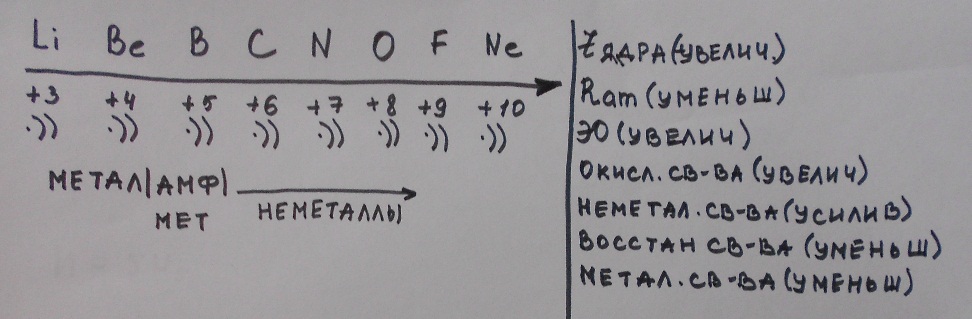
С увеличением положительного заряда ядра, усиливается притяжение внешних электронов к ядру поэтому радиус атома уменьшается.
ЭО(электроотрицательность)- способность атома притягивать к себе электроны.
Окислительные свойства-способность принимать электроны.
Восстановительные свойства-способность отдавать электроны.
Б) Изменение свойств в подгруппах

Билет №3.
Виды химической связи: ионная, ковалентная (полярная, неполярная); простые и кратные связи в органических соединениях.
Ковалентная связь образуется за счет перекрывания электронных облаков двух атомов. Каждый атом предоставляет один неспаренный электрон для образования одной химической связи, при этом происходит образование общей электронной пары. Если ковалентная связь образуется между двумя одинаковыми атомами, она называется неполярной.
Если ковалентная связь образуется между двумя различными атомами, общая электронная пара смещайся к атому с большей электроотрицательностью (электроотрицательностью называется способность атома притягивать электроны). В этом случае возникает полярная ковалентная связь.
Частным случаем ковалентной связи является донорно-акцепторная связь. Для ее образованья у одного атома должна быть свободная орбиталь на внешнем электронном уровне, а у другого—пара электронов. Один атом (донор) предоставляет другому (акцептору) свою электронную пару, в результате она становится общей, образуется химическая связь. Пример— молекула СО:
Ионная связь образуется между атомами с сильно отличающейся электроотрицательностью. При этом один атом отдает электроны и превращается в положительно заряженный ион, а атом, получивший электроны, в отрицательно заряженный. Ионы удерживаются вместе за счет сил электростатического притяжения.
Водородная связь образуется между полярными молекулами (вода, спирты, аммиак) за счет притяжения разноименных зарядов.
Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи.
Билет №4. Классификация химических реакций в неорганической химии.
Классификация по составу исходных веществ и продуктов реакции. Реакции соединения — из нескольких веществ (простых или сложных) образуется сложное вещество:
Реакции разложения — сложное вещество превращается в несколько веществ (простых или сложных):
Реакции замещения — из простого и сложного веществ образуется простое и сложное вещества:
Реакции обмена — из двух сложных веществ образуются два сложных вещества: Классификация по изменению степени окисления.
Окислительно-восстановительные реакции — в ходе реакции происходит изменение степеней окисления элементов:
Реакции ионного обмена — изменения степеней окисления не происходит: Классификация во тепловому эффекту. Экзотермические реакции — в ходе реакции выделяется тепло: Эндотермические реакции — в ходе реакции поглощается тепло:
Билет №5
Обратимые и необратимые химические реакции. Химическое равновесие и условия его смещения (изменение концентрации реагентов, температуры, давления).
Обратимые реакции протекают до достижения состояния химического равновесия.
Химическое равновесие — состояние, при котором скорости прямой и обратной реакций равны.
Обратимые реакции протекают до достижения состояния равновесия. Обратимость многих реакций кажущаяся. Так, реакция водорода с кислородом с образованием воды кажется обратимой. Однако при температуре 2000°С с заметной скоростью протекает обратный процесс— разложение воды на водород и кислород и устанавливается равновесие. Смещение химического равновесия при изменении условий описывается принципом Ле-Шателье.
При изменении внешних условий равновесие реакции смещается таким образом, чтобы уменьшить это воздействие.
Смещение равновесия при изменении температуры. В случае экзотермической реакции (протекающей с выделением тепла) равновесие смещается влево (в сторону исходных веществ) при повышении температуры, и вправо (в сторону продуктов реакции) при понижений температуры: |
В случае эндотермической реакции (протекающей с поглощением тепла) равновесие смещается вправо при повышении температуры и влево при понижении температуры: Смещение равновесия при изменении давления.
Если реакция протекает с увеличением числа молекул газообразных веществ, при повышении давления равновесие смещается влево, а при понижении давления вправо:
Если реакция протекает с уменьшением числа молекул газообразных веществ, то при повышении давления равновесие смещается вправо, а при понижений давления влево:
Если реакция протекает без изменения числа молекул газообразных веществ, то при изменении давления равновесие не смещается.
Билет №6.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (зависимость скорости от природы, концентрации вещества, площади поверхности соприкосновения реагирующих веществ, температуры, катализатора).
Скоростью химической реакции называется изменение количества вещества за единицу времени в единице объема. Скорость реакции зависит от природы реагирующих веществ.
При реакции металлов с соляной кислотой, чем левее расположен металл в раду напряжений, тем быстрее протекает реакция, а металлы, находящиеся правее водорода, не реагируют вообще:
Скорость реакции увеличивается при увеличении концентрации реагирующих веществ. Горение веществ в чистом кислороде происходит быстрее, чем в воздухе, содержание кислорода в котором составляет 21%:
Скорость реакции увеличивается при увеличении поверхности соприкосновения реагирующих веществ.
Железные опилки быстрее реагируют с соляной кислотой, чем железные гвозди: Скорость реакции увеличивается с увеличением темпера
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет, то есть ее скорость равна 0:
Скорость многих реакций увеличивается в присутствии специальных веществ — катализаторов. Катализаторы увеличивают скорость реакции, но по окончании реакции остаются неизменными. Примеры каталитических реакций: (реакция сильно ускоряется в присутствии МnО2). (Реакция протекает только в присутствии катализаторов — платины, оксида ванадия (V), железа и др).
Билет №7. Реакции ионного обмена. Условия их необратимости. В растворах электролитов реакции протекают между ионами.
Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения степеней окисления. Условия течения реакций в растворах электролитов до конца:
1) в результате реакции выпадает осадок:
2) в результате реакции выделяется газ:
3) в результате реакции образуется малодиссоциирующее вещество:
Ионный обмен –это процесс, в результате которого ионы, находящиеся в твердой фазе, обмениваются с ионами, находящимися в растворе. Нерастворимое твердое вещество может представлять собой какой-либо природный материал либо синтетическую смолу. Природные материалы, используемые для ионного обмена, включают цеолиты (комплексные алюмосиликаты натрия) и глауконитовый песок.
Например, если первоначально раствор содержит, например, хлорид натрия, то ионы натрия обмениваются с ионами водорода и из нижней части колонки вытекает разбавленный раствор соляной кислоты.
Ионообменный материал можно регенерировать (восстанавливать), промывая колонку разбавленной соляной кислотой. Это приводит к смещению влево рассматриваемого равновесия, в результате чего ионы натрия замещаются ионами водорода.



Билет №8.
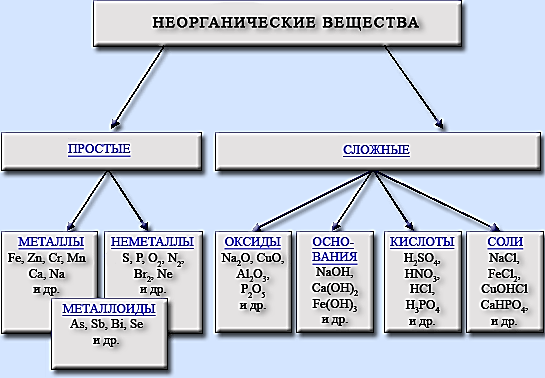
Классификация неорганических соединений.
Первоначально все химические вещества делятся на простые и сложные.
Простые вещества подразделяются на металлы и неметаллы.
Помимо типичных металлов и неметаллов есть большая группа веществ, обладающая промежуточными свойствами, их называют металлоидами.
Сложные вещества подразделяются на четыре класса химических соединений: оксиды, основания, кислоты и соли.
Билет №9.
Металлы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
Если в периодической системе элементов Д.И. Мнделеева провести диагональ от бериллия к астату, в левой нижней части-элементы-металлы. Элементы, расположены вблизи диагонали (например, Be, Al, Ti, Ge, Nb, Sb) обладают двойственный характером.





Билет №10.
Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов. Окислитено-восстановительные свойства неметаллов на примере элементов подгруппы кислорода.
Ответ следует начать с характеристики положения неметаллов в периодической системе: если провести воображаемую диагональ от бериллия Be к астату At, то неметаллы расположатся в главных подгруппах выше диагонали (т. е. в верхнем правом углу). К неметаллам относятся также водород Н и инертные газы.
Далее важно отметить, что для общей характеристики неметаллов необходимо обратить внимание на строение их атомов, на то, как распределяются электроны по электронным слоям и сколько электронов приходится на внешний электронный слой. По мере увеличения порядковых номеров атомов элементов и накопления электронов на внешнем слое у неметаллов одного периода усиливается способность принимать электроны от других атомов на свой внешний слой, т. е. неметаллические свойства элементов в периодах увеличиваются.
Рассматривая изменение свойств неметаллов при движении по группе, следует отметить, что они ослабевают. Это связано с увеличением расстояния от ядра до внешнего слоя, а следовательно, уменьшением способности ядра притягивать к себе электроны от других атомов. Для подтверждения этого вывода рассмотрим VI группу. В начале ее расположен кислород О — типичный неметалл, а заканчивается группа полонием Ро, обладающим свойствами металла.
Далее следует перейти к рассмотрению физических свойств неметаллов. Следует отметить, что простые вещества — неметаллы могут иметь как атомное (Si, В), так и молекулярное (Н2, N2, Br2) строение. Поэтому среди неметаллов есть газы (О2, С12), жидкости (Вг2), твердые вещества (С, 12). Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
Переходя к характеристике химических свойств, необходимо отметить, что более типичным для неметаллов является процесс принятия электронов. В этом отличие химических свойств неметаллов от химических свойств металлов. Это положение можно подтвердить взаимодействием неметаллов с простыми веществами. При этом следует записать уравнения соответствующих химических реакций и объяснить их сущность с точки зрения процессов окисления — восстановления. Следует отметить, что неметаллы могут проявлять свойства как окислителей, так и восстановителей.
Можно добавить, что некоторые неметаллы могут реагировать и со сложными веществами (оксидами, кислотами, солями).
Билет №11.
Аллотропия неорганических веществ на примере углерода и кислорода.




Билет №12.
Электрохимический ряд напряжений металлов. Вытеснение металлов из растворов солей другими металлами.
При погружении любого металла в раствор его соли на границе металл\раствор возникает разность потенциалов, называемая электродным потенциалом.
Электродный потенциал называют также окислительно-восстановительным потенциалом.
Ряд стандартных электродных потенциалов характеризуется химические свойства металлов. Его применяют для выяснения, в какой последовательности восстанавливаются ионы при электролизе, а также при описании других свойств металлов. Чем меньше значение потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.

Билет №13.
Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе элементов Д. И. Менделеева.
CH4,NH3,H2S, HCL.В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства л.в.с. элементов в водных растворах усиливаются. В группах сверху вниз отрицательно заряженные ионы (F-,CL-,Br-, I-) все слабее притягивают положительно заряженные ионы водорода H+. В связи с этим облегчается процесс оищепления ионов водорода и кислотные св-ва водородных соединений увеличиваются.Водородные соединения неметаллов, обладающие в водных р-рах кислотными св-ми, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных р-рах основными св-ми, реагируют с кислотами. Окислительная активность в.с н. в группах сверху вниз сильно увеличивается, т.к. в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
ИЛИ
В соединениях с неметаллами водород проявляет степень окисления +1. Поскольку энергия ионизации водорода очень большая, химическая связь его с неметаллами не ионная, а полярно-ковалентная. Наиболее электроотрицательные р-элементы в правой части периодов, например сера и хлор, реагируют с водородом, образуя ковалентные гидриды, которые обладают кислотными свойствами и сила этих кислот увеличивается по мере увеличения размера атома присоединяемого к водороду неметалла. Исключениями являются метан СН4, представляющий собой нейтральное соединение, а также аммиак NH3, обладающий основными свойствами. Водородные соединения неметаллов хорошо растворимы в воде и образуют кислоты с теми же формулами.
Более электроотрицательные р-элементы, например алюминий, кремний и фосфор, в нагретом состоянии не реагируют с водородом.
Билет №14.
Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодический системе.
Реакционная способность элементов во взаимодействии с кислородом, вообще говоря, уменьшается при перемещении вправо вдоль каждого периода. Например, в 3-м периоде два s-металла, натрий и магний, и два р-элемента, алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том же периоде элементы кремний и сера способны только медленно реагировать с кислородом. Хлор и аргон, расположенные в правом конце периода, вообще не реагируют с кислородом.
Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия Na2O и оксид магния MgO. Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода. Например, s-металлы обычно образуют оксиды, которые растворяются в воде с образованием щелочных растворов. Молекулярные оксиды р-элементов, например диоксид углерода и триоксид серы, обычно обладают кислотными свойствами. Закономерное изменение основных свойств с переходом к кислотным свойствам проявляется у оксидов элементов 3-го периода.
Билет №15.
Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации.
Кислота —электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например:
![]()

Все общие характерные свойства кислот- кислый вкус, изменение цвета индикаторов, взаимодействие с основаниями, основными оксидами, солями.
Кислоты реагируют с металлами, находящимися в ряду напряжений до водорода, при этом выделяется газообразный водород и образуется соль.

Сильные кислоты реагирует с солями слабых кислот, вытесняя слабые кислоты из их солей.
Муравьиная кислота-бесцветная, легкоподвижная жидкость с резким запахом. Во всех соотношениях смешивается с водой, спиртом, эфиром.
Уксусная кислота- бесцветная, с резким запахом и кислым вкусом. Во всех соотношениях смешивается с водой, спиртом, эфиром. И другими органическими растворами.
Билет №16.
Основания, их классификация и свойства на основе представлений об электролитической диссоциации.

Билет №17.
Соли, их состав и названия, взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена.

Билет №18.
Общая характеристика подгруппы галогенов, строение атомов, возможные степени окисления, физические и химические свойства.
Галогены- элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
В подгруппу галогенов входят фтор, хлор, бром, иод и астат. Первые четыре элемента встречаются в природе в виде различных соединений. Астат получен только искусственным путем, радиоактивен. Это р-элементы VII группы периодической системы Д . И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5
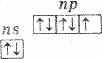
Этим объясняется общность их свойств. Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7.
Окислительно-восстановительные свойства и различия в химическом поведении галогенов легко понять, сравнивая эти свойства в зависимости от изменения заряда ядра при переходе от F к I. В ряду F, Cl, Br, I наибольшим радиусом атома (и, следовательно, наименьшим сродством к электрону) обладает I, поэтому он характеризуется менее выраженными окислительными свойствами, чем Br, Cl, F. Следовательно, окислительные свойства нейтральных атомов в подгруппе галогенов уменьшаются от F к I, а восстановительные усиливаются:

Галогены взаимодействуют почти со всеми простыми веществами.
Наиболее энергично протекает реакция с металлами.
Галогены в этой реакции проявляют сильные окислительные свойства. При этом атомы металла отдают электроны, а атомы галогена принимают, например:

При обычных условиях фтор реагирует с водородом в темноте со взрывом. Взаимодействие хлора с водородом протекает на ярком солнечном свету.
Галогены с кислородом и азотом непосредственно не взаимодействуют.
Хорошо реагируют галогены с другими неметаллами, например: 2Р+3Сl2=2РСl3 2Р+5Сl2=2РСl5 Si+2F2=SiF4
С водой. Фтор реагирует с водой со взрывом с образованием атомарного кислорода: H2O+F2=2HF+O
Билет №19.
Окислительно-восстановительные реакции (на примере взаимодействия алюминия с оксидами некоторых металлов, концентрированной серной кислоты с медью).


Билет №20.
Окислительно-восстановительные свойства серы и ее соединений.


Билет №21.
Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Сплавы железа.
Железо находится в побочной подгруппе VIII группы периодической системы.
Электронная формула атома железа:
![]()
Типичные степени окисления железа +2 и +3. Степень окисления +2 проявляется
за счет потери двух 4s-электронов. Степень окисления +3 соответствует также
при потере еще одного Зd-электрона, при этом Зd-уровень оказывается
заполненным наполовину; такие электронные конфигурации относительно
устойчивы.
Физические свойства. Железо – типичный металл, образует металлическую
кристаллическую решетку. Железо проводит электрический ток, довольно
тугоплавко, температура плавления 1539°С. От большинства других металлов железо
отличается способностью намагничиваться.
При реакции солей железа (II) и (III) со щелочами в осадок выпадают
нерастворимые гидроксиды:
![]()
Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом
воздуха:
![]()
Химические свойства. Железо реагирует со многими неметаллами:
![]()
Образуется железная окалина – смешанный оксид железа. Его формулу записывают
также так: FeО•Fe2О3.
![]()
Реагирует с кислотами с выделением водорода:
![]()
Сплавы железа. Современная металлургическая промышленность производит
железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К
первой группе относятся различные сорта чугуна, ко второй — различные сорта
стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать, волочить,
штамповать. Различие в механических свойствах чугунов и сталей зависит прежде
всего от содержания в них углерода — в чугунах содержится около 4% углерода,
а в сталях — обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из
чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят в
сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в
стали.
Билет №22.
Общие научные принципы химического производства на примере промышленного способа получения серной кислоты. Защита окружающей среды от химических загрязнений.
В сернокислотном производстве перерабатывают и получают такие вещества, как сероводород H2S, оксид серы (IV) SO2, оксид серы (VI) SO3, серную кислоту H2SO4. Эти вещества, присутствуя в воздухе, вредно отражаются на здоровье людей, губительно действуют на растения, разрушают постройки и т. п. Именно поэтому уделяется серьезное внимание проблеме охраны окружающей среды от загрязнения.
Ряд экологических проблем, связанных с производством серной кислоты. Первая связана с обжигом серного колчедана FeS2 и других сульфидных руд. При обжиге, протекающем в «кипящем слое», получающийся оксид металла, например Fe2O3, выделяется в атмосферу*:
![]()
Это можно объяснить тем, что для аппаратов обжига в «кипящем слое» требуется порошок руды, подвергшийся сильному измельчению. В результате обжига образуется оксид железа или другого металла с очень маленькими частицами. С улавливанием этих частиц фильтры могут не справиться. Частицы оксида могут попасть в атмосферу при выгрузке из печи. Попадание в атмосферу измельченных оксидов железа или других металлов называют металлизацией атмосферы.
При производстве серной кислоты в атмосферу попадает много оксида серы (IV):
![]()
Это связано с тем, что производственные установки не всегда герметичны, а также с тем, что иногда автоматические системы управления не справляются с работой, что приводит к аварийным выбросам.
Для производства серной кислоты нередко используется сера, получаемая из сероводорода .
Производится сера с помощью неполного окисления сероводорода Эта технологическая схема настолько несовершенна, что около 20% серы идет на образование оксида серы (IV), который выделяется в атмосферу.
В ходе производства возможны выбросы в атмосферу оксида серы (VI) и серной кислоты:
SO3 + Н2О = H2SO4
Эти выбросы считаются аварийными, но они возможны и, к сожалению, случаются нередко.
Один из способов разрешения экологических проблем — использование технологических схем, сводящих к минимуму загрязнение атмосферы:
непрерывность процесса;
циркуляционные процессы (непрореагировавшие вещества возвращаются в сферу реакции);
принцип противотока (увеличивается площадь поверхности реагирующих веществ и скорость реакции);
комплексное использование сырья, безотходная технология;
выбор оптимального сырья и режима его переработки.
Билет №23.
Причины многообразия неорганических и органических веществ; взаимосвязь веществ.


Билет №24.
Высшие кислородосодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств.
Фосфор образует целый ряд кислородсодержащих кислот. Некоторые из них мономерны. например фосфиновая, фосфористая и фосфорная кислоты. Кислоты фосфора могут быть одноосновными либо многоосновными Наиболее важной из всех этих кислот является фосфорная(V) кислота (другое ее название - ортофосфорная кислота). При нормальных условиях она представляет собой белое кристаллическое вещество, расплывающееся при поглощении влаги из воздуха. Ее 85%-ный водный раствор называют «сиропообразной фосфорной кислотой». Фосфорнця(V) кислота является слабой трехосновной кислотой.
Хлор образует несколько кислородсодержащих кислот. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и сила кислоты:
НОCl < НСlO2 < НСlO3 < НClO4
НClO3 и НClO4 - сильные кислоты, причем НСlO4 - одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только НСlO4 удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием его степени окисления:
НОСl и НClO2 - особенно хорошие окислители. Например, кислый раствор НОCl:
1) окисляет ионы железа (II) до ионов железа (III):
2) на солнечном свету разлагается с образованием кислорода:
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат (V)-ионы:
Остальные высшие кислотсодержащие кислоты элементов третьего периода (H3AlO3, H2SiO3) более слабые, чем фосфорная кислота. Серная кислота (H2SO4) менее сильнае, чем хлорная (VII) кислота, но более сильная, чем фосфорная кислота. Вообще, при увеличении степени окисления элемента, образующего кислоту, увеличивается сила самой кислоты:
H3AlO3 < H2SiO3 < H3PO4 < H2SO4 < НСlO4
Билет №25.
Общие способы получения металлов. Практическое значение электролиза (на примере электролиза солей бескислородных кислот).






Билет №26.
Основные положения теории химического строения органических веществ А. М. Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах.
Атомы в молекулах органических веществ связаны в определенной последовательности, согласно их валентности.

Свойства химических веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов.
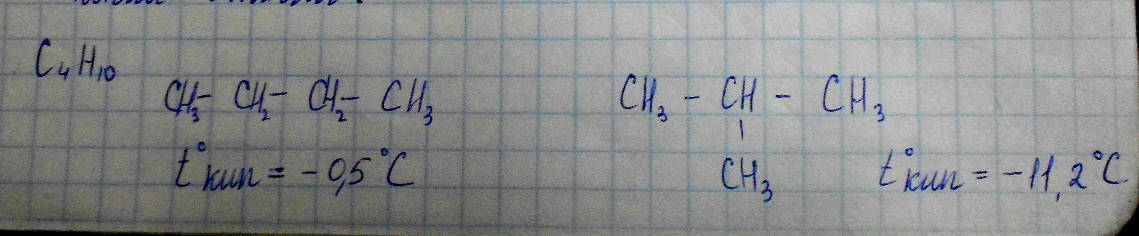
Н-бутан(нормальный) Изо-бутан(равный)
Это положение позволило объяснить явление изомерии, при котором существует вещества изомеры. Изомерами называют вещества имеющие одинаковый качественный и количественный состав, но разный порядковые соединения атомов и поэтому разные свойства.
По свойствам данного вещества можно определить его строение, а по строению предсказать свойства.
Атомы в молекулах органических веществ взаимно влияют друг на друга.

Билет №27.
Изомерия органических соединений и ее виды.



Билет №28.
Предельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применения метана.
Предельными называются углеводороды имеющие общую формулу СnH2n+2 в молекулах, которых все связи атомов С насыщены до предела другими атомами.
Мета́н — простейший углеводород, бесцветный газ без запаха, химическая формула — CH4. Малорастворимый в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Сам по себе метан не токсичен и не опасен для здоровья человека. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики и во многих случаях метан для лабораторий и промышленных производств остается без запаха.
Химические свойства
1. Метан горит бледным синеватым пламенем, образуя оксид углерода(IV) и воду:
CH4 + 2O2 = CO2 + 2H2O.
2. При сильном нагревании без доступа воздуха метан разлагается:
![]()
В печах специальной конструкции распад метана может быть осуществлен до промежуточного продукта – ацетилена:
![]()
3. Метан при обычной температуре обладает большой стойкостью к кислотам, щелочам и многим окислителям. Однако он вступает в реакцию с разбавленной азотной кислотой при температуре 140 оСи небольшом давлении (радикальная реакция, реакция Коновалова):
![]()
Билет №29.
Непредельные углеводороды, общая формула и химическое строение гомологов данного ряда. Свойства и применение этилена.
Называются углеводороды имеющие общую формулу CnH2nв молекулах которых между атомами С имеется двойная связь.

Физические свойства
Этилен- бесцветный газ со слабым запахом, плохо растворим в воде, но хорошо в спирте. Горит светящимся пламенем. С воздухом этилен образует взрывчатую смесь.
Химические свойства
Обесцвечивания перманганата калия

Реакция гидрирования

Гидратация этилена

Применение
Этилен служит сырьем для производства этилового спирта, полиэтилена, окиси этилена, уксусной и пропиновой кислоты, этилбензола
Билет №30.
Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.



Билет №31.
Диеновые углеводороды, их химическое строение, свойства, получение и практическое значение. Натуральный и синтетический каучуки.
Называются углеводороды имеющие общую формулу CnH2n-2 в молекулах которых атомах С имеются 2-е двойные связи. Наибольшее значения имеют два диеновых углеводорода.



Получение синтетического каучука — основная область применения диеновых углеводородов (главным образом бутадиена и изопрена). Натуральный каучук — полимер изопрена: n=1000-3000

Синтетический
каучук в промышленном масштабе впервые
был получен в 1932 г. в нашей стране по
способу С. В. Лебедева:
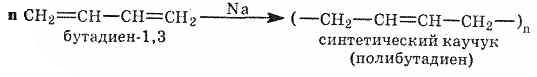
Билет №32.
Ацетилен – представитель углеводородов с тройной связью в молекуле. Свойства, получение и применение ацетилена.
Из ацетилена путем замещения в его молекуле атомов водорода можно получить другие члены гомологического ряда, их общая формула CnH2n-2

Физические свойства. Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Химические свойства. По химическим свойствам ацетилен во многом аналогичен этилену. Для него характерны реакции присоединения, окисления и полимеризации.
1. Присоединение водорода (реакция гидрирования) происходит при нагревании в присутствии катализатора. Реакция протекает в две стадии, сначала образуется этилен, а затем – этан:
![]()
2. Присоединение галогенов (реакция галогенирования) протекает очень легко (также в две стадии):

3. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
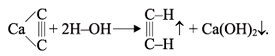
 Получение
ацетилена. В
лаборатории и в промышленности ацетилен
получают взаимодействием карбида
кальция с водой (карбидный способ):
Получение
ацетилена. В
лаборатории и в промышленности ацетилен
получают взаимодействием карбида
кальция с водой (карбидный способ):
Карбид кальция получают в электропечах при нагревании кокса с негашеной известью:
![]()
На получение CaC2 затрачивается много электроэнергии, поэтому карбидный метод не может удовлетворить потребности в ацетилене.
В промышленности ацетилен получают в результате высокотемпературного крекинга метана:
![]()
Применение ацетилена в органическом синтезе. Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают уксусную кислоту, растворители. При сжигании ацетилена в кислороде температура пламени достигает 3150 °С, поэтому его используют при сварке и резке металлов.
Билет №33.
Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов.
Ароматические углеводороды, или арены, – это соединения углерода с водородом, в молекулах которых содержится бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей.
Простейшим представителем аренов является бензол C6H6. Гомологический ряд бензола имеет общую формулу CnH2n-6.

Физические свойства. Бензол – бесцветная, летучая, огнеопасная жидкость со своеобразным запахом. В воде практически нерастворим, но служит хорошим растворителем для многих органических веществ. Горит сильно коптящим пламенем (92,3 % массы приходится на углерод). Пары' бензола с воздухом образуют взрывчатую смесь. Жидкий бензол и пары' бензола ядовиты. Температура кипения бензола 80,1 °С. При охлаждении он легко застывает в белую кристаллическую массу с температурой плавления 5,5 °С.
Химические свойства. Ядро бензола обладает большой прочностью. Этим и объясняется склонность аренов к реакциям замещения. Они протекают легче, чем у предельных углеводородов.
1) Нитрование. При действии на бензол нитрующей смеси (смесь концентрированных азотной и серной кислот) атом водорода замещается нитрогруппой NO2:

2) Бензол очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4.
3) Бензол на воздухе горит коптящим пламенем:
2C6H6 +
15O2 ![]() 12CO2
12CO2![]() +
6H2O.
+
6H2O.
Получение бензола.
Бензол получают из нефти и каменноугольной смолы, образующейся при коксовании каменного угля.
Бензол получают при сплавлении солей ароматических кислот со щелочью: C6H5–COONa + NaOH —> C6H6 + Na2CO3.
Применение бензола и его гомологов.
Бензол C6H6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C6H5NO2(растворитель, из него получают анилин), хлорбензола C6H5Cl, фенола C6H5OH, стирола и т.д.
Толуол C6H5–CH3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2. Технический ксилол – смесь трех изомеров (орто-, мета- и пара-ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C6H5–CH(CH3)2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С6Сl6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C6H5 – CH = CH2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
Билет №34.
Природные источники углеводородов: нефть, природный газ и их практическое использование.
По запасам природного газа первое место в мире принадлежит нашей стране. В природном газе содержатся углеводороды с низкой молекулярной массой. Состав газа специфичен для каждого месторождения. Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его содержится в природном газе.
Природный газ широко используется как дешевое топливо с высокой теплотворной способностью. Это один из лучших видов топлива для бытовых и промышленных нужд. Кроме того, природный газ служит ценным сырьем для химической промышленности: получения ацетилена, этилена, водорода, сажи, различных пластмасс, уксусной кислоты, красителей, медикаментов и других продуктов.
Попутные нефтяные газы находятся в залежах вместе с нефтью: они растворены в ней и находятся над нефтью, образуя газовую “шапку”. При извлечении нефти на поверхность газы вследствие резкого падения давления отделяются от нее. Раньше попутные газы не находили применения и при добыче нефти сжигались факельным способом. В настоящее время их улавливают и используют как топливо и ценное химическое сырье.
Нефть – маслянистая горючая жидкость темно-бурого или почти черного цвета с характерным запахом. Она легче воды. о составу нефть – сложная смесь углеводородов различной молекулярной массы, поэтому у нее нет определенной температуры кипения. Сырая нефть обычно не применяется. Для получения из нефти технически ценных продуктов ее подвергают переработке.
Первичная переработка нефти заключается в ее перегонке. Перегонку производят на нефтеперерабатывающих заводах после отделения попутных газов. При перегонке нефти получают светлые нефтепродукты:
бензин
лигроин
керосин
газойль
Билет №35.
Предельные одноатомные спирты, их строение, свойства. Получение и применение этилового спирта.
Одноатомные спирты предельного ряда образуют гомологический ряд, в котором всеч оены ряда отличаются друг от друга на группу CH2.
Общая формула СnН2n+1OH
Строение молекул
И з
электронной формулы спирта видно, что
в его молекуле химическая связь между
атомом кислорода и атомом водорода
весьма полярна. Поэтому водород имеет
частичный положительный заряд, а кислород
– отрицательный. И как следствие: 1) атом
водорода, связанный с атомом кислорода,
подвижен и реакционноспособен; 2) возможно
образование водородных связей между
отдельными молекулами спирта и между
молекулами спирта и воды
з
электронной формулы спирта видно, что
в его молекуле химическая связь между
атомом кислорода и атомом водорода
весьма полярна. Поэтому водород имеет
частичный положительный заряд, а кислород
– отрицательный. И как следствие: 1) атом
водорода, связанный с атомом кислорода,
подвижен и реакционноспособен; 2) возможно
образование водородных связей между
отдельными молекулами спирта и между
молекулами спирта и воды
Получение
В промышленности:
а) гидратацией алкенов:
![]()
б) сбраживанием сахаристых веществ:
![]()
в) путем гидролиза крахмалосодержащих продуктов и целлюлозы с последующим сбраживанием образовавшейся глюкозы;
г) из синтез-газа получают метанол:
![]()
В лаборатории:
а) из галогенопроизводных алканов, действуя на них AgOH или КОН:
С4Н9Вr
+ AgОН ![]() С4Н9OН
+ AgBr
С4Н9OН
+ AgBr![]() ;
;
б) гидратацией алкенов:
![]()
Химические свойства
1. Взаимодействие со щелочными металлами:
2C2H5 – OH + 2Na 2C2H5 – ONa + H2 .
2. Взаимодействие с кислотами:

3. Реакции окисления:
а) спирты горят:
2С3Н7ОН + 9O2 6СО2 + 8Н2О;
б) в присутствии окислителей спирты окисляются:
![]()
4. Спирты подвергаются дегидрированию и дегидратации:

Физические свойства
Предельные одноатомные спирты от C1 до C12 -- жидкости. Высшие спирты -- мазеобразные вещества, от C21 и выше -- твердые вещества.
Все спирты легче воды (плотность ниже единицы). Температура кипения спиртов нормального строения повышается с увеличением молекулярной массы. Спирты нормального строения кипят при более высокой температуре, чем спирты с изостроением. В воде хорошо растворяются метиловый, этиловый и пропиловый спирты. С увеличением молекулярной массы растворимость спиртов снижается. Низшие спирты легче воспламеняются и горят бесцветным пламенем. Спирты с большой молекулярной массой коптят при горении.
![]() Применение
спиртов
Применение
спиртов
Метанол
прекрасный растворитель,
сырье для производства формальдегида и некоторых лекарственных веществ,
добавка к моторному топливу для увеличения октанового числа.
Применение этанола обширно. Но, в связи с применением его в приготовлении алкогольных напитков, напомним, что этиловый спирт – этонаркотик и яд.
Значительное
количество глицерина идет на изготовление
взрывчатого вещества (ВВ) нитроглицерина 
Несмотря на взрывоопасность, в очень малых дозах его применяют в медицине в качестве лекарственного средства при сердечно-сосудистых заболеваниях.
Билет №36.
Фенол, его химическое строение, свойства, получение и применение.
Производное бензола, в котором один атом Н замещен на функциональную группу ОН
Общая формула r–oh или r(oh)n Строение молекул
В отличие от радикалов алканов (СН3–,
С2Н5 –
и т. д.) бензольное кольцо обладает
свойством притягивать к себе электронную
плотность кислородного атома гидроксильной
группы.
Вследствие этого атом кислорода
сильнее, чем в молекулах спиртов,
притягивает к себе электронную плотность
от атома водорода. Поэтому в молекуле
фенола химическая связь между атомом
кислорода и атомом водорода становится
более полярной, а водородный атом более
подвижен и реакционноспособен.
отличие от радикалов алканов (СН3–,
С2Н5 –
и т. д.) бензольное кольцо обладает
свойством притягивать к себе электронную
плотность кислородного атома гидроксильной
группы.
Вследствие этого атом кислорода
сильнее, чем в молекулах спиртов,
притягивает к себе электронную плотность
от атома водорода. Поэтому в молекуле
фенола химическая связь между атомом
кислорода и атомом водорода становится
более полярной, а водородный атом более
подвижен и реакционноспособен.
Получение
В промышленности:
а) выделяют из продуктов пиролиза каменного угля; б) из бензола и пропилена:

в) из бензола:
С6Н6 С6Н5Сl С6Н5 – OH.
Физически свойства
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество, tпл = 430C, tкип = 1820C, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком, поэтому с фенолом необходимо обращаться осторожно!
Сам фенол и его пары ядовиты. Но существуют фенолы растительного происхождения, содержащиеся, например, в чае. Они благоприятно действуют на организм человека.
Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде.
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
Химические свойства
