- •К госэкзамену по химии (д/о, 4 курс, магистры по кафедре физической химии) Вопросы
- •Сольватация и гидратация Недостатки теории электролитической диссоциации Аррениуса
- •Теплоты сольватации (гидратации)
- •Модельные методы расчета энергии гидратации ионов
- •Определение реальных энергий гидратации ионов
- •Энтропия сольватации ионов
- •Состояние ионов в растворах
- •2. Теоретическая интерпретация электропроводности
- •1. Гидродинамическая теория
- •2. Теория электропроводности Дебая – Онзагера
- •3. Кинетическая теория электропроводности
- •4. Прототропная теория электропроводности
- •Электроды первого рода
- •Электроды второго рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •4. Неравновесные электродные процессы. Электродная поляризация, перенапряжение. Теория электрохимического перенапряжения Эрдей-Груза и Фольмера
- •Эдс поляризации. Электродная поляризация и ее виды
- •Понятие об электрохимической стадии
- •Основы теории электрохимического перенапряжения
- •5. Реакция катодного выделения водорода: опытные закономерности, возможные стадии реакции, механизм водородного перенапряжения на различных металлах Общая характеристика процесса
- •Закономерности перенапряжения выделения водорода
- •1. Влияние плотности тока
- •2. Влияние природы металла
- •3. Влияние природы и состава раствора
- •4. Влияние температуры и некоторых других факторов
- •Возможные стадии и пути протекания процесса катодного выделения водорода
- •Природа водородного перенапряжения на различных металлах
- •6. Анодное растворение металлов. Пассивность
- •Общая характеристика анодного растворения металлов
- •Пассивность металлов
- •Природа металлического перенапряжения
Закономерности перенапряжения выделения водорода
1. Влияние плотности тока
Уже в 1905 г. Тафель эмпирически вывел уравнение, которое связывает перенапряжение с плотностью тока, проходящего через раствор, то есть со скоростью электрохимического процесса:
= а + b lg i ,
где – перенапряжение, В; a и b – константы; i – плотность тока, А/см2.
Смысл величины а : а дает значение перенапряжения при i = 1 А/см2. Величина а существенно зависит от материала электрода.
Величина b мало зависит от материала электрода и является характеристикой самого электрохимического процесса; в большинстве случаев она приблизительно равна 22,303RT/zF , то есть 0,118-0,120 В при z = 1 и Т = 298 К. Это значит, что при увеличении плотности тока в 10 раз увеличивается на 0,118-0,120 В. Однако величина b в ряде случаев может составлять и 0,030 В. Физический смысл величины b: тафелевский коэффициент b является мерой влияния плотности тока на величину перенапряжения; b соответствует наклону тафелевской прямой в координатах – lg i.
Формула Тафеля соответствует опыту в очень широком интервале величин i (от 10–6 до 1 и более А/см2 ); при очень малых токах она, естественно, неприменима. В области малых отклонений от равновесного потенциала наблюдается линейная связь между и i:
= R i ,
где R – поляризационное сопротивление.
2. Влияние природы металла
В зависимости от величины перенапряжения водорода (величины а) металлы можно разбить на 3 группы:
Металлы с высоким значением перенапряжения выделения водорода (в кислотах а = 1,2-1,55 В): Pb, Tl, Hg, Cd, Zn, Sn.
Металлы со средним значением перенапряжения водорода (а = 0,5-0,8 В): Cu, Ag, Fe, Co, Ni.
Металлы с низким перенапряжением водорода (а = 0,1-0,3 В): Pt, Pd.
Помимо материала электрода, на величину а влияет состояние его поверхности. Константа а уменьшается при развитии поверхности и при освобождении ее от поверхностных окислов.
Величина b меняется в более узких пределах – от 0,030 до 0,120 В, и только в редких случаях (для технических и окисленных металлов) она больше 0,120. Низкие значения b наблюдаются для металлов с низким перенапряжением (Pt, Pd); для большинства металлов, в том числе для всех металлов с высоким перенапряжением, b составляет около 0,120 В.
Измерения, проведенные с монокристаллами различных металлов, показали, что перенапряжение в значительной степени зависит от символа грани монокристалла, на которой катодно выделяется водород. Поэтому величины , найденные для твердых катодов с поликристаллической структурой, представляют собой некоторые усредненные значения.
3. Влияние природы и состава раствора
а) Влияние растворителя. Наибольшее число исследований по перенапряжению водорода выполнено с водными растворами. Для ртути и для некоторых других металлов были получены данные также и в неводных растворах кислот. Характер изменения с изменением растворителя точно не установлен. Перенапряжение выделения водорода на ртути из раствора HCl в этиловом и метиловом спиртах ниже, чем из водных растворов; для Cu и Ni в спиртовых растворах оно выше, чем в водных. Для металлов с низким природа растворителя играет меньшую роль.
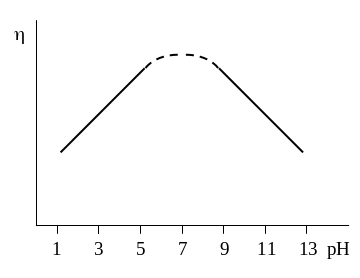
б) Влияние рН раствора на перенапряжение водорода с наибольшей полнотой изучено на ртути. Установлено, что в растворах чистых кислот в области концентраций до 0,1 н не является функцией рН; при более высоких концентрациях зависит от рН, уменьшаясь с увеличением концентрации кислоты, причем /рН составляет примерно 60 мВ. Если растворы кроме кислоты содержат также избыток постороннего электролита, то подобное изменение с рН наблюдается и для концентраций кислоты, меньших 0,1 н. При избытке постороннего электролита такой ход с рН наблюдается и для разбавленных растворов щелочей. Таким образом, максимальное перенапряжение водорода соответствует нейтральным растворам и линейно уменьшается с отклонением рН в ту или иную сторону от точки нейтральности (см. рис. 39). В концентрированных растворах кислот и оснований соотношение между и составом раствора становится более сложным.
Для других металлов: на Ni изменяется с рН незначительно и не подчиняется простой линейной зависимости; на Pt оно почти не зависит от рН раствора.
|
Рис. 39. Зависимость перенапряжения выделения водорода от рН в растворах с постоянной ионной силой; i = const |
в) перенапряжение водорода очень чувствительно к присутствию в электролите посторонних веществ. Добавки солей к разбавленным растворам кислот увеличивают на ртути, причем увеличение концентрации 1-1 зарядного электролита в 10 раз (при постоянном рН) повышает примерно на 55-58 мВ. Первоначальная добавка электролита с поливалентным катионом оказывает большее действие, чем такая же добавка 1-1 зарядного электролита. Поверхностно-активные вещества (анионы, катионы и молекулярные вещества) или повышают, или понижают на ртути, в зависимости от их природы. ПАВ сильнее всего влияют на величину в области малых плотностей тока; действие этих добавок ослабляется с ростом плотности тока и при высоких ее значениях полностью исчезает. На Pt, Fe и Ni также возрастает при введении ПАВ; характер влияния ПАВ на и на этих металлах является функцией потенциала электрода.