
- •Основные физико-химические методы анализа
- •Хроматографические метод анализа
- •Теоретические основы хроматографии
- •Газовая хроматография
- •Качественный анализ
- •Количественный анализ
- •Влияние температуры
- •Спектроскопические методы-
- •Молекулярная абсорбционная спектроскопия
- •Ограничения и условия применимости закона Бугера-Ламберта –Бера
- •Спектры поглощения
- •Чувствительность фотометрических методов
- •Основные узлы приборов абсорбционной спектроскопии
- •Светофильтры
- •Электрохимические методы
- •Потенциометрическое титрование
- •Кулонометрия
- •Условия проведения прямых и косвенных кулонометрических определений
- •Прямая кулонометрия
- •Кулонометрическое титрование
- •Вольтамперометрия
- •Амперометрическое титрование
- •Кондуктометрия
- •Кинетические методы анализа
Основные физико-химические методы анализа
Общее число физико-химических анализо составляет несколько десятков. Наибольшее практическое значение среди них имеют следующие:
- спектроскопические методы;
-электрохимические методы;
-хроматографические методы анализа.
Хроматографические метод анализа
Приблизительно 60 % всех анализов в мире выполняется хроматографически. Достоинства метода: универсальность, экспрессность, чувствительность. 14 работ (1957-1980), выполненных с применением хроматографических методов, были удостоены Нобелевских премий.
Честь открытия хроматографии принадлежит русскому ботанику Михаилу Цвету, который предложил метод колоночной хроматографии в 1903 году. Используя колонку, содержащую мелко размолотый карбонат кальция (мел), он установил, что считавшийся однородным зеленый пигмент растений - хлорофилл – на самом деле состоит из нескольких веществ.
Слово «хроматография», предложенное Цветом в 1906 г., образовано из двух греческих слов «цвет» и «писать»
Х роматография
– это физико-химический метод разделения
веществ, основанный на распределении
компонентов между двумя фазами -
неподвижной и подвижной.
роматография
– это физико-химический метод разделения
веществ, основанный на распределении
компонентов между двумя фазами -
неподвижной и подвижной.
Метод можно определить как процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента.



Сорбция - процесс поглощения твердым телом или жидкостью (сорбентом) газообразного или растворенного вещества (сорбата), обратный процесс называют десорбцией. Сорбцию подразделяют на адсорбцию, абсорбцию, хемосорбцию.
Если смежными фазами являются газ и твердое тело или жидкость и твердое тело, то происходит концентрирование вещества на поверхности твердой фазы, поглощение вещества твердой фазой. Такой процесс называется адсорбцией.
Если смежными фазами являются газ и жидкость, и газ поглощается жидкостью, то такой процесс называется абсорбцией.
Адсорбция и абсорбция подразделяются на физическую, которая обуславливается силами притяжения, и химическую, которая происходит за счет валентно-химического воздействия.
Неподвижной (стационарной) фазой обычно служит твердое вещество (его часто называют сорбентом) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу.
При постоянной температуре адсорбция увеличивается с ростом концентрации раствора или давления газа. Зависимость количества поглощенного вещества от концентрации раствора или давления газа при постоянной температуре называют изотермой адсорбции. Математически эта зависимость может быть выражена уравнением Ленгмюра.
![]()
где n – количество адсорбированного вещества при равновесии;
n∞- максимальное количество вещества, которое может быть адсорбировано на данном адсорбенте;
b- постоянная;
с – концентрация.
По
Ленгмюру на поверхности твердого тела
имеется некоторое число мест с минимальной
энергией, расположенных через определенные
интервалы по всей поверхности. Их число
равно n∞.
На этих местах могут адорбироваться
молекулы из раствора или газа.
В области небольших концентраций
изотерма линейна (рисунок), т.к. при bс
<<1 знаменатель становится равным
единице и уравнение переходит в:
![]()
 n
n
с
Изотерма адсорбции
Это уравненение линейной адсорбции. Оно соответствует уравнению Генри. (Г-коэффициент Генри).
При высокой концентрации bc>>1 уравнение Ленгмюра принимает вид n=n∞, что соответствует насыщению: изотерма адсорбции выходит на прямую, параллельную оси абсцисс.
Иногда зависимость количества адсорбированного вещества от концентрации раствора или давления газа отличается от изображенной на рисунке (например, имеет вид вогнутой или S-образной кривой). Это может быть вызвано образованием на поверхности адсорбента полимолекулярного слоя или неоднородностью поверхности.
При адсорбции двух или нескольких веществ уравнение Ленгмюра для i-того компонента принимает вид
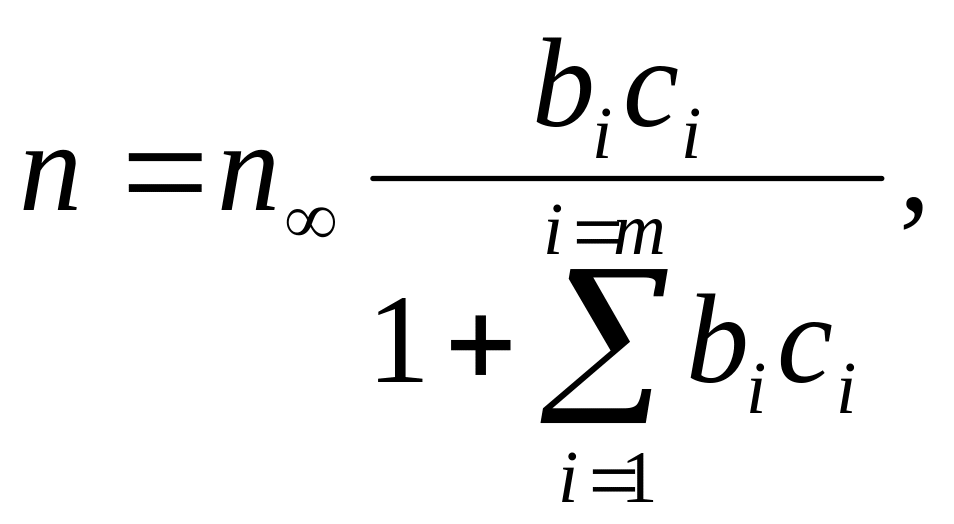
Количество адсорбированного вещества определяется не только его концентрацией, но и сродством к адсорбенту. При адсорбции нескольких веществ, проявление сродства особенно заметно, так как возможно вытеснение одних сорбированных веществ другими, обладающими большим сродством, хотя имеющими, может быть, и меньшую концентрацию.
Классификация хроматографических методов
Методы хроматографии можно классифицировать:
-по агрегатному состоянию фаз;
-способу их относительного перемещения;
-аппаратурному оформлению процесса и т.д.
Классификация хроматографических методов по агрегатному состоянию фаз
Неподвижная фаза |
Подвижная фаза |
|
газообразная |
жидкая |
|
Твердая |
Газовая адсорбционная хроматография |
Жидкостная адсорбционная, ионообменная, ионная, тонкослойная, осадочная хроматография |
Жидкая |
Газожидкостная распределительная хроматография, капиллярная |
Жидкостная распределительная, высокоэффективная жидкостная, гельхроматография |
По способу относительного перемещения фаз различают проявительную (или элюентную), фронтальную и вытеснительную хроматографию.
Проявительный (элюентный) метод. При работе по этому методу в колонку вводят анализируемую смесь в виде порции раствора или газа и колонку непрерывно промывают газом – носителем или растворителем.
В газе или растворе, вытекающем из колонки, сначала появляется трудно сорбирующийся компонент, затем чистый растворитель, затем хорошо сорбирующийся компонент. Чем больше концентрация компонента, тем больше площадь пика. Метод наиболее часто применяется в практике.
Фронтальный метод состоит в том, что через колонку с адсорбентом непрерывно пропускают анализируемую смесь в растворителе. В растворе, вытекающем из колонки, определяют концентрацию каждого компонента и строят график в координатах концентрация – объем пропущенного раствора. Метод используется сравнительно редко, например, для очистки раствора от примесей, если они сорбируются сравнительно лучше, чем основной компонент, или для выявления наиболее слабо сорбирующегося вещества.
Вытеснительный метод. В этом методе анализируемую смесь вводят в колонку и промывают раствором вещества, сорбирующимся лучше, чем любой из компонентов анализируемой смеси (вытеснитель).
Хроматографический пик и элюционные характеристики.
При проведении хроматографического анализа выбирают нужную подвижную и неподвижную фазы в зависимости от свойств анализируемых веществ, устанавливают необходимый режим хроматографа (температуру, скорость подачи подвижной фазы, детектор), затем проводят хроматографическое разделение и регистрируют сигнал. График, связывающий сигнал с объемом газа носителя V или временем его прохождения τ через колонку называют хроматограммой. На хроматограмме каждому компоненту анализируемой пробы отвечает соответствующий пик. На выходе из колонки устанавливается детектор – прибор, который непрерывно фиксирует какое –либо свойство вещества, сигнал подается на самописец или др. регистрирующий прибор.
Типичная хроматограмма проявительного анализа.
c
D
C E h h1
▪ ▪ ▪ ▪ ▪
А1 А В G F
 В1
F1
V
В1
F1
V
Если:
точка А1 соответствует вводу анализируемой пробы,
А-появлению на выходе какого-то несорбирующегося компонента,
В - анализируемого вещества,
то линию
А1АВ и ее продолжение ВF называют нулевой линией.
Кривую ВDF называют хроматографическим пиком и характеризуют высотой, шириной и площадью.
Высотой пика считают либо величину h, либо h1 . Шириной пика называют расстояние между точками контура на половине его высоты (ω0,5 =СЕ).
Важной хроматографической характеристикой системы является время удерживания или пропорциональный ему удерживаемый объем. На рисунке приведенному удерживаемому объему соответствует отрезок AG, а общий удерживаемый объем характеризуется отрезком A1G. Если длину отрезка A1G обозначить l , то время удерживания τ, будет равно
![]()
где U – скорость движения ленты самописца.
Удерживаемый объем V уд пропорционален времени удерживания τуд.
![]() ,
,
где α – объемная скорость газа-носителя.
Приведенный удерживаемый объем Vприв , соответствующий отрезку AG, определяется соотношением
![]()
где V0 пропорционален отрезку АА1 , длина которого l0 .
Величина V0 характеризует удерживаемый объем несорбирующегося газа, или мертвый объем колонки.
Полнота разделения двух компонентов количественно может быть выражена критерием разделения К:
![]()
где ∆l - расстояние между максимумами пиков разделяемых элементов;
ω0,5 - полуширина хроматографического пика первого (1) и второго (2) компонентов на половине высоты
При К=1 разделение достаточно полное.
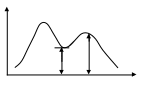
При взаимном перекрывании пиков определение ширины зоны каждого пика становится невозможным. В таких случаях рассматривают степень разделения φ:
где
h2
– высота
пика вещества, имеющего меньшую
концентрацию;
hmin
- высота
минимума.
![]()
hmin h2
t
Определение степени разделения
В количественном анализе важно, чтобы четкость разделения обеспечивала достаточную точность определения высоты или площади пика.
