
MOLEKULYaRNYE_OSNOVY_BIOENERGETIChESKIKh_PROTsESSOV
.docxМОЛЕКУЛЯРНЫЕ ОСНОВЫ БИОЭНЕРГЕТИЧЕСКИХ ПРОЦЕССОВ
И ОБЩИЕ ПУТИ КАТАБОЛИЗМА В ОРГАНИЗМЕ ЧЕЛОВЕКА
1.Понятие метаболизма.Стадии метаболизма.Цикл трикарбоновых кислот(цикл Кребса),его роль в обмене углеводов,липидов,аминокислот.
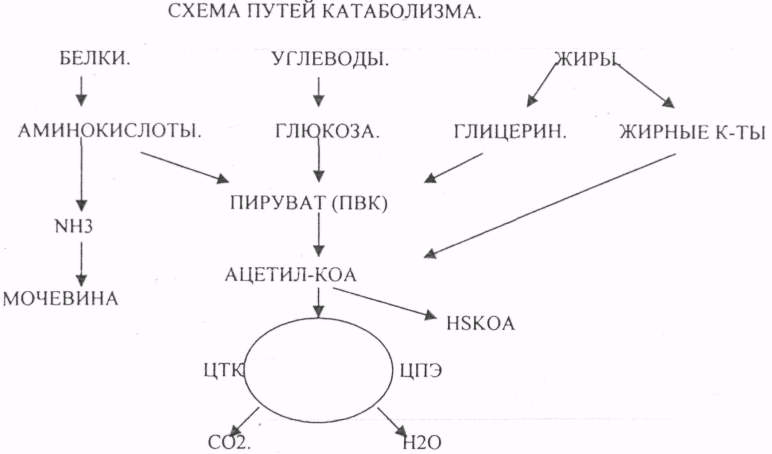
метаболизм – это совокупность протекающих в организме химических превращений, обеспечивающих его рост, развитие и адаптацию к изменениям окружающей среды.существует три стадии:
1-в ЖКТ р-ции гидролиза пищевых в-в. Хим.энергия рассеивается в виде тепла.
2- внутриклеточный катаболизм – в цитоплазме и митохондриях. Хим.энергия ЧАСТИЧНО рассеивается в виде тепла,ЧАСТИЧНО накапливается в виде восстановленных коферментных форм, ЧАСТИЧНО запасается в виде АТФ.
3- в митохондриях образуются конечные продукты катаболизма (CO2 и H2O)хим энергия частично в виде тепла, а 40-45% в виде АТФ.
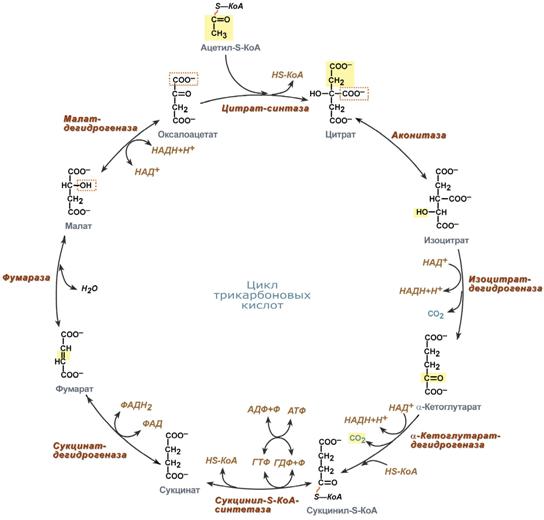
Функции цикла Кребса
-
Водороддонорная функция. Цикл Кребса поставляет субстраты для дыхательной цепи (НАД-зависимые субстраты: изоцитрат,-кетоглутарат, малат; ФАД-зависимый субстрат – сукцинат).
-
Катаболическая функция.В ходе ЦТК окисляются до конечных продуктов обмена ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты).
-
Анаболическая функция. Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глу и асп; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема).
-
Анаплеротическая функция.Цикл не прерывается благодаря реакциям анаплероза (пополнения) фонда его субстратов. Важнейшей анаплеротической реакцией является образование ЩУК (молекулы, запускающей цикл) путем карбоксилирования ПВК.
-
Энергетическая функция. На уровне сукцинил-КоА происходит субстратное фосфорилирование с образованием 1 молекулы макроэрга. Помимо этого, 4 дегидрогеназные реакции в цикле Кребса создают мощный поток электронов, богатых энергией. Эти электроны поступают в дыхательную цепь внутренней мембраны митохондрий. Конечным акцептором электронов является кислород. При последовательном переносе электронов на кислород выделяется энергия, достаточная для образования 9 молекул АТФ путем окислительного фосфорилирования.Примечание: более понятной эта цифра станет после того, как мы познакомимся с работой дыхательной цепи и с ферментом, синтезирующим АТФ.
Регуляция цтк
Первый фермент цитратсинтаза ингибируется АТФ, жирными кислотами. Лимитирующим ферментом (катализирует самую медленную реакцию) являетсяизоцитратДГ.Он активируется АДФ, НАД+, ингибируется АТФ, восстановленной формой НАДН·Н+. Когда в клетке достаточно АТФ (покой), скорость цикла снижается, при распаде же АТФ образуется АДФ, который активирует самую медленную реакцию и, следовательно, скорость всего цикла в целом.
Познакомившись с центральными путями метаболизма, основное назначение которых — отделение от субстратов атомов водорода, проследим за судьбой этих атомов, за тем, как происходит их окисление кислородом до воды.
2\ Метаболический путь— последовательность химических превращений вещества. Метаболические пути многоэтапны, взаимосвязаны, регулируемы, скоординированы в пространстве. Они бывают линейными (распад и синтез гликогена, гликолиз и др.) и циклическими (цикл трикарбоновых кислот, орнитиновый цикл).
Тканевое дыхание - основа биологического окисления и представляет собой совокупность окислительно-восстановительныхреакций, связанных с потреблением организмом кислорода, освобождением химической энергии, выделением углекислого газа и воды. Часть окислительных реакций в организме не сопровождается накоплением энергии и не входит в комплекс тканевого дыхания. Эти реакции осуществляют превращения некоторых веществ (например, окисление при образовании стероидных гормонов, желчных кислот и т. д.).
При тканевом дыхании одно из веществ окисляется, другое - восстанавливается. Окисляемым веществом, илисубстратом, считают то вещество, которое в ходе химических реакций теряет протоны и электроны или присоединяет кислород. Вещество, которое присоединяет протоны и электроны или теряет кислород, считаетсявосстановленным. Протоны и электроны называютвосстанавливающими эквивалентами. Они переносятся от одного соединения -донора - к другому -акцептору. У аэробов конечным акцептором восстанавливающих эквивалентов является кислород.
Дыхательная цепь – это своеобразный конвейер по переносу электронов от окисляющегося субстрата к кислороду. Она составлена из нескольких типов переносчиков ē и Н+, и её можно представить в виде следующей обобщённой схемы:
В процессе распада углеводов, жиров и белков образуются соединения, которые представляют собой субстраты биологического окисления (SН2). Преимущественно они образуются в цикле Кребса (изоцитрат, α-кетоглутарат, сукцинат, малат). Под действием НАД- и ФАД-зависимых дегидрогеназ от них отщепляется по два атома водорода. После этого начинается транспорт протонов и электронов водорода по дыхательной цепи.
Восстановленный НАДН2взаимодействует с дегидрогеназой, содержащей ФМН в качестве кофермента. ФМН акцептирует (забирает) водород, отщепляемый от НАДН2.
Следующий компонент дыхательной цепи коэнзимQ (убихинон) принимает 2Н от ФМН. Убихинон представляет собой узловой пункт, куда стекается водород, поступающий в дыхательную цепь от самых различных субстратов.
Если 3 первых компонента дыхательной цепи – НАД, ФМН и убихинон – переносили водород, то есть: и протоны, и электроны, то, начиная с цитохрома bи до кислорода потоки протонов и электронов разделяются, так как дальнейший участок дыхательной цепи содержит только переносчики электронов. От коэнзимаQ два электрона переходят на две молекулы цитохромаb,затем последовательно на цитохромы c1, c, a, a3. Кислород, присоединив два электрона от двух молекул цитохромаa3, взаимодействует с двумя протонами и превращается в воду.
Направление переноса электронов в дыхательной цепи определяют окислительно-восстановительные потенциалы переносчиков. Окислительно-восстановительный потенциал (Е) характеризует способность молекулы принимать электроны. Чем выше Е компонента цепи, тем выше его сила как окислителя. Переносчики в дыхательной цепи расположены в порядке увеличения Е, так как возможна отдача электронов только соединению с более высоким окислительно-восстановительным потенциалом. У кислорода наивысшая способность принимать электроны (Е = +0,82В), у водорода – наименьшая (Е = -0,42В). Таким образом, кислород, являясь наиболее сильным окислителем, создаёт движущую силу для переноса электронов по дыхательной цепи.
3\ Макроэргическими называются органические соединения живых клеток, содержащие богатые энергией связи. При гидролизе макроэргических связей (обозначаются извилистой линией ~) высвобождается более 4 ккал/моль (20 кДж/моль). Макроэргические связи образуются в результате перераспределения энергии химических связей в процессе обмена веществ. Большинство макроэргических соединений являются ангидридами фосфорной кислоты, например, АТФ, ГТФ, УТФ и т.д. Аденозинтрифосфат (АТФ) занимает центральное место среди веществ с макроэргическими связями.
аденин – рибоза – Р ~ Р ~ Р, где Р – остаток фосфорной кислоты
АТФ находится в каждой клетке в цитоплазме, митохондриях и ядрах. Реакции биологического окисления сопровождаются переносом фосфатной группы на АДФ с образованием АТФ (этот процесс называется фосфорилированием). Таким образом, энергия запасается в форме молекул АТФ и при необходимости используется для выполнения различных видов работы (механической, электрической, осмотической) и для осуществления процессов синтеза.
Все известные Макроэргимческие соединемния содержат фосфорильную (--РО3Н2) или ацильную группы и могут быть описаны формулой Х--Y, где Х -- атом азота, кислорода, серы или углерода, а Y -- атом фосфора или углерода. Реакционная способность Макроэргимческих соединемний связана с повышенным сродством к электрону атома Y, что обусловливает высокую свободную энергию гидролиза Макроэргимческих соединемний, составляющую 6--14 ккал/моль.
Важной группой соединений, в которую входят Макроэргимческие соединемния, являются аденозинфосфорные, или адениловые, кислоты -- нуклеозиды, содержащие аденин, рибозу и остатки фосфорной кислоты (см. рис.).
Наиболее значительное из них -- аденозинтрифосфорная кислота (аденозинтрифосфат, АТФ).
АТФ представляет собой аденозинфосфорную кислоту, содержащую 3 остатка фосфорной кислоты (или фосфатных остатка), служит универсальным переносчиком и основным аккумулятором химической энергии в живых клетках, кофермент многих ферментов. АТФ не единственное биологически активное соединение, содержащее пирофосфатные связи. Некоторые фосфорилированные соединения по количеству энергии, заключенной в таких связях, не отличаются от АТФ. Однако дифосфаты таких соединений не могут заменить аденозиндифосфорную кислоту в тех процессах, которые ведут к синтезу АТФ, а их трифосфаты не могут заменить АТФ в последующих процессах энергетического обмена, в которых АТФ используется как донор энергии, необходимой для протекания биосинтетических реакций. Возможно, что такая высокая степень специфичности отражает не столько уникальность АТФ, сколько уникальные особенности биохимических процессов, приспособленных исключительно к АТФ.В организме АТФ синтезируется путём фосфорилирования АДФ:АДФ + H3PO4 + энергия → АТФ + H2O.
Фосфорилирование АДФ возможно тремя способами:
субстратное фосфорилирование,
окислительное фосфорилирование,
фотофосфорилирование в процессе фотосинтеза у растений.
В первых двух способах используется энергия окисляющихся веществ. Основная масса АТФ образуется на мембранах митохондрий в ходе окислительного фосфорилирования H-зависимой АТФ-синтазой. Субстратное фосфорилирование АТФ не требует участия мембранных ферментов, оно происходит в цитоплазме в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
-
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
-
Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
-
АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
-
Также известна роль АТФ в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала).
Энергетическая функция ЦТК. На уровне сукцинил-КоА происходит субстратное фосфорилирование с образованием 1 молекулы макроэрга. Помимо этого, 4 дегидрогеназные реакции в цикле Кребса создают мощный поток электронов, богатых энергией. Эти электроны поступают в дыхательную цепь внутренней мембраны митохондрий. Конечным акцептором электронов является кислород. При последовательном переносе электронов на кислород выделяется энергия, достаточная для образования 9 молекул АТФ путем окислительного фосфорилирования.Примечание: более понятной эта цифра станет после того, как мы познакомимся с работой дыхательной цепи и с ферментом, синтезирующим АТФ.
4\ Макроэргическими называются органические соединения живых клеток, содержащие богатые энергией связи. При гидролизе макроэргических связей (обозначаются извилистой линией ~) высвобождается более 4 ккал/моль (20 кДж/моль). Макроэргические связи образуются в результате перераспределения энергии химических связей в процессе обмена веществ. Большинство макроэргических соединений являются ангидридами фосфорной кислоты, например, АТФ, ГТФ, УТФ и т.д. Аденозинтрифосфат (АТФ) занимает центральное место среди веществ с макроэргическими связями.
аденин – рибоза – Р ~ Р ~ Р, где Р – остаток фосфорной кислоты
АТФ находится в каждой клетке в цитоплазме, митохондриях и ядрах. Реакции биологического окисления сопровождаются переносом фосфатной группы на АДФ с образованием АТФ (этот процесс называется фосфорилированием). Таким образом, энергия запасается в форме молекул АТФ и при необходимости используется для выполнения различных видов работы (механической, электрической, осмотической) и для осуществления процессов синтеза.
Все известные Макроэргимческие соединемния содержат фосфорильную (--РО3Н2) или ацильную группы и могут быть описаны формулой Х--Y, где Х -- атом азота, кислорода, серы или углерода, а Y -- атом фосфора или углерода. Реакционная способность Макроэргимческих соединемний связана с повышенным сродством к электрону атома Y, что обусловливает высокую свободную энергию гидролиза Макроэргимческих соединемний, составляющую 6--14 ккал/моль.
Важной группой соединений, в которую входят Макроэргимческие соединемния, являются аденозинфосфорные, или адениловые, кислоты -- нуклеозиды, содержащие аденин, рибозу и остатки фосфорной кислоты (см. рис.).
Наиболее значительное из них -- аденозинтрифосфорная кислота (аденозинтрифосфат, АТФ).
АТФ представляет собой аденозинфосфорную кислоту, содержащую 3 остатка фосфорной кислоты (или фосфатных остатка), служит универсальным переносчиком и основным аккумулятором химической энергии в живых клетках, кофермент многих ферментов. АТФ не единственное биологически активное соединение, содержащее пирофосфатные связи. Некоторые фосфорилированные соединения по количеству энергии, заключенной в таких связях, не отличаются от АТФ. Однако дифосфаты таких соединений не могут заменить аденозиндифосфорную кислоту в тех процессах, которые ведут к синтезу АТФ, а их трифосфаты не могут заменить АТФ в последующих процессах энергетического обмена, в которых АТФ используется как донор энергии, необходимой для протекания биосинтетических реакций. Возможно, что такая высокая степень специфичности отражает не столько уникальность АТФ, сколько уникальные особенности биохимических процессов, приспособленных исключительно к АТФ.
В организме АТФ синтезируется путём фосфорилирования АДФ:АДФ + H3PO4 + энергия → АТФ + H2O.
Фосфорилирование АДФ возможно тремя способами:
субстратное фосфорилирование,
окислительное фосфорилирование,
фотофосфорилирование в процессе фотосинтеза у растений.
В первых двух способах используется энергия окисляющихся веществ. Основная масса АТФ образуется на мембранах митохондрий в ходе окислительного фосфорилирования H-зависимой АТФ-синтазой. Субстратное фосфорилирование АТФ не требует участия мембранных ферментов, оно происходит в цитоплазме в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
-
Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
-
Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
-
АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
-
Также известна роль АТФ в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала).
5\ Катаболизм — процесс расщепления сложных молекул до более простых, идущий с выделением энергии.
Анаболизм — процесс синтеза сложных веществ из более простых, идущий с затратой энергии в виде АТФ.
Амфиболические пути – двойственные, связывают катаболические и анаболические пути.
Катаболизм и анаболизм протекают в клетках одновременно, но часто локализуются в разных участках клетки. При катаболизме пищевых веществ извлекаемая из них энергия запасается в форме энергии фосфатных связей (АТФ). Энергия, необходимая для анаболизма, высвобождается при дефосфорилировании АТФ. Таким образом, АТФ выполняет функцию переносчика химической энергии. Химическая энергия может передаваться от катаболических путей к анаболическим также и при участии коферментов (главным образом, НАДФН).
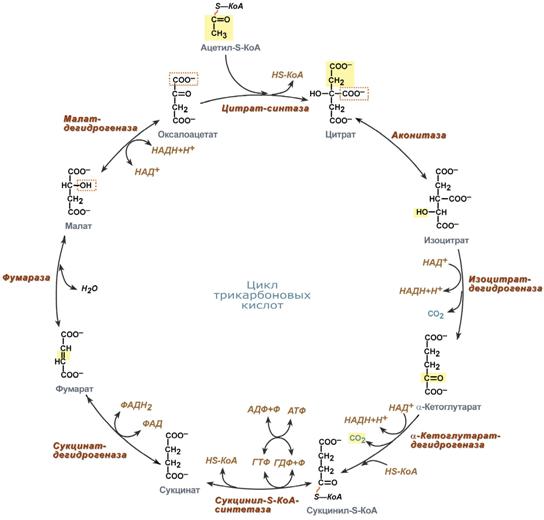
Функции цикла Кребса
-
Водороддонорная функция. Цикл Кребса поставляет субстраты для дыхательной цепи (НАД-зависимые субстраты: изоцитрат,-кетоглутарат, малат; ФАД-зависимый субстрат – сукцинат).
-
Катаболическая функция.В ходе ЦТК окисляются до конечных продуктов обмена ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты).
-
Анаболическая функция. Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глу и асп; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема).
-
Анаплеротическая функция.Цикл не прерывается благодаря реакциям анаплероза (пополнения) фонда его субстратов. Важнейшей анаплеротической реакцией является образование ЩУК (молекулы, запускающей цикл) путем карбоксилирования ПВК.
-
Энергетическая функция. На уровне сукцинил-КоА происходит субстратное фосфорилирование с образованием 1 молекулы макроэрга. Помимо этого, 4 дегидрогеназные реакции в цикле Кребса создают мощный поток электронов, богатых энергией. Эти электроны поступают в дыхательную цепь внутренней мембраны митохондрий. Конечным акцептором электронов является кислород. При последовательном переносе электронов на кислород выделяется энергия, достаточная для образования 9 молекул АТФ путем окислительного фосфорилирования.Примечание: более понятной эта цифра станет после того, как мы познакомимся с работой дыхательной цепи и с ферментом, синтезирующим АТФ.
Регуляция цтк
Первый фермент цитратсинтаза ингибируется АТФ, жирными кислотами. Лимитирующим ферментом (катализирует самую медленную реакцию) являетсяизоцитратДГ.Он активируется АДФ, НАД+, ингибируется АТФ, восстановленной формой НАДН·Н+. Когда в клетке достаточно АТФ (покой), скорость цикла снижается, при распаде же АТФ образуется АДФ, который активирует самую медленную реакцию и, следовательно, скорость всего цикла в целом.
Познакомившись с центральными путями метаболизма, основное назначение которых — отделение от субстратов атомов водорода, проследим за судьбой этих атомов, за тем, как происходит их окисление кислородом до воды.
6\ 1) Субстратное фосфорилирование –синтез АТФ из АДФ и фосфорной кислоты с использованием энергии высокоэнергетического субстрата. Этот способ синтеза АТФ не требует присутствия кислорода, т.е. происходит в анаэробных условиях. Реакции субстратного фосфорилирования происходят: 1) в процессе гликолиза (макроэргические субстраты - 3-фосфо-глицерат и фосфоенолпируват); 2) с использованием креатинфосфата; 3) в одной реакции ЦТК, с использованием макроэргического субстрата – сукцинил-КоА.
2) Окислительное фосфорилирование– синтез АТФ из АДФ и фосфорной кислоты с использованием энергии окисления водорода в дыхательной цепи. Этот способ синтеза АТФ требует присутствия кислорода, т.е. происходит в аэробных условиях. Дыхательная цепь локализуется во внутренней мембране митохондрий.
АТФ образуется путём присоединения к АДФ остатка фосфорной кислоты. Этот процесс называется фосфорилированием. Таким образом, два процесса: процесс биологического окисления (передача протонов и электронов по дыхательной цепи) и процесс фосфорилирования (образование АТФ) являются сопряжёнными, так как энергия, образующаяся при окислении, используется для фосфорилирования. Поэтому образование АТФ за счёт энергии, выделяющейся при прохождении электронов по дыхательной цепи, называетсяокислительным фосфорилированием.
Для количественной характеристики сопряжения окисления и фосфорилирования используется коэффициент фосфорилирования– отношениеР/О. Этот коэффициент показывает, какое количество атомов неорганического фосфора поглощается митохондрией при поглощении одного атома кислорода (или при переносе одной пары электронов на кислород).
Расчёты показывают, что для образования одной макроэргической связи АТФ, затраты на которую составляют не менее 40 кДж/моль, требуется перепад окислительно-восстановительных потенциалов между участниками дыхательной цепи примерно в 0,22 В на пару перенесённых электронов. В дыхательной цепи имеются только три участка с разницей о/в потенциалов, достаточной для синтеза АТФ (три участка сопряжения окисления и фосфорилирования):
I – между НАД∙Н2и ФМН;
II – между цитохромами bи c;
III – между цитохромами a и a3.
На данных этапах выделение энергии достаточно для синтеза АТФ. На остальных этапах перепад о/в потенциалов недостаточен для синтеза АТФ и выделяющаяся энергия (около 40-50%) рассеивается в виде тепла. Таким образом, при прохождении двух электронов по дыхательной цепи, которая начинается НАД-зависимыми дегидрогеназами образуется три молекулы АТФ. В этом случае коэффициент Р/О = 3.
Некоторые субстраты окисления (сукцинат, жирные кислоты) имеют более высокий окислительно-восстановительный потенциал, чем НАД. Поэтому они окисляются не НАД-, а ФАД-зависимыми дегидрогеназами. При окислении таких веществ образуется только две молекулы АТФ, так как пропускается один пункт сопряжения окисления и фосфорилирования. Поэтому коэффициент Р/О = 2.
Приведённые значения коэффициентов фосфорилирования являются расчетными, реальное значение этого коэффициента в физиологических условиях составляет Р/О ≈ 2,5.
Коэффициент Р/О может иметь ещё более низкие значения (Р/О < 2,5), так как в митохондриях иногда происходит разобщение окисления и фосфорилирования. При этом окислительно-восстановительные процессы в дыхательной цепи протекают, но фосфорилирование (синтез АТФ) не происходит, т.е. дыхательная цепь работает как бы на холостом ходу. Вся энергия окисляемых веществ превращается в теплоту. Митохондрии становятся своеобразной клеточной «печкой», производящей теплоту. Это необходимо в тех ситуациях, когда потребность в теплоте для организма больше, чем потребность в АТФ, например, для поддержания температуры тела при охлаждении.
Английский биохимик П. Митчелл предположил, что синтез АТФVкомплексом ВММ сопряжен с особым состоянием этой мембраны, и сформулировалхемиоосмотическую теориюокислительного фосфорилирования (Нобелевская премия 1978 г.).
Основные постулаты этой теории:
-
внутренняя митохондриальная мембрана (ВММ) непроницаема для ионов, в частности для Н+и ОН-;
-
за счет энергии транспорта электронов через I,IIIиIVкомплексы дыхательной цепи из матрикса выкачиваются протоны;
-
возникающий на мембране электрохимический потенциал (ЭХП)и есть промежуточная форма запасания энергии;
-
возвращение (транслокация) протонов в матрикс митохондрии через протонный канал Vкомплекса за счет ЭХП является движущей силой синтеза АТФ.
7\ 1) Субстратное фосфорилирование –синтез АТФ из АДФ и фосфорной кислоты с использованием энергии высокоэнергетического субстрата. Этот способ синтеза АТФ не требует присутствия кислорода, т.е. происходит в анаэробных условиях. Реакции субстратного фосфорилирования происходят: 1) в процессе гликолиза (макроэргические субстраты - 3-фосфо-глицерат и фосфоенолпируват); 2) с использованием креатинфосфата; 3) в одной реакции ЦТК, с использованием макроэргического субстрата – сукцинил-КоА.
2) Окислительное фосфорилирование– синтез АТФ из АДФ и фосфорной кислоты с использованием энергии окисления водорода в дыхательной цепи. Этот способ синтеза АТФ требует присутствия кислорода, т.е. происходит в аэробных условиях. Дыхательная цепь локализуется во внутренней мембране митохондрий.
Окислительное фосфолирование - образование АТФ из аденозиндифосфорной и фосфорной к-т за счет энергии, освоб-ся при ок-ии орг. в-в в живых кл. Каждая ок. р-ция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соотв-но своим ок-восст. потенциалам эти соединения в восстановленной форме подключаются к дыхат. цепи. Разобщение процессов дыхания и окислительного фосфорилирования происходит если протоны начинают проникать через внутреннюю мембрану митохондрий. В этом случае выравнивается градиент рН и исчезает движущая сила фосфорилирования. Хим. в-ва - разобщители называются протонофорами, они способны переносить протоны через мембрану. К таковым относятся 2,4 -динитрофенол, гормоны щитовидной железы и др. В норме скорость митохондриального транспорта электронов регул-ся содержанием АДФ. Выполнение кл. ф-ций с затратой АТФ приводит к накоплению АДФ, к-й в свою очередь активирует тканевое дыхание. Т. о., клеткам свойственно реагировать на интенс-ть клет. метаболизма и поддерживать запасы АТФ на необходимом уровне. Это свойствоназывается дыхательным контролем.
Английский биохимик П. Митчелл предположил, что синтез АТФVкомплексом ВММ сопряжен с особым состоянием этой мембраны, и сформулировалхемиоосмотическую теориюокислительного фосфорилирования (Нобелевская премия 1978 г.).
Основные постулаты этой теории:
-
внутренняя митохондриальная мембрана (ВММ) непроницаема для ионов, в частности для Н+и ОН-;
-
за счет энергии транспорта электронов через I,IIIиIVкомплексы дыхательной цепи из матрикса выкачиваются протоны;
-
возникающий на мембране электрохимический потенциал (ЭХП)и есть промежуточная форма запасания энергии;
-
возвращение (транслокация) протонов в матрикс митохондрии через протонный канал Vкомплекса за счет ЭХП является движущей силой синтеза АТФ.
