
Денисова В.Г. Мастер-класс «Химические свойства веществ в заданиях ЕГЭ»
Занятие 3. Поведение важнейших окислителей и восстановителей. Прогнозирование продуктов окислительно-восстановительных реакций.
Прогнозирование продуктов окислительно-восстановительных реакций – одно из самых сложных умений, которое базируется не только на знаниях, но и на опыте. Именно поэтому учащимся трудно предполагать продукты ОВР. Кроме того, продукты окислительно-восстановительных реакций зависят от ряда факторов: температуры, концентрации реагентов, рН среды, мольного соотношения реагирующих веществ и т.д. В одной и той же реакции может получаться смесь продуктов (например, при взаимодействии концентрированной азотной кислоты с металлами), в таком случае нужно считать правильным любой из возможных вариантов.
Задача нашего занятия – выяснить, какие окислители и восстановители используются в заданиях ЕГЭ наиболее часто, и рассмотреть их поведение.
Напомню, что вещества, содержащие элемент в высшей степени окисления, выступают окислителями, в низшей – восстановителями, а остальные могут проявлять окислительно-восстановительную двойственность.
Наиболее часто встречающиеся в ЕГЭ окислители: KMnO4, K2Cr2O7, HNO3, нитраты, H2SO4, галогены и их кислородные соединения, феррат.
Соединения марганца в овр
Перманганат-ион выступает окислителем в любой среде, от рН среды зависит продукт восстановления перманганата-иона. Кислую среду создают серная, азотная, соляная и другие сильные кислоты, раствор сернистого газа. Азотная кислота помимо создания кислой среды будет проявлять окислительные свойства, а соляная (и другие галогеноводородные кислоты, кроме HF) – восстановительные свойства. Щелочная среда создается растворами щелочей и аммиака, сульфидов щелочных металлов. Тот или иной продукт восстановления объясняется его устойчивостью в данной среде. Надо заметить, что в некоторых заданиях С1 в качестве продукта восстановления KMnO4 в щелочной среде указывается оксид марганца (IV). Это объясняется тем, что манганат (K2MnO4) в принципе неустойчивое вещество и в растворе самопроизвольно диспропорционирует на оксид марганца(IV) и перманганат.
Схема 1. Поведение перманганат-иона в ОВР
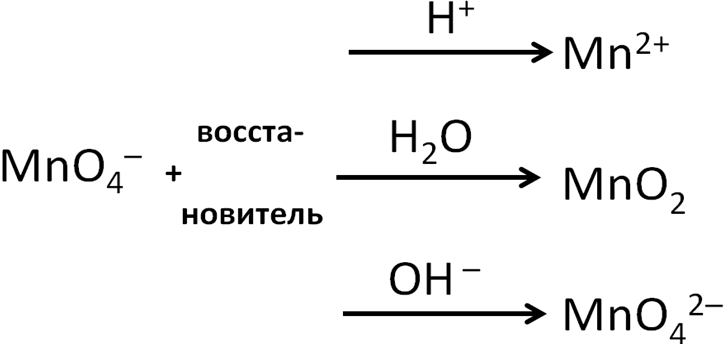
Приведем примеры, следуя выше указанной схеме:
KMnO4 + К2SO3 + H2SO4
Окислитель восстановитель создает кислую среду,
Следовательно перманганат превратится в сульфат марганца (II), сульфит окислится до сульфата, ионы калия свяжутся сульфат-ионами, ионы водорода превратятся в воду.
2KMnO4 + 5К2SO3 + 3H2SO4 = 6К2SO4+ 2MnSO4+ 3H2O
KMnO4 + К2SO3 + H2O
Окислитель восстановитель среда близка к нейтральной (слабо щелочная из-за гидролиза сульфита) , следовательно перманганат превратится в оксид марганца (IV), сульфит окислится до сульфата, ионы калия свяжутся с гидроксид-ионами.
2KMnO4 + 3К2SO3 + H2O = 3К2SO4+ 2MnO2+2KOH
KMnO4 + К2SO3 + KOH
Окислитель восстановитель создает щелочную среду,
Следовательно перманганат превратится в манганат калия, сульфит окислится до сульфата, побочный продукт - вода:
2KMnO4 +К2SO3 + 2KOH = К2SO4+ 2 K2MnO4+ H2O
2KMnO4 + 5SO2 + 2H2O = К2SO4+ 2MnSO4+ 2H2 SO4
Создает кислую среду
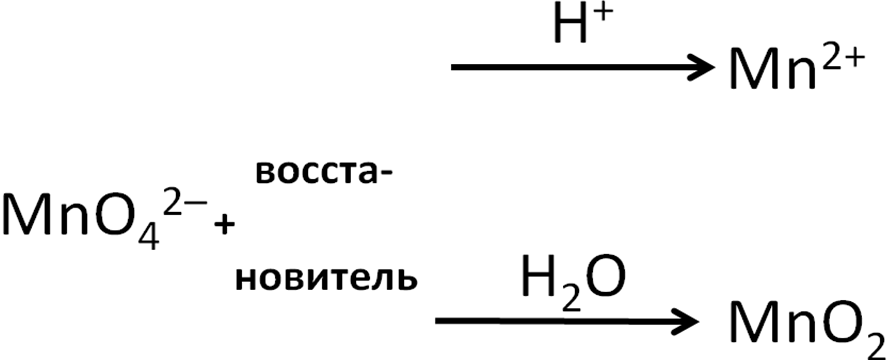
Манганат-ион также может выступать окислителем (в нейтральной и кислой среде):
Схема 2. Поведение манганат-иона в ОВР
Оксид марганца (IV) выступает окислителем в кислой среде с образованием солей манганца (II):
Нужно заметить, что соли марганца (II), оксид марганца (IV) и манганаты могут выступать восстановителями, при этом продукт их окисления также зависит от среды: в нейтральной среде получится оксид марганца (IV), в щелочной – манганат, в кислой – перманганат.
Примеры:
MnCl2 + O3 + H2O = MnO2 + O2 + 2HCl
восстановитель окислитель нейтральная среда продукт окисления
Mn(OH)2 + 2Cl2 + 6KOH = K2MnO4 + 4H2O + 4KCl
восстановитель окислитель щелочная среда продукт окисления
MnO2 + KNO3 + 2KOH = K2MnO4 + H2O + K NO2
восстановитель окислитель щелочная среда продукт окисления
2MnSO4+ 5NaBiO3 +16HNO3 = 2HMnO4 + 2Na2SO4 + 7H2O + NaNO3+5Bi (NO3)3
Восст-ель окис-ль кислая среда продукт окисления
