
- •Завдання №3
- •1. Типи розчинів. Розчинність.
- •2. Фазові рівноваги в двокомпонентних системах. Закон Рауля.
- •3. Закон Рауля для реальних розчинів.
- •4. Закони Коновалова.
- •5. Властивості розчинів твердих речовин у рідинах.
- •6. Закон розподілу. Екстракція. Осмотичний тиск.
- •7. Електроліти. Основні положення теорії Арреніуса.
- •8. Термодинамічна активність.
- •9. Нерівноважні процеси в електрохімічних системах. Закони Фарадея. Електроліз
- •10. Електропровідність розчинів електролітів
- •11. Швидкість хімічної реакції
- •12. Односторонні реакції 1 - порядку
- •13.Односторонні реакції другого порядку.
- •14.Односторонні реакції третього порядку
- •15.Методи визначення порядку реакції.
- •16.Оборотні реакції першого порядку.
- •17.Паралельні реакції
- •18.Послідовні реакції
- •19. Метод стаціонарних концентрацій
- •20. Вплив температури на швидкість хімічних реакцій.
- •21. Теорія активних зіткнень.
- •22. Теорія активованого комплексу.
- •23. Механізми дифузії атомів у твердому тілі.
- •1 Та 2 характерно для самодифузії.
- •24. Закони Фіка. Початкові і граничні умови в задачах дифузії.
22. Теорія активованого комплексу.
Для будь-якої елементарної реакції вважається, що початкова конфігурація атомів переходить в кінцеву в результаті неперервної зміни між’ядерних відстаней.
При неперервній зміні міжядених відстаней завжди утворюється проміжна конфігурація А…В…С, в якій зв'язок В-С вже ослаблений, а А-В почав формуватися. Така конфігурація є критичною, продукти реакції можуть зявитися лише за умови утвор перехідного стану (активований комплекс).
З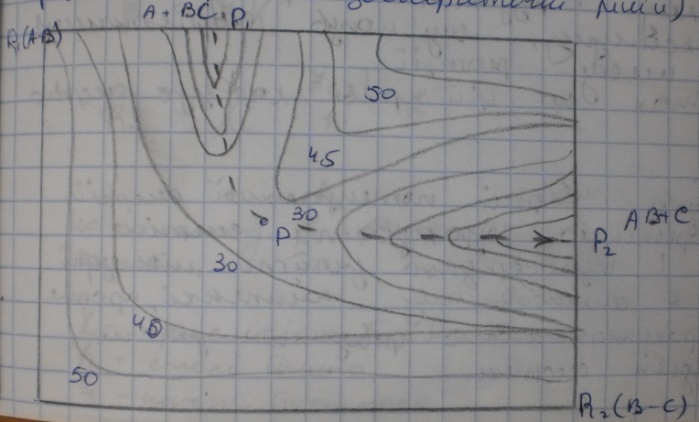 а
допомогою квантово-механічних методів
можна розрахувати потенціальну енергію
системи як Е=f(R1;R2).
Для наочності зображують карту поверхні
на плоскому кресленні
а
допомогою квантово-механічних методів
можна розрахувати потенціальну енергію
системи як Е=f(R1;R2).
Для наочності зображують карту поверхні
на плоскому кресленні
Цифри поблизу ліній означають енергію в умовних одиницях. Можна виділити «долину» Р1 в якій система (А+ВС) знаходиться до реакції, і «долину» Р2 з системою (АВ+С) що утворилася в результаті реакції. Шлях реакції проходить по «дну» від Р1 до «перевалу» Р і потім спускається по «долині» Р2. Найбільш енергетично вигідний шлях шлях переходу від вихідної до кінцевої систем по пунктирній лінії, що з’єднує точки мін потенціальної енергії, наз координатою реакції.
Найвища точка Р відповідає активованому комплексу. Шлях реакції розгортають у пряму лінію і відкладають ділянки цього шляху по осі абсцис, а на осі ординат наносять значення енергії, які відповідають точкам шляху. В результаті отримують криву змаксимуму, яку назив енергетичним профілем шляху реакції.
Побудова поверхні дозволяє теоретично розрахувати енергію активації і знайти міжядерні відстані.
Основний постулат теорії активованого комплексу: вихідні речовини завжди знаходяться в рівновазі з активованим комплексом.
Константа
рівноваги реакції утвор актив комплексу:

Швидкість
утвор продуктів реакції:

 -трансмісійний
коефіцієнт
-трансмісійний
коефіцієнт
 - стала
Планка
- стала
Планка
Рівняння Ейрінга
23. Механізми дифузії атомів у твердому тілі.
1 )
Обмінний
механізм: реалізується при взаємному
обміні 2-х атомів розташованих у сусідніх
вузлах градки (а);
)
Обмінний
механізм: реалізується при взаємному
обміні 2-х атомів розташованих у сусідніх
вузлах градки (а);
2) Кільцевий механізм: реалізується при узгодженому обміні місцями групи атомів розташованих по кільцю (б);
3)Вакаційний механізм: здійснюється при русі атомів по вакансіях (в); рух атома по вакансіях супроводжується зустрічним рухом вакансій як власного дефекту гратки.
4)Між вузловинний механізм: здійснюється шляхом руху атомів по між вузловинам (г); міжвузловин ний механізм призводить до більших швидкостей дифузії ніж (3);
5)Комбінований механізм: А) дисоціативний( атоми домішки залишають вузли гратки і переміщюються по міжвузловинам; Б) естафетний( міжвузловинний атом домішки витісняє з сусіднього вузла власний атом гратки, який у свою чергу заміщує сусідній домішковий атом у найблищому його в міжвузловину);
1 Та 2 характерно для самодифузії.
24. Закони Фіка. Початкові і граничні умови в задачах дифузії.
І закон Фіка
D — коефіцієнт дифузії (знак «-» вказує на напрямок потоку від більших концентрацій до менших).
ІІ закон Фіка описує зміну частинок у часі і просторі за допомогою дифузійного рівняння.

t — час
