
- •Завдання №3
- •1. Типи розчинів. Розчинність.
- •2. Фазові рівноваги в двокомпонентних системах. Закон Рауля.
- •3. Закон Рауля для реальних розчинів.
- •4. Закони Коновалова.
- •5. Властивості розчинів твердих речовин у рідинах.
- •6. Закон розподілу. Екстракція. Осмотичний тиск.
- •7. Електроліти. Основні положення теорії Арреніуса.
- •8. Термодинамічна активність.
- •9. Нерівноважні процеси в електрохімічних системах. Закони Фарадея. Електроліз
- •10. Електропровідність розчинів електролітів
- •11. Швидкість хімічної реакції
- •12. Односторонні реакції 1 - порядку
- •13.Односторонні реакції другого порядку.
- •14.Односторонні реакції третього порядку
- •15.Методи визначення порядку реакції.
- •16.Оборотні реакції першого порядку.
- •17.Паралельні реакції
- •18.Послідовні реакції
- •19. Метод стаціонарних концентрацій
- •20. Вплив температури на швидкість хімічних реакцій.
- •21. Теорія активних зіткнень.
- •22. Теорія активованого комплексу.
- •23. Механізми дифузії атомів у твердому тілі.
- •1 Та 2 характерно для самодифузії.
- •24. Закони Фіка. Початкові і граничні умови в задачах дифузії.
16.Оборотні реакції першого порядку.
Реакція
виду: 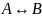
Загальна
швидкість реакції : 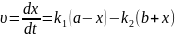
Кінетичне рівняння
Константа
рівноваги 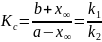
17.Паралельні реакції
У випадку паралельних реакцій одні і тіж самі речовини реагують одночасно у декількох напрямках утворюючи різні продукти.
Приклад:необоротна реакція першого порядку:
Загальна
швидкість реакції 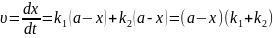
Для одержання окремих к1к2запишемо рівняння для швидкостей В і С
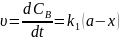
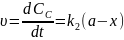
Відомо
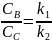
Тобто у будь-який момент реакції співвідношень будь-яких відношень реакцій є сталою величиною яка дорівнює відношенню констант швидкостей паралельних реакцій
18.Послідовні реакції
Більшість хімічних реакцій має складний механізм і вони перебігають через ряд послідовних стадій , а кінцеві продукти утворення з нестійких проміжних продуктів (молекул , атомів) у зв`язку з цим досліди цих послідовних реакцій –важлива задача хімічної кінетики .
Найбільш простим прикладом для розгляду є випадок двох послідовних необоротних реакцій першого порядку

У початковий момент часу t=0 кінцева речовина . Речовина А=а , речовини В та С відсутні . Через деякий час t концентрація речовин становитимуть :
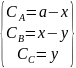
Швидкість
перетворення речовини А в В 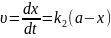
Швидкість
перетворення речовини Вв
С 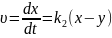
Залежність
концентрацій кінцевого продукту у
вигляді 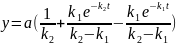
Час
досягнення максимуму 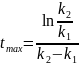
Максимальна
концентрація проміжного продукту 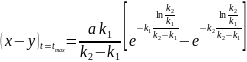
19. Метод стаціонарних концентрацій
В основі методу лежить положення про те, що через деякий невеликий час після початку реакції швидкість утворення проміжного продукту стає приблизно рівною швидкості його розпаду і сумарну швидкість зміни концентрації нестійкого проміжного продукту можна вважати приблизно рівною нулю протягом досить тривалого часу, тобто протягом цього часу встановлюється стаціонарна концентрація нестійкого продукту.
метод стаціонарних концентрацій не є абсолютно строгим, його застосування обмежується виконанням умов типу, тобто утворенням дуже нестійких проміжних продуктів, концентрація яких в ході реакції виявляється невеликий. Однак на практиці такі випадки зустрічаються дуже часто (освіта в якості проміжних продуктів атомів, вільних радикалів), тому метод стаціонарних концентрацій отримав широке поширення при вивченні кінетики та механізму різних реакцій.
20. Вплив температури на швидкість хімічних реакцій.
Правило Вант-Гоффа: з підвищенням температури на 10К швидкість реакції збільшується в 2-4 рази.
Температурний коефіцієнт шв реакції Вант-Гоффа:
Швидкість
реакції за температури:

Рівняння Арреніуса
Ea – Арреніувська або дослідна енергія активації
Ко – передекспоненційний множник, який слабко залежить від температури
Енергія активації представляє собою надлишок енергії, порівняно з середньою енергією молекул за даної температури, необхідного для того щоб реагуючі частинки могли вступити в хім. реакцію.
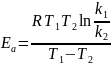
21. Теорія активних зіткнень.
Теорія активних зіткнень ґрунтується на використанні результатів, отриманих у кінетичній теорії газів. Згідно цієї теорії, число подвійних зіткнень:
µ
-
зведена маса молекул
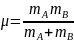
σA(B)- діаметр молекули А(В)
nA(B)- концентрація
Швидкість
реакції А+В=D+F
: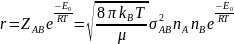
Константа
швидкості реакції другого порядку
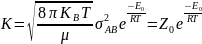
Е0
– істинна енергія активації:
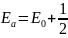 RT
RT
За допомогою теорії активних зіткнень неможливо теоретично обчислити енергію активації Еа..
Стеричний
множник – множник Р, який враховує
необхідну орієнтацію молекул реагентів
при зіткненні(
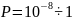 )
)
