
- •Завдання №3
- •1. Типи розчинів. Розчинність.
- •2. Фазові рівноваги в двокомпонентних системах. Закон Рауля.
- •3. Закон Рауля для реальних розчинів.
- •4. Закони Коновалова.
- •5. Властивості розчинів твердих речовин у рідинах.
- •6. Закон розподілу. Екстракція. Осмотичний тиск.
- •7. Електроліти. Основні положення теорії Арреніуса.
- •8. Термодинамічна активність.
- •9. Нерівноважні процеси в електрохімічних системах. Закони Фарадея. Електроліз
- •10. Електропровідність розчинів електролітів
- •11. Швидкість хімічної реакції
- •12. Односторонні реакції 1 - порядку
- •13.Односторонні реакції другого порядку.
- •14.Односторонні реакції третього порядку
- •15.Методи визначення порядку реакції.
- •16.Оборотні реакції першого порядку.
- •17.Паралельні реакції
- •18.Послідовні реакції
- •19. Метод стаціонарних концентрацій
- •20. Вплив температури на швидкість хімічних реакцій.
- •21. Теорія активних зіткнень.
- •22. Теорія активованого комплексу.
- •23. Механізми дифузії атомів у твердому тілі.
- •1 Та 2 характерно для самодифузії.
- •24. Закони Фіка. Початкові і граничні умови в задачах дифузії.
12. Односторонні реакції 1 - порядку
Односторонні реакції 1 - порядку Це реакції виду: А → Продукти.
Вираз для швидкості реакції має вигляд: W = K 1 C.
Вона пов'язана зі швидкістю витрачання вихідної речовини А співвідношенням:
де- стехіометричний коефіцієнт вихідної речовини А.
Рівняння для константи швидкості реакції першого порядку прийме вигляд:
Основним завданням хімічної кінетики є розрахунок швидкостей хімічних реакцій. Їх визначають з рівняння за відомою константі швидкості. До 1 знаходять експериментально. При цьому за експериментальними даними зміни концентрації вихідної речовини від часу будують графік в координатах 1пС - τ. У цій системі координат кінетичне рівняння реакції 1 го порядку представляє пряму лінію. Тангенс кута нахилу цієї лінії дорівнює
Іноді для характеристики швидкості реакції користуються часом напівперетворення або напіврозпаду τ 1 / 2.
τ 1 / 2 - це проміжок часу, протягом якого реагує
Або
З рівняння випливає, що τ 1 / 2 для реакції першого порядку не залежить від початкової концентрації вихідної речовини і визначається тільки константою швидкості.
Рівняння кінетики реакції 1 ого порядку характеризують не тільки швидкості мономолекулярних реакцій, але застосовні і до складних реакцій. Багато складних реакції протікають як реакції першого порядку
13.Односторонні реакції другого порядку.
Реакція
виду:  продукти
продукти
Швидкість
реакції : 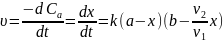
Кінетичне
рівняння 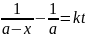
Час
напівреакції 
Константа швидкості реакції
14.Односторонні реакції третього порядку
Реакція
виду: 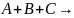 продукти
продукти
Швидкість
реакції : 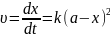 або
або
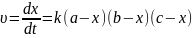
К
інетичне
рівняння 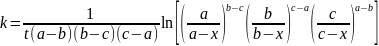
Константа швидкості реакції
15.Методи визначення порядку реакції.
а)Спосіб надлишкових концентрацій Для реакції v1 А 1 + v2A2 → Продукти
залежність швидкості від концентрації вихідних речовин записується рівнянням:
де С 1 і С 2 - концентрації вихідних речовин А 1 і А 2; п 1 і п 2 - порядки реакції по речовин А 1 і А 2; К - константа швидкості реакції. Загальний порядок реакції дорівнює: п = п 1 + п 2
Якщо реакція елементарна і формально проста і підпорядковується кінетичному рівняння для елементарних реакцій, то порядок реакції по речовин А 1 і А 2 дорівнює їх стехіометричним коефіцієнтами в рівнянні реакції, тобто п 1 = v1 і п 2 = v2 тоді п = v1 + v2 б)Спосіб надлишкових концентрацій або метод ізолювання Оствальда. Вінполягає в наступному. Спочаткупроводятьреакцію, коли концентраціявихідноїречовиниА2надлишкова в порівнянні з речовиноюА 1. При протіканніреакціївважають, щозмінюєтьсялишеконцентраціяречовиниА1 (зазвичай вона в 10 ... 1000 разівменша за концентраціюіншихречовин), а концентраціяречовиниА 2 практично постійна і їїможна ввести в постійнийкоефіцієнт. При цьомурівняння (23) набудевигляду:
де -Константа швидкостіреакції по речовиніА 1
в)Диференціальний метод (методВант-Гоффа) При розрахунках цим способом використовують досвідчені дані залежності швидкості реакції від часу
Здослідів, як правило, отримуютьзалежністьконцентраціїданого компонента від часу (кінетичнукриву) C i = f (τ i). Тому для визначенняшвидкостіреакціїбудуютьграфікв координатах
У даномувипадкуможнавикористовувати так званий спосіблогарифмування
г)Спосібпідстановки Проінтегруєморівняння (29) в межах від 0 до τ і від С 0 до С при п = 1, 2, 3, при цьому одержимо:
д)Графічнийспосіб Перепишеморівняння (30 )...( 32) увиді:
