- •Завдання №3
- •1. Типи розчинів. Розчинність.
- •2. Фазові рівноваги в двокомпонентних системах. Закон Рауля.
- •3. Закон Рауля для реальних розчинів.
- •4. Закони Коновалова.
- •5. Властивості розчинів твердих речовин у рідинах.
- •6. Закон розподілу. Екстракція. Осмотичний тиск.
- •7. Електроліти. Основні положення теорії Арреніуса.
- •8. Термодинамічна активність.
- •9. Нерівноважні процеси в електрохімічних системах. Закони Фарадея. Електроліз
- •10. Електропровідність розчинів електролітів
- •11. Швидкість хімічної реакції
- •12. Односторонні реакції 1 - порядку
- •13.Односторонні реакції другого порядку.
- •14.Односторонні реакції третього порядку
- •15.Методи визначення порядку реакції.
- •16.Оборотні реакції першого порядку.
- •17.Паралельні реакції
- •18.Послідовні реакції
- •19. Метод стаціонарних концентрацій
- •20. Вплив температури на швидкість хімічних реакцій.
- •21. Теорія активних зіткнень.
- •22. Теорія активованого комплексу.
- •23. Механізми дифузії атомів у твердому тілі.
- •1 Та 2 характерно для самодифузії.
- •24. Закони Фіка. Початкові і граничні умови в задачах дифузії.
1.Істинні розчини – гомогенна однофазна система, що складається з 2-х й більше кількості компонентів. |
2. Молярність – кількість речовини розчиненого в 1000мл розчинника. |
3. Розбавлення – кількість молів розчинника, що припадає на 1 моль розчиненої речовини. |
4. Розчинність – максимальна кількість грамів(молів), яка може бути розчинена у 100г розчинника при певній Т. |
5. Закон Генрі – При постійній температурі розчинність газів у рідинах лінійно зростає із збільшенням тиску. |
6. Константа Генрі –К, чисельно дорівнює молярній частці розчину газу на одиницю тиску. |
7. Парціальний тиск компоненти – тиск який мав би компонент, що входить до складу суміші за умови якою б компонент займав увесь V. |
8. Закон Рауля – Парціальний тиск пари данного компонента пропорційний його молярній частці у суміші. |
9. Висновок з з-ну Рауля – При постійній Т відносне зниження тисків пари чистого розчинника над розчином дорівнює молярній частці розчиненої речовини. |
10. Крива рідини - це крива на термодинамічної діаграмі, що відокремлює область рідини від області співіснування рідкої та пароподібної фаз |
11. Крива пари -Це крива на термодинамічної діаграмі, що відокремлює область пара від області співіснування рідкої та пароподібної фаз. |
12. І з-н Коновалова – насичена пара порівняно з рівноважним розчином збагачена тим компонентом, додавання якого до розчину підвищує тиск насиченої пари над розчином або знижує Т кип. |
13. Правило важеля - якщо одна фаза при зміні параметрів системи розкладається на дві інші фази, то кількісне співвідношення утворюючих вічних співвідношень фаз буде обернено пропорційним довжинам правила важеля відрізків від вихідної фази до утворюючих фаз. |
14. ІІ з-н Коновалова – у точках максимуму та мінімуму на кривих загального тиску і Ткипсклад пари і рівноважного з нею розчину однаковий. |
15. Азеотропні речовини - речовини які кипять при сталій температурі і не змінює складу при перегонці. |
16. Температура кипіння – це така Т за якої тиск насиченої пари над розчином дорівнює атмосферному. |
17. Ебуліоскапічна стала – фіз.. вел. Яка чисельно дорівнює збільшеній Ткип розчину, що містить один моль розчиненної речовини на 1000 мл. |
18. Температура замерзання – це Т при якій тиск пари над твердим розчином дорівнює тиску пари над чистим твердим розчинником. |
19. Кріоскопічна стала – Ккр, чисельнодорівнюєзниженнютемпературизамерзання в одномоляльномурозчині з властивостямиідеального.
|
20. З-нНернста – Шилова – відношення концентрації третього компонента в обох фазах при фіксованії Т є велечиною сталою. |
21. Екстракція – процес виділення речовини з розчину, за допомогою розчинника, який незмішуеться з розчином, але розчинена речовина в екстрагенті розчиняється краще. |
22. Осмос – це явише довільного проникнення молекул розчинника через напівпроникну мембрану, як фізикохімічне явище осмос зумовлений ентропійним фактором. |
23. З-н Вант – Гоффа – Осматичний тиск розбавлених розчинів прямо пропорційний концентрації і Т. |
24. Ізотонічний розчин – розчини які мають однакові осмотичні тиски. |
25. Електроліти – це речовини, розчини та розплави яких, здатні проводити електричний струм. |
26. Термодинамічна активність - цетакафізичнатермодинамічна величина, підставивши яку в формулу для хімічногопотенціалузамістьконцентрацїїробитьїї справедливою для реального розчину. |
27. Електрохімія - галузь науки, яка вивчає властивості систем, що містять іонні провідники, та перетворення речовин на межі поділу фаз за участю заряджених часток (іонів, електронів).
|
28. Гальванічні елементи - джереложивлення, в якомувикористовуєтьсярізницяелектроднихпотенціалівдвохметалів, занурених у електроліт. |
29. Електролізери - прилади для процесу електролізу |
30. Електроліти – це речовини, розчини та розплави яких, здатні проводити електричний струм. |
31. Перший з-н Фарадея - маса m речовини, яка виділилась на електроді під час проходженняелектричного струму, прямо-пропорційназначенню q електричного заряду, пропущеного через електроліт |
32. Другий закон Фарадея - електрохімічні еквіваленти елементів прямо-пропорційні їх хімічним еквівалентам. |
33. Електропровідність– Здатність речовини проводити електричний струм. |
34. Питома електропровідність – кількісна міра електропровідності. |
35. Еквівалентна електропровідність - називають питому електропровідність, віднесену до числа моль-еквівалентів в 1 моль розчину. |
36. Гранична еквівалентна електропровідність при нескінченному розведенні – при додаванні великої кількості розчинника еквівалентна електропровідність за рахунок повної дисоціації зростає і досягає максимального значення. |
37. Швидкусть реакції – кількість молекул речовини, що реагують за одиницю часу. |
38.Осн. постулат хім. кінетики-У кожний момент часу швидкість хім. реакції пропорційна добутку концентрації реагуючих речовин , зведених у деякій степені |
39.Порядок реакціїданоїречовини - показникступеня при концентраціїцієїречовини в кінетичномурівнянніреакції. |
40.Повний порядок реакції - це сума величин стехіометричний коефіцієнтів реакції. |
41. Константа швидкості реакції являє собою швидкість реакції, коли концентрації всіх вихідних речовин рівні 1 моль/л. |
42.Якщо реакція здійснюється шляхом послідовно протікаючих стадій і одна з цих стадій вимагає значно більшого часу, ніж інші, тобто йде набагато повільніше, то така стадія називається лімітуючої. |
43.Молекулярністьреакції— число частинокреагентів, щовзаємодіють один з одним в однійелементарнійреакціїта перетворюються в продукти. |
44.Кінетично оборотніреакціїздійснюються за одних і тих же умов одночасно у двохвзаємнопротилежнихнапрямках(прямому та зворотньому). |
45.Кінетично необоро́тніреа́кції—реакції, при якихузятіречовинибез остачіперетворюються напродуктиреакції, що не реагуютьміж собою за даних умов. |
46.Середня тривалість життя – величина обернена до константи швидкості реакції 1 порядку. Тобто k-1. |
47. Час напівреакції (напівперетворення) - це проміжок часу, за який концентрація початкових компонентів зменшується вдвічі. |
48.Принцип незалежності : При перебігу в системі декількох реакцій кожна з них проходить незалежно одна від одної і підпорядковується Осн.постулату кінетики |
49. Індуктивний період реакції – початковий період реакції, коли початкова швидкість утворення кінцевих продуктів мала і його кількість також настільки мала, що аналітично не виявляється. |
50. Правило Вант-Гоффа: з підвищенням температури на 10К швидкість реакції збільшується в 2-4 рази |
51. Енергія активації – надлишок енергії (в розрахунку на 1моль), порівняно з середньою енергією молекул за даної температури |
52. Стеричний множник – множник Р, який враховує необхідну орієнтацію молекул реагентів при зіткненні |
53. Активований комплекс – проміжна конфігурація А…В…С, в якій зв'язок В-С вже ослаблений, а А-В почав формуватися. |
54. Координата реакції – найбільш енергетично вигідний шлях переходу від вихідної системи до кінцевої по лінії, що з’єднує точки мін потенціальної енергії. |
55. Шлях реакції розгортають у пряму лінію і відкладають ділянки цього шляху по осі абсцис, а на осі ординат наносять значення енергії, які відповідають точкам шляху. В результаті отримують криву змаксимуму, яку назив енергетичним профілем шляху реакції. |
56. Самодифузія – це дифондування власних дефектів гратки при їх не однорідному розподілу. |
57. Гетеродифузія- це дифондування власних дефектів гратки при їх однорідному розподілу.
|
58. Час осілого життя атому - час, протягом якого здійснюється перехід з однієї "осілої" позиції в іншу. |
59. Коефіцієнт дифузії - це стала, що зв'язує потік речовини з градієнтом концентрації у відповідності з першим рівнянням Фіка. |
|
|
|
Завдання 2 |
|
|
1. Массова частка
|
2. Закон Генрі
|
3. Закон Рауля {
|
4.Висновок із закону Рауля
|
5. Ебуліоскапічна стала
|
6. Кріоскопічна стала
|
7. Маса компонента, що екстрагуеться
|
8. Закон Вант-Гоффа
|
9. Ступінь дисоціації
|
10. Ізотонічний коефіцієнт Вант-Гоффа
|
11. Закон розведенняОстальда
|
12. ТД активність
|
13. Середня активність електроліту
|
14. Йонна сила розчину
|
15. Рівняння граничного закону Дебая – Гюкелля
|
16. Перший закон Фарадея
|
17. Другий закон Фарадея
|
18.Об`єднаний закон Фарадея
|
19. Число переносу
|
20. Електропровідність
|
21. Питома електропровідність
|
22. концентраційна залежність електропровідності електролітів
|
23. Закон незалежного руху йонів
|
24. Коефіціент електропровідності
|
25.
Рівняння Онзагера
|
26. Швидкість реакції
|
27.Середня
швидкістьреакції |
28.Швидкість реакції першого порядку
|
29.Кінетичне рівняння реакції першого порядку
|
30. Зміна концентрації реагуючоїречовини у часі для реакції прешого порядку
|
31.Період
напівреакції хім.. реакції першого
порядку |
32.Швидкість реакції другого порядку
|
33.Кінетичнерівняння реакції другого порядку
|
34.Період напівреакції хім.. реакції другого порядку
|
35.Контстанта швидкості реакції другого порядку (загальний випадок)
|
36.Контстанта швидкості реакції третього порядку (частковий випадок)
|
37.Контстанта швидкості реакції третього порядку (загальний випадок)
|
38. .Контстанта швидкості реакції n-ого порядку
|
39. Загальна швидкість оборотної реакції Іго порядку
a,b-вихідні к-ті речовин А, В x-к-ть речовини А, що прореагувала до моменту часу t |
40. Константа швидкості оборотної реакції Іго порядку
|
41. Швидкість паралельної реакції
|
42. Константа швидкості паралельної реакції
|
43. Температурній коефіцієнт швидкості реакції Вант-Гоффа
|
44. Рівняння Арреніуса
Ea – Арреніувська або дослідна енергія активації Ко – передекспоненційний множник, який слабко залежить від температури |
45. Рівняння Арреніуса в диференціальній формі
|
46. Число подвійних зіткнень частинок
µ - зведена маса молекул σA(B)- діаметр молекули А(В) nA(B)- концентрація |
47. Константа швидкості реакції ІІго порядку за теорією активних зіткнень
|
48. Рівняння Ейрінга
|
49. Час осідлого життя атому
|
50. Коефіцієнт дифузії атомів у твердому тілі
D — коефіцієнт дифузії
|
51. І закон Фіка
D — коефіцієнт дифузії (знак «-» вказує на напрямок потоку від більших концентрацій до менших). |
52. ІІ закон Фіка
t — час D — коефіцієнт дифузії |
|
|
|
Завдання №3
1. Типи розчинів. Розчинність.
У теоретичних і практичних дослідженнях користуються двома теоріями розчинів:
1) Фізична теорія розчинів – ґрунтується на вивченні різних характеристик розчинів.
2) Хімічна теорія розчинів (розроблена Мендилеевим) згідно цієї теорія при розчинені відбувається хімічна взаємодія, що супроводжується утворенням соловатів.
Процес утворення розчинів можна розглядати з позицій виконання двох умов: 1 – Термодинамічних, і 2- кінетичних.
Розчинність – максимальна кількість грамів(молів), яка може бути розчинена у 100г розчинника при певній Т. Існують декілька способів розподілу розчинів на типи:
Тверді розчини(сплави)
Рідинні
Газоподібні
Розчини також розрізняються за здатністю компонентів змішуватися:
Розчинена речовина і розчинник змішується не обмежено.
Розчинена речовина і розчинник змішується обмежено.
Розчинена речовина і розчинник не змішується.
Розчинність залежить від багатьох фактів, але експериментально встановлено певну закономірність: подібне добре розчиняється в подібному.
2. Фазові рівноваги в двокомпонентних системах. Закон Рауля.
Нехай маємо розчин що складається з двох речовин А і В які добре розчиняються один в одному. Над рідинною фазою існує газоподібна яка містить тіж самі компоненти що і рідина. Через деякий час після розчинення на поверхні встановлюється рівновага між рідиною і газоподібною фазою.
При цьому склад обох фаз неоднаковий умовою рівноваги у таких гетерогенних системах є рівність хімічних потенціалів у рідинній та газоподібних фазах.
 Або
після деяких хімічних перетворювань :
Або
після деяких хімічних перетворювань :

Закон Рауля : « Парціальний тиск пари данного компонента пропорційний його молярній частці у суміші. »
Висновок з закону Рауля: «При постійній Т відносне зниження тисків пари чистого розчинника над розчином дорівнює молярній частці розчиненої речовини.»
3. Закон Рауля для реальних розчинів.
З точки зору будови реальних систем та характеристик між молекулярної взаємодії для ідеальної моделі реального розчину:
1) Відсутність теплового ефекту реакції та будь-яких змін об’єму в процесі проходження реакції.
2) Рівність сил між молекулярної взаємодії між будь-якими молекулами що входять до складу системи

 сили
між молекулярної взаємодії між молекулами
розчинника, домішки і між молекулами
розчинника і домішки.
сили
між молекулярної взаємодії між молекулами
розчинника, домішки і між молекулами
розчинника і домішки.
4. Закони Коновалова.
Перший закон Коновалова : « Насичена пара порівняно з рівноважним розчином збагачена тим компонентом, додавання якого до розчину підвищує тиск насиченої пари над розчином або знижує Т кип.»
Другий закон Коновалова : «У точках максимуму та мінімуму на кривих загального тиску і Ткипсклад пари і рівноважного з нею розчину однаковий.»
Третій закон Коновалова : « При постійній Т або р зміна складу розчину і насиченої пари проходить в одному напрямку(симбатно).»
Закони Коновалова відіграють важливу роль при побудові діаграм фазової рівноваги, за допомогою яких можна теоретично обґрунтувати процес фракційної перегонки.







 -
ентальпія
фазового переходу
-
ентальпія
фазового переходу


































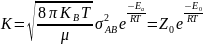



 - змінa
концентрації
- змінa
концентрації