
- •I. Мета:
- •II. Методи, прийоми, засоби:
- •Хід лекції
- •1. Основні компоненти електрон транспортного ланцюга:
- •3. Молекулярна організація дихального ланцюга мітохондрій:
- •4.Гіпотези окисного фосфорилювання:
- •II. Основна частина (70 – 75 хв.)
- •1.Основні компоненти дихального ланцюга
- •2. Молекулярна організація дихального ланцюга мітохондрій
- •Інгібітори дихального ланцюга
- •3. Хеміосмотична теорія Мітчелла (теорія окисного фосфорилювання)
- •Інгібітори та роз’єднувачі окисного фосфорилювання
- •Дихальний контроль
- •III. Заключна частина (5-10 хв.)
Інгібітори дихального ланцюга
Робота дихального ланцюга може бути інгібована під дією різноманітних клітинних отрут, які взаємодіють з білками-переносниками та порушують транспорт електронів:
Інгібітори I комплексу — барбітурати (амітил, секонал), ротенон, пієрицидин А.
Інгібітор II комплексу — малонат.
Інгібітор III комплексу — антиміцин А.
Інгібітори IV комплексу — Н2S, цианіди, СО.
Наявність у клітині вказаних інгібіторів призводить до розвитку гіпоенергетичного стану, що, в свою чергу, в деяких випадках може призвести до загибелі клітини.
3. Хеміосмотична теорія Мітчелла (теорія окисного фосфорилювання)
Пояснення механізмів спряження роботи дихального ланцюга та синтезу АТФ було запропоноване англійським біохіміком Пітером Мітчеллом у 1961 році, яке потім знайшло експериментальне підтвердження у роботах багатьох дослідни-ків. За винайдення механізмів окисного фосфорилювання П. Мітчелл у 1978 році отримав Нобелівську премії в галузі хімії («За внесок у розуміння процесу перенесення біологічної енергії, який зроблений завдяки створенню хеміосмотичної теорії»).

Рисунок 9 - Спряження роботи дихального ланцюга із синтезом АТФ (за теорією П.Мітчелла)
Існує декілька гіпотез для пояснення механізму спряження або фосфорилювання. Перш за все - це гіпотеза хімічного спряження, гіпотеза хеміосмотич-ного спряження й гіпотеза механохімічного чи конформаційного спряження. Гіпотеза хімічного спряження ґрунтується на уявленні, згідно з яким передача енергії, що виділяється в процесі переносу електронів по дихальному ланцюгу на АДФ з утворенням АТФ, здійснюється через загальні проміжні сполуки, які містять макроергічний зв'язок: тобто за типом субстратного фосфорилювання. Але до цього часу не вдалося довести реальне існування та ідентифікувати передбачувані переносники.
Наявність процесу окислювального фосфорилювання лише в тих мітохондріях, де збереглася структура мембрани, збільшила інтерес до двох інших гіпотез.
Згідно з гіпотезою механохімічного або конформаційного спряження припускалося, що енергія, вивільнена в дихальному ланцюзі, використовується безпосередньо для переведення білків внутрішньої мембрани в новий, багатий на енергію конформаційний стан, який, у свою чергу, стає рушійною силою окислювального фосфорилюван-ня, що призводить до утворення АТФ (подібно до процесів м'язового скорочення). Однак розглянуті вище теорії не могли пояснити, чому для окислювального фосфорилювання необхідна цілісність внутрішньої мембрани.
На сьогодні найсерйозніше експериментальне обґрунтування одержала теорія хеміосмотичного спряження, розроблена англійським біохіміком П. Мітчеллом. Багато для її доказу зроблено російським вченим В.П. Скулачовим.
Провідну роль у хеміосмотичній теорії відіграють замкненість і цілісність внутрішньої спряжуючої мембрани мітохондрій, при порушенні яких синтез АТФ припиняється. Було звернуто увагу на те, що окислювально-відновні ферменти й коферменти, які складають дихальний ланцюг, розміщені в певній послідовності, векторно, утворюючи поперек внутрішньої мембрани петлі й перехрести (рис. 59). Це забезпечує певну спрямованість процесів у просторі. Основним проявом векторності в дихальному ланцюзі є перекидання іонів Н+ із внутрішньої сторони мембрани (з боку матриксу) на зовнішню. Зворотній перехід Н+ є неможливим, оскільки внутрішня мембрана для них непроникна.
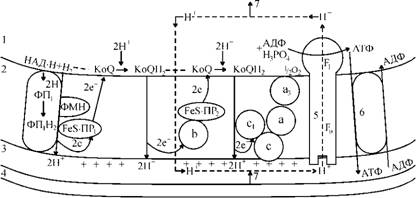
Рис. Схема утворення протонного потенціалу під час дихання (показані передбачувані ділянки перехрестів мембрани): 1 - матрикс, 2 - внутрішня мембрана мітохондрій, 3 - міжмембранний простір, 4 - зовнішня мембрана, 5 - Н+-АТФ-синтетаза, 6 - АДФ-АТФ-транслоказа, 7- схематично показаний кругообіг іонів Н+, протонний цикл (пояснення в тексті)
Більшість ферментів дихального ланцюга досить міцно закріплені в ліпідно-білковій конструкції мембрани й не мають контактів з її внутрішньою і зовнішньою сторонами. Перша ж ланка дихального ланцюга, яка зв'язана з НАД- або ФАД-дегідрогеназами, знаходиться на внутрішній поверхні мембрани й має вихід у матрикс. Сюди спрямовані їхні активні центри, до яких надходять з матриксу субстрати для дегідрування. Атоми водню від НАДН+Н+ захоплю-ються іззовні флавопротеїдом, розташованим поперек внутрішньої мембрани, при цьому електрони надходять на залізосірчаний білок, а Н+ виштовхуються назовні. Електрони передаються далі по ланцюгу. Остання ланка - цитохромоксидаза - також локалізується близько до внутрішньої поверхні мембрани, її активний центр спрямований у матрикс, куди й надходить молекулярний кисень.
Ліпідорозчинний кофермент О (убіхінон) легко дифундує із внутрішнього боку мембрани (від матриксу) до зовнішнього і, віддаючи електрони по ланцюгу, є також переносником протонів з матриксу на зовнішню поверхню мембрани, тобто в міжмембранний простір.
Вважається, що енергія електронів, яка виділяється при їх переносі по дихальному ланцюгу, перекачує протони з матриксу в між-мембранний простір, уникаючи накопичення їх усередині самої мембрани. При цьому утворюється так званий протонний потенціал (різниця концентрацій Н+ по обидва боки внутрішньої мембрани), а отже - й електрохімічний потенціал (зарядженість), який потім використовується в процесі фосфорилювання АДФ для утворення АТФ. Тому внутрішня мембрана мітохондрій не повинна бути проникною для заряджених часток і передусім для Н+ і ОН-. Якби мембрана була проникною для Н+, вони повернулися б назад - у напрямку меншої їх концентрації на лівий бік мембрани (у матрикс). Енергія при цьому виділилася б у вигляді тепла. Це підтверджувалося й тим, що при добавленні деяких речовин (так званих «роз'єднувальних агентів»), які різко підвищують проникність внутрішньої мембрани для Н+, відбувалося роз'єднання процесів тканинного дихання з фосфорилюванням і утворення АТФ припинялося. Прикладом може бути 2,4-динітрофенол:
Ця ліпофільна речовина легко дифундує через мітохондріальну мембрану як в іонізованій, так і в неіонізованій формі і, будучи джерелом Н+, може переносити останні через мембрану в бік їх меншої концентрації, що призводить до зняття протонного потенціалу. У присутності роз'єднувачів (у тому числі й природних, наприклад, гормону тироксину), а також деяких лікарських засобів (аспірин, дику-марол та ін.) вільна енергія, що виділяється при переносі електронів, переходить у тепло і не запасається у вигляді АТФ. Споживання кисню й окислення субстратів при цьому продовжується, але синтез АТФ, звичайно, є неможливим. Оскільки енергія окислення при роз'єднанні

203
тканинного дихання з фосфорилююванням розсіюється у формі тепла, то роз'єднувачі підвищують температуру тіла (пірогенна дія).
Всі вищезазначені та інші факти мали важливе значення для створення хеміосмотичної концепції спряження тканинного дихання з фосфорилюванням.
Основними постулатами теорії Мітчелла є таке
внутрішня мембрана мітохондрій непроникна для іонів та малих молекул (за винятком молекул води);
дихальний ланцюг працює як «помпа», що викачує протони з матриксу в міжмембранний простір – рух 2 електронів від субстрату на кисень призводить до перенесення 8-10 Н+ (протони транспортуються через I, III та IV комплекси) через мембрану;
робота дихального ланцюга створює електрохімічний градієнт протонів (∆μН+), оскільки вони вільно через внутрішню мітохондріальну мембрану повернутися в матрикс не можуть і будуть накопичуватись у міжмемб-ранному просторі; ∆μН+ - це проміжна форма зберігання енергії окиснення субстратів;
енергію протонного градієнта використовує Н+-АТФ- синтаза (V комплекс) для синтезу АТФ, коли через одну з її субодиниць протони повертаються в матрикс;
існують сполуки - роз’єднувачі окисного фосфорилю-вання, які порушують електрохімічний градієнт протонів і знижують ефективність роботи Н+-АТФ-синтази
На думку Мітчелла, енергія переносу електронів і протонів по дихальному ланцюгу спочатку зосереджується у вигляді протонного потенціалу або електрохімічного градієнта іонів Н+, який утворюється перекачуванням іонів Н+ через мембрану (на певних пунктах дихального ланцюга) із внутрішньої поверхні внутрішньої мембрани (з боку матриксу) на її зовнішню поверхню - у міжмембраний простір. Інакше кажучи, між водними фазами, розділеними внутрішньою мембраною, утворюється різниця концентрацій Н+ (градієнт концентрації Н+) з більш кислим значенням рН ззовні. Одночасно поверхні мембрани заряджаються: зовнішня - позитивно за рахунок збільшення Н+, а внутрішня - негативно за рахунок зменшення концентрації Н+ і надлишку ОН-, тобто утворюється градієнт електричного потенціалу. Отже, ланцюг переносу електронів працює як протонний насос, перекачуючи протони з матриксу на зовнішню сторону мембрани. Як результат, між двома сторонами мембрани виникає різниця концентрацій протонів і водночас - різниця електричних потенціалів зі знаком плюс на зовнішній поверхні.
Утворений електрохімічний потенціал примушує протони, за умови їх надлишку на зовнішній стороні мембрани, рухатися (по градієнту концентрації) у зворотному напрямку - із зовнішньої поверхні - всередину (у матрикс). Але мембрана непроникна для них, за винятком спеціальних ділянок - протонних каналів, що розміщені у ферментативному комплексі Н+-АТФ-синтетази, розташованої поперек внутрішньої мембрани, і яка має певні пункти контактів як з міжмембранним простором, так і з матриксом. Зворотна дифузія Н+ у матрикс призводить до вирівнювання різниці концентрацій Н+, і відбувається розрядження внутрішньої мембрани (зникає електричний потенціал). Одночасно в активному центрі ферменту Н+-АТФ синтетази відбувається процес окислювального фосфорилювання АДФ активним неорганічним фосфатом з утворенням АТФ, тобто енергія електрохімічного потенціалу трансформується в хімічну енергію макроергічного зв'язку АТФ. Різниця потенціалів у 0,25 В при зворотному переносі двох протонів, є цілком достатньою для утворення однієї молекули АТФ.
Так, при спряженні тканинного дихання з фосфорилюванням створюється безупинний кругообіг іонів Н+ (зарядка й розрядка внутрішньої мембрани), так званий протонний цикл (рис.). Тому хе-міосмотичну концепцію називають ще протонрушійною. Саме цей зворотний потік протонів і є рушійною силою для синтезу АТФ: протони, проходячи зворотно через спеціалізовану систему (комплекс Н+-АТФ-синтетази, який витрачає енергію електричного поля для синтезу АТФ із АДФ і активної молекули фосфату), сприяють тому, що енергія протонного потенціалу накопичується в молекулі АТФ -цьому універсальному біологічному акумуляторі енергії.
Повернення Н+ іншими шляхами, поза протонними каналами комплексу Н+-АТФ-синтетази, у тому числі й добавленням речовин, які легко проникають у мембрану й віддають свій Н+ (тобто роз'єднують окислення з фосфорилюванням), призводить до того, що енергія виділяється у вигляді тепла. Таким чином, можна припустити, що тканинне дихання заряджає мітохондріальну мембрану, а окислювальне фосфорилювання розряджає її, використовуючи енергію мембранного потенціалу для синтезу АТФ. При цьому тканинне дихання здійснює осмотичну роботу (концентруючи протони в міжме-мбранному просторі мітохондрій) і електричну (утворює різницю електричних потенціалів), яка використовується Н+-АТФ-синтета-зою для хімічної роботи, тобто синтезу АТФ. Поєднання функцій дихання й фосфорилювання дало підставу назвати гіпотезу хеміосмо-тичною або протонрушійною, оскільки рушійною силою фосфори-лювання є протонний потенціал.
На даний час хеміосмотична теорія підтверджена великою кількістю експериментів, і можна вважати, що саме вона найбільш точно відображає організуючий принцип окислювального фосфорилювання.
Російським вченим В.П. Скулачову, Ю.А. Овчіннікову та їх співробітникам вдалося безпосередньо виміряти величину електрорушійної сили, виникаючої під час освітлення бактерій, що містять ба-ктеріородопсин. Бактеріородопсин вбудовували у фосфоліпідну плівку, яка розділяла два відсіки кювети, заповненої розчином електроліту. У відісіки занурювали електроди. При освітленні бактеріородо-псину (спалах лазера) на мембрані виникала різниця потенціалів близько 0,25 В, достатня для синтезу АТФ.
Однак деякі деталі не до кінця зрозумілі. Досі залишається невідомим механізм використання електрохімічного потенціалу Н+-АТФ-синтетазою під час синтезу АТФ.
Більшість сучасних дослідників вважає, що проблему окислювального фосфорилювання можна вирішити в рамках хеміосмотичної теорії Мітчела. Вона розкриває основні принципи, дає загальний підхід до вирішення конкретних питань і механізмів енергетичного спряження. Однак вчені підкреслюють, що не варто скидати з рахунку й інші гіпотези, користь яких при розшифруванні й конкретизації механізмів енергетичного спряження теорії Мітчелла може бути безсумнівною.
Механізм утворення протонного потенціалу в дихальному ланцюзі мітохондрій
Дихальний ланцюг переносу електронів, як зазначалося вище, має три ділянки фосфорилювання, що повинно відповідати трьом протонним насосам. Як результат, у разі переносу двох електронів від НАД Н2 до кисню по дихальному ланцюгу утворюються три молекули АТФ, а в разі переносу електронів від ФАД-дегідрогенази -дві молекули АТФ.
Перший перехрест починається на ділянці від НАДН2 до КоО (убіхі-нона). Як уже зазначалося, на внутрішній поверхні внутрішньої мембрани розташована НАД-дегідрогеназа або ФАД-дегідрогеназа з активним центром, спрямованим до матриксу, звідки вони одержують відповідні субстрати. Тут здійснюється процес дегідрування субстратів з утворенням НАДН+Н+; атоми водню від нього надходять до флавопротеїнів (ФП). До складу останніх входить ФМН і залізосір-чаний білок із негеміновим залізом (БеБ-ПР^, який приймає електрони, а 2Н+ перекидаються на зовнішню сторону мембрани. Отже, тут звільняється перша пара протонів, а два електрони транспортуються через Ре8-ПР1 до КоО. КоО, приєднуючи електрони, набуває негативного заряду і одночасно захоплює протони з матриксу міто-хондрій. Це супроводжується утворенням КоОН2 і негативного заряду на внутрішній поверхні мембрани.
Другий перехрест має місце на ділянці від КоО Н2 до цитохро-му с1. Відновлений КоОН2 дифундує крізь мембрану до зовнішньої поверхні, де розташований цитохром Ь і залізосірчаний білок (Бе8-ПР2). На зовнішній поверхні окислення КоОН2 супроводжується переходом другої пари 2Н+ у середовище й поверненням двох електронів на Бе8-ПР2, а потім до другої молекули КоО. При цьому КоО, приєднуючи два електрони, набуває негативного заряду і захоплює ще 2Н+ з матриксу.
Третій перехрест починається, коли КоО Н2 знову переносить назовні третю пару протонів, а два електрони КоО Н2 через цитохроми с1 і с передаються на цитохромоксидазу (а а3), де закінчується третя, електронна петля. На цитохромоксидазі, активний центр якої звернений до матриксу, відбувається передача електронів на молекулярний кисень за рівнянням: 2е- + 1/2О2 + 2Н+ -— Н2О.
Іони Н+ для утворення гідроксильних іонів і молекул води надходять з матриксу мітохондрій.
Отже, окислення НАДН2, розпочавшись на внутрішній поверхні, закінчується після триразового перетину мембрани протонами й електронами відновленням кисню й утворенням води теж на внутрішній поверхні мембрани мітохондрій. Джерелом шести протонів є: два Н+ від субстратів окислення (що знаходяться у складі НАД Н2) і чотири Н+ із середовища матриксу. Джерелами електронів, які використовуються для відновлення кисню, є тільки НАДН2 або, у випадку ФАД-де-гідрогенази, - ФАД • Н2, які утворюються при дегідруванні субстратів.
Механізм фосфорилювання. Згідно з хеміосмотичною концепцією протони, виведені назовні за рахунок енергії переносу електронів, у разі їх надлишку на зовнішній стороні внутрішньої мембрани знову прямують у мітохондріальний матрикс. Проте внутрішня мембрана непроникна для них, за винятком спеціальної ділянки - протонних каналів. У зоні цих каналів знаходиться Н+-АТФ-синтетаза, яка є протонним насосом, що забезпечує перехід Н+ із зони з більш високою (зовнішня сторона внутрішньої мембрани) у зону з більш низькою концентрацією (у матрикс), що супроводжується виділенням вільної енергії, за рахунок якої й синтезується АТФ. На даний час остаточно встановлено, що комплекс Н+-АТФ-синтетази, вбудований у мембрану, являє собою найпростішу систему, здатну здійснювати взаємоперетворення енергії АТФ і АцН+. Як уже зазначалося, внутрішня мембрана пронизана виростами грибоподібної форми, які й являють собою АТФ-синтетазний комплекс, який складається із двох структурних частин. «Ніжка гриба» (фактор Б0) у вигляді білкового циліндра пронизує всю товщу внутрішньої мембрани (рис. 59 і рис. 60), один кінець якого сполучається із зовнішнім середовищем, а другий виходить у матрикс у вигляді головки з активним центром і позначається як фактор БР Отже, Н+-АТФ-синтетазу можна позначити як Р0 + Будова, властивості й функція цих двох частин ферменту зовсім різні. Загальна маса Б0 + Б! приблизно дорівнює 500000 дальтон, із них на Б! припадає близько 340000, а на Б0 - решта маси. Б0 - дуже гідрофобний білок, який складається з чотирьох поліпеп-тидних ланцюгів. Б! складається з десяти субодиниць - поліпептид-них ланцюгів п'яти різних типів (а, р, у, 5, є). Б0 виконує функцію каналу в мембрані, через який проходять протони, а Б! - фосфорилю-ючу функцію під час синтезу АТФ. Цей спряжуючий фактор може викликати за певних умов і гідроліз АТФ, оскільки може знаходитись у двох взаємоперетворюваних станах, рівновага між якими контролюється співвідношенням кількостей АТФ і АДФ у мітохондріях.
Послідовність молекулярних перетворень на заключному етапі процесу фосфорилювання точно не з'ясована. Запропоновано два гіпотетичні механізми. В основі моделі П. Мітчелла лежить припущення про безпосередню участь іонів водню у фосфорилюванні АДФ в активному центрі ферменту. Іони водню, використовуючи енергію електрохімічного потенціалу, проходять протонний канал комплексу Б0, потрапляючи в активний центр Б!-компоненту, де реагують з атомом кисню неорганічного фосфату. Як результат утворюється реакційноз-датне фосфатне похідне, яке безпосередньо взаємодіє з АДФ, фосфо-рилюючи його. В інших випадках провідна роль належить змінам просторової структури Б!-АТФ-синтетази. Вважають, що енергія протонного потенціалу витрачається на індукцію конформаційних перебудов у білкових ланцюгах Бгкомплексу, що призводить до формування каталітичних центрів у молекулі ферменту для зв'язування АДФ і фосфату, а отже, й до синтезу АТФ.
Клітина використовує АТФ, синтезований у мітохондріях, як хімічне паливо при різних енерговитратах. Тому мітохондріальний АТФ необхідно доставити в ту частину клітини, де він необхідний.
Також необхідним є надходження субстрату фосфорилювання АДФ і донора фосфатної групи в мітохондрії. Вільна дифузія цих метаболітів через внутрішню мембрану мітохондрій неможлива завдяки її непроникності для гідрофільних молекул, таких як АТФ4-, АДФ3-, -Р043-. Ця проблема вирішується завдяки існуванню в ліпідному бі-шарі двох спеціалізованих білкових транспортних систем: транслока-зи фосфату, яка доставляє його в матрикс, і транслокази аденілових нуклеотидів (АДФ-АТФ-транслокази), яка переносить АДФ3- в міто-хондрії, а АТФ4- - у цитоплазму (рис.).
Система АДФ-АТФ-транслоказ високоспецифічна. Вона не здатна переносити інші нуклеотиди. Прояв її біологічної активності пов'язаний з конформаційними переходами комплексу. В одній конформації зв'язуюча ділянка доступна з боку цитоплазми і взаємодіє з АДФ, в іншій -зв'язує АТФ на протилежному боці. Якщо на поверхні внутрішньої мембрани потенціал відсутній, транслоказа переносить обидва нуклеотиди з рівною ефективністю в обох напрямках. Наявність позитивного мембранного потенціалу на зовнішньому боці бішару робить неможливим перенесення АТФ4- всередину, а АДФ3- - назовні. Таким чином, мембранний потенціал визначає фізіологічно необхідний напрямок руху -захват АДФ із цитоплазми і викид у це ж середовище АТФ.
Важливим моментом є оборотність реакції, яка каталізується АТФ-синтетазним комплексом. За відповідних умов комплекс Б^Бо може розщеплювати молекулу АТФ і використовувати отриману при цьому енергію для викачування протонів, тобто для утворення на мембрані електрохімічного потенціалу іонів водню. Отже, каталізуючи зворотну реакцію розпаду АТФ, Н+-АТФ-синтетаза працює як Н+-АТФаза (протонна аденозинтрифосфатаза), відкачуючи протони із внутрішнього простору назовні за рахунок енергії гідролізу АТФ. Протонні АТФази, які були виділені з мітохондрій тварин, вищих рослин і грибів, хлоропластів і деяких бактеріальних клітин, мають однаковий тип будови і, ймовірно, один і той же механізм функціонування.
На рис. наведена структура протонної АТФ-синтази (Н+-АТФ-синтази, Н+-АТФ-аза), яка безпосередньо використовує енергію протонного градієнта, що був створений дихальним ланцюгом, для синтезу АТФ.

Рисунок 10 - Структура Н+-АТФ-синтази
Протонна АТФ-синтаза – це олігомерний білок, який вмонтований у внутрішню мембрану мітохондрії і за будовою нагадує гриб .Вона містить дві субодиниці:
Fo – протонний канал (о - від «олігоміцин»); лише через цей канал протони можуть повернутися в матрикс;
F1 – фермент, який використовує енергію, що вивільняється при транспорті протонів через Fo для синтезу АТФ з АДФ та Фн.
П.Мітчелл у своїй теорії теоретично віддав функцію спряження окиснення та фосфорилювання саме Н+-АТФ-азі. Експериментальне піддтердження цей факт знайшов у працях Джона Уокера та Пола Бойера, які за «З’ясування ензимного механізму, що лежить в основі синтезу аденозин-фосфату» в 1997 році отримали Нобелівську премію з хімії.
На сьогодні відомо, що при транспорті протонів через Fo-субодиницю відбуваються конфірмаційні зміни в активному центрі F1-субодиниці, які призводять до її активації і відповідно до синтезу АТФ та її вивільнення. Молекули АТФ, що синтезуються, транспортуються у цитозоль за допомогою транслокази.
Для синтезу молекули АТФ, її вивільнення та транспорту у цитозоль потрібна енергія 4 протонів (40% цієї енергії іде на синтез АТФ, 60% виділяється у вигляді тепла).
Кількість молекул неорганічного фосфату, яке перейшло у зв’язану форму (тобто у АТФ) у перерахунку на один атом кисню має назву коефіцієнт окисного фосфорилювання і позначається Р/O (коефіцієнт фосфорилювання).
Коефіцієнт Р/O чисельно дорівнює кількості молекул АТФ, що синтезувалися в результаті транспорту 2 ē на один атом кисню. Тому для субстратів, що окислюються під дією НАД-залежних дегідрогеназ Р/O= 3 (наприклад, для пірувату, α-кетоглутарату, ізоцитрату, малату). Для субстратів, які окислюються за допомогою ФАД-залежних дегідрогеназ, цей коефіцієнт дорівнює 2 (наприклад, для сукцинату, ацил-КоА, гліцерил-3-фосфату).
