
- •18 Кинетика ферментативных реакций
- •19 Классификация и номенклатура ферментов
- •20 Эндергонические и экзергонические реакции
- •21 Строение митохондрий Наружная мембрана
- •23 Биохимия питания
- •24 Витамины
- •27 Цикл лимонной кислоты
- •29 Основные углеводы животных
- •30 Аэробный гликолиз
- •31 Биосинтез глюкозы из аминокислот
- •32 Гликоген
- •33 Анаэробный гликолиз
- •34 Липиды
- •35 Переваривание липидов биохимия
- •37 Распад жирных кислот в клетке
- •38 Кетоновые тела биосинтез
- •39 Биосинтез жирных кислот
- •40 Холестерин
- •41 Липопротеины плазмы крови
- •42 Липидный состав мембран
- •43 Биологические мембраны
- •44 Механизм переноса веществ через мембрану
- •45 Переваривание белков
- •48 Метаболизм аминокислот
- •49 Источники аммиака в организме
- •50 Орнитиновый цикл мочевинообразования
- •51 Обмен фенилаланина и тирозина
- •53 Декарбоксилирование аминокислот
- •54 Биосинтез гема
- •55 Распад гема ----
- •57 Образование активных форм кислорода
- •59 Биосинтез и распад пиримидиновых нуклеотидов
- •61 Первичная структура нуклеиновых кислот
- •62 Репликация
- •63 Транскрипция
- •64 Генетический код
- •65 Сборка полипептидной цепи на рибосоме
- •66 Особенности синтеза и процессинга секретируемых белков( коллаген и инсулина)
- •67 Клетки мишени
- •70 Классификация гормонов
63 Транскрипция
ТРАНСКРИПЦИЯ (от лат. transcriptio, букв-переписывание), биосинтез РНК на матрице ДНК; первая стадия реализации генетич. информации, в ходе к-рой нуклеотидная последовательность ДНК считывается в виде нуклеотидной последовательности РНК (см. Генетический код). В основе этого процесса лежит принцип комплементарного спаривания пуриновых и пиримидиновых оснований (см. Компле-ментарность). Транскрипция осуществляется с участием фермента РНК-полимеразы, использующей в качестве субстратов рибонук-леозидтрифосфаты. Кроме того, в транскрипции участвует большое число вспомогат. белков, регулирующих работу РНК-полимеразы.
Транскрипция происходит на участках ДНК, наз. единицами транскрипции или трапскриптонами. В начале и конце транскрилтона расположены специфич. нуклеотидные последовательности -соотв. промотор и терминатор. Существование множества транскриптонов обеспечивает возможность независимого считывания разных генов, их индивидуального включения и выключения. У животных, растений и др. эукариот в состав транскриптона, как правило, входит один ген. Транс-криптоны бактерий обычно наз. оперонами; мн. из них содержат по неск. генов, обычно функционально связанных (напр., кодирующих неск. ферментов, участвующих в синтезе той или иной аминокислоты).
Процесс синтеза РНК можно разделить на четыре основные стадии: 1) связывание РНК-полимеразы с промотором, 2) начало синтеза цепи РНК (инициация), 3) рост цепи РНК (элонгация), 4) завершение синтеза цепи РНК (терминация).
Связывание РНК-полимеразы с промотором включает по крайней мере два этапа. На первом РНК-полимераза образует с промотором закрытый комплекс, в к-ром ДНК сохраняет двухспиральную структуру, а РНК-полимераза еще не способна начать синтез РНК. На втором закрытый комплекс превращается в открытый, в к-ром РНК-полимераза расплетает примерно один виток двойной спирали ДНК в районе стартовой точки-нуклеотида, с к-рого начинается комплементарное копирование матрицы.
При наличии субстратов РНК-полимераза в открытом комплексе осуществляет инициацию. Первый нуклеотид (обычно это аденозин- или гуанозинтрифосфат) входит в состав цепи целиком, а последующие присоединяются к группе 3'-ОН предыдущего нуклеотида с образованием фос-фодиэфирной связи и освобождением пирофосфата (см. Нуклеиновые кислоты). На стадии инициации образующаяся РНК связана с матрицей и ферментом непрочно и может отделиться от комплекса. В этом случае РНК-полимераза, не покидая промотора, снова инициирует РНК (такой синтез коротких рибонуклеотидов наз. абортивным). Стадия инициации завершается, когда цепь РНК достигает критич. длины (от 3 до 9 нуклеотидов на разных промоторах); при этом от РНК-полимеразы отделяется s-субъединица.
Считают, что в процессе элонгации примерно 13 нуклеотидов РНК образуют гибридную спираль с матричной нитью расплетенной ДНК (всего на этой стадии в ДНК расплетено примерно 18 нуклеотидов). По мере движения РНК-полимеразы по матрице впереди нее происходит расплетание, а позади восстановление двойной спирали ДНК. Одновременно происходит вытеснение очередного звена растущей цепи РНК из комплекса с матрицей.
Цепь РНК растет в направлении 5' : 3' по мере продвижения РНК-полимеразы по цепи ДНК в направлении от 3'-конца к 5'-концу. Средняя скорость роста цепи РНК у бактерии Escherichia coli (E. coli) составляет 40-45 рибонуклеотидов в секунду. В процессе удлинения цепи РНК фермент движется по ДНК с непостоянной скоростью. В нек-рых участках матрицы происходят длительные задержки в его продвижении, т. наз. паузы (нек-рые стадии транскрипции показаны на рис.).
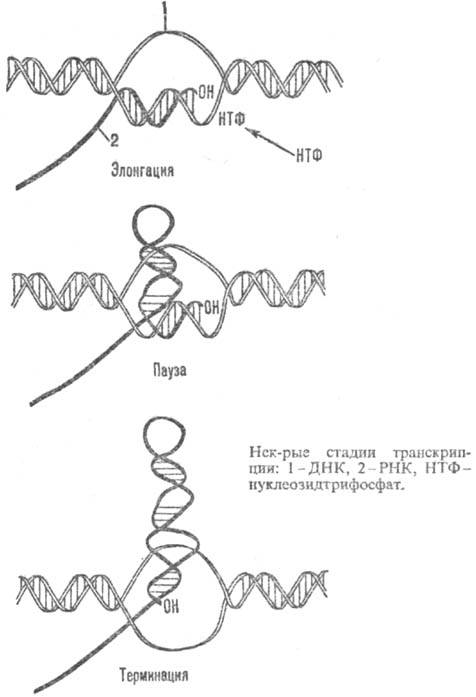
На стадии злонгации в состав транскрибирующего комплекса входит ряд дополнит. белков, от к-рых зависит протекание завершающей стадии транскрипции -терминации. Один из таких белков, кодируемых геном nusA E. coli, занимает в РНК-полимеразе место s-субъединицы. Др. бактериальный фактор терминации r взаимод. с РНК.
Терминация транскрипции, как правило, происходит в строго определенных участках матрицы - терминаторах, в к-рых от матрицы отделяются РНК и РНК-полимераза; последняя, объединившись со свободной s-субъединицей, может вступить в следующий цикл транскрипции. В терминаторах, для узнавания к-рых РНК-полимеразе не требуется фактора р, нуклеотидная последовательность характеризуется двумя особенностями: по ходу транскрипции перед точкой терминации расположен участок, богатый парами dG-dC (дезоксигуанозин-дезоксицити-дин), а затем участок, состоящий из 4-8 расположенных подряд остатков дезоксиадениловой к-ты. Предполагают, что после прохождения РНК-полимеразой участка, богатого dG-dC, в РНК возникает шпилька, к-рая препятствует продвижению фермента и разрушает часть спирали РНК-ДНК транскрибирующего комплекса. Оставшаяся часть гибридной спирали, включающая концевую полиуридиловую последовательность РНК, легко плавится (разрушается) ввиду крайней нестабильности комплементарной пары уридин-дезоксиаденозин, что и приводит к освобождению РНК.
Мн. терминаторы узнаются РНК-полимеразой только с помощью белковых факторов терминации. Из них наиб. изучен фактор r E. coli-олигомерный белок с мол. м. 46 тыс. Фактор r присоединяется к определенным участкам синтезируемой РНК (не имеющим протяженных двухспи-ральных структур) до того, как РНК-полимераза достигает терминатора. Предполагается, что фактор r передвигается вдоль РНК вслед за РНК-полимеразой, используя для этого энергию гидролиза нуклеозидтрифосфатов, и способствует диссоциации гибрида РНК с матричной нитью ДНК.
Скорость транскрипции разл. генов может отличаться в тысячи раз; в столь же больших пределах может изменяться скорость транскрипции одного и того же гена в разных тканях многоклеточного организма или в одной клетке в зависимости от изменяющихся внеш. условий или внутр. программы. На стадии инициации регуляция транскрипции осуществляется благодаря наличию особых белков-регуляторов (см. Регуляторные белки), способных присоединяться к определенным участкам ДНК и тем самым препятствовать или помогать РНК-полимеразе инициировать синтез РНК на промоторе.
У прокариот регуляция транскрипции часто осуществляется на стадии терминации в особых терминаторах (называемых аттенюаторами), расположенных в начале или внутри оперонов.
Существует также обратная транскрипция-синтез ДНК на матрице РНК. Такой синтез осуществляется у ретровирусов (семейство РНК-содержащих вирусов) с участием фермента ревер-тазы (обратная транскриптаза). В ходе обратной транскрипции образуется вначале гибрид РНК-ДНК, к-рый реплицирует под действием ДНК-зависимой ДНК-полимеразы (см. Полиде-зоксирибонуклеотид-синтетазы) с образованием двухцепо-чечной спирали ДНК. Последняя также подвержена репликации и способна включаться в геном инфицированной клетки и служить там матрицей для вирусной РНК. Транскрипция обр., поток генетич. информации у ретровирусов направлен от РНК к ДНК и затем обратно к РНК.
РНК-полимеразу открыли С. Вейс, Ж. Гурвиц и О. Стивене в 1960; ими же установлено ее значение в синтезе РНК. Концепцию транскриптона (оперона) сформулировали Ф. Жакоб и Ж. Моно в 1961. X. Темин и Д. Балтимор в 1970 открыли обратную транскриптазу и механизм синтеза ДНК на РНК-матрице.
