
- •Наглядная иммунология
- •Предисловие
- •1. Определение иммунологии
- •2. Естественные и адаптивные иммунные механизмы
- •3. Эволюция иммунных механизмов
- •7. Фагоцитарные клетки. Система мононуклеарных фагоцитов
- •8. Фагоцитоз
- •9. Лимфоциты
- •10. Центральные лимфоидные органы и лимфопоэз
- •11. Периферические лимфоидные органы и рециркуляция лимфоцитов
- •12. Эволюция распознающих молекул
- •13. Главный комплекс гистосовместимости (гкгс)
- •15. Синтез и многообразие антител
- •16. Структура и функции антител
- •17. Распознавание и переработка антигена
- •18. Гуморальный иммунный ответ
- •19. Взаимодействие антигена и антитела и иммунные комплексы
- •20. Клеточный иммунный ответ
- •21. Толерантность
- •22. Идиотипы, антиидиотипы и их сети
- •23. Цитокиновая сеть
- •24. Иммунитет, гормоны, мозг
- •25. Антимикробный иммунитет. Общая схема
- •26. Противовирусный иммунитет
- •27. Иммунитет к бактериям
- •28. Иммунитет к грибам
- •29. Иммунитет к простейшим
- •30. Иммунитет к гельминтам
- •32. Нежелательные проявления иммунитета. Общая схема
- •33. Аллергия и анафилаксия
- •34. Иммунные комплексы, комплемент и заболевания
- •36. Аутоиммунитет
- •37. Отторжение трансплантата
- •38. Иммуносупрессия
- •39. Иммунодефициты
- •40. Вич и спид
- •41. Иммуностимуляция и вакцинация
19. Взаимодействие антигена и антитела и иммунные комплексы
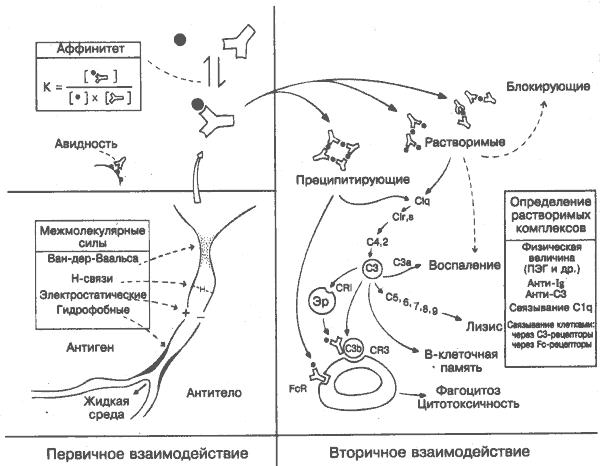
Антиген стимулирует синтез антител, которые соединяются с этим антигеном. Оба процесса основаны на взаимной комплементарности конфигурации антигенной детерминанты и антигенсвязываюшего участка антитела, образованного гипервариабельными участками тяжёлой и лёгкой цепей (рис. 16). Чем ближе это соответствие, тем интенсивнее нековалентные силы между ними (гидрофобные, электростатические и т.д.; на рисунке слева внизу) и тем выше аффинитет (слева вверху). Связывание антигена двумя активными центрами антитела увеличивает прочность соединения и характеризуется авидностью.
Способность связываться только с определённой антигенной детерминантой характеризует специфичность антител. Специфичность основана на огромном числе различающихся по конфигурации активных участков, которое заложено в V-генах и ещё более увеличивается в результате соматических мутаций (рис. 15). В результате в организме образуются миллионы антител различной специфичности, что составляет антительный репертуар.
Последствия соединения антитела с антигеном могут быть различными. Иногда, как в случае тех микроорганизмов и токсинов, которым для проявления патогенного свойства необходимо прикрепиться к поверхностным рецепторам клетки,нейтрализующего действия антител, связывающих антигенные детерминанты, оказывается достаточно. Чаще всё-таки требуется взаимодействие антител с другими эффекторными агентами, такими, как комплемент или фагоциты. О значении этого вторичного взаимодействия говорит уже то, что проявления дефицита комплемента и миелоидных клеток приводят почти к таким же последствиям, как дефицит антител (рис. 39).
Соединение из антигена и антитела называют иммунным комплексом. В зависимости от природы и соотношения антигена и антител иммунные комплексы могут быть мелкими (растворимыми) или крупными (преципитирующими) (справа вверху). Обычно они удаляются фагоцитарными клетками в результате взаимодействия Fc-участка антитела с комплементом и поверхностными рецепторами фагоцитов (в центре внизу; см. также рис. 8). В некоторых случаях комплексы циркулируют в крови и вызывают воспалительное поражение органов (рис. 34) или подавляют иммунитет, например, к опухолям или паразитам. Обнаружение иммунных комплексов и идентификация входящих в их состав антигенов представляют большой практический интерес и проводятся с помощью многочисленных методик.
ВЗАИМОДЕЙСТВИЕ АНТИГЕНА И АНТИТЕЛА
Антигенсвязывающий участок антитела представляет собой щель размером примерно 3х1х1 ни (размер 5 или 6 углеводных единиц), но известно, что антигены способны связываться с большими или даже отдельными частями вариабельной области. Связывание основывается на тесном трехмерном контакте, так что слабые межмолекулярные силы преодолевают нормальное отталкивание.
Ван-дер-Ваальса силы притягивают все молекулы через облако электронов, но действуют только на очень коротких расстояниях.
Водородные связи (Н-связи) (например, между -NH2- и -ОН-группами) — другой вариант слабых сил.
Электростатическое притяжение молекул антигена и антитела, несущих оппозитные заряды, может быть достаточно сильным.
Гидрофобные области антигена и антитела притягиваются в жидкой среде. Возможно, это наиболее сильная связь в иммунном комплексе.
Аффинитет выражается константой равновесия (на рисунке слева вверху). Значение, например, 103 л/моль считается низким, а у высокоаффинных антител оно может достигать 1010 л/моль и выше, что на несколько порядков больше, чем в большинстве взаимодействий фермент-субстрат. На практике чаще измеряют авидность, поскольку антитела имеют как минимум 2 активных участка и с моновалентными антигенами антисыворотка может реагировать с аффиннитетом средней степени. После антигенной стимуляции аффиннитет антител постепенно повышается, особенно в результате клеточной селекции снижающимся количеством антигена и частично соматической мутации генов иммуноглобулинов. В большинстве случаев вы-сокоаффинные антитела гораздо эффективнее, но поскольку антитела с низким аффиннитетом тоже существуют, они могут иметь определённые преимущества (многоразовость, отсутствие толерантности).
ИММУННЫЕ КОМПЛЕКСЫ
При избытке антигена или антител образуются преимущественно мелкие (растворимые) комплексы. При почти одинаковых количествах антигена и антител (зона эквивалентности) формируются преципитаты (образования решётчатой структуры). В присутствии комплемента (т.е. в свежей сыворотке) образуются только растворимые комплексы; СЗ способен растворять крупные комплексы (рис. 34).
Блокирование киллерной активности, опосредованной Т-лим-фоцитами или антителами, иммунными комплексами при избытке антигена или антител (соответственно) может стать причиной неотвечаемости на опухоли или паразитарные заболевания.
C1q — первый компонент комплемента. Связывается с Fc-фрагментом антител в иммунном комплексе, и, возможно, это происходит после конформационных изменений в молекуле Ig, хотя некоторые исследователи считают достаточным условием на-груженность антигеном обоих активных участков (IgG). Связывание Clq с иммунным комплексом вызывает активацию комплемента по классическому пути.
Воспаление. Продукты расщепления СЗ и С5, воздействуя на тучные клетки, нейтрофилы и др., вызывают повреждение сосудов, характерное для болезней, связанных с иммунными комплексами (рис. 34).
Лизис (например, бактерий) требует полного каскада компонентов комплемента. Иногда комплекс С5,6,7 удаляется от первоначального участка связывания антитела, активирует С8 и С9 и вызывает лизис нормальных клеток (например, эритроцитов) — процесс, известный как реактивный лизис.
Фагоцитоз. Чаще всего иммунные комплексы фагоцитируются макрофагами, нейтрофилами, эозинофилами и др. Обычно классы и подклассы антител, соединяющиеся с Fc-рецепторами фагоцитов, связываются и с комплементом, давая более высокий эффект опсонизации. Действие через Fc- и СЗ-рецепторы происходит по разным механизмам. IgM, например, в большей степени связывает комплемент, чем взаимодействует с фагоцитарными клетками. Большинство иммунных комплексов, циркулирующих в крови, связывается через рецепторы комплемента с эритроцитами (рис. 5), попадает с ними в печень или селезёнку, где удаляется местными фагоцитарными клетками.
Цитотоксичность. Антитела, связанные с поверхностью клетки или микроорганизма, через Fc-рецепторы могут опосредовать киллинг, а не фагоцитоз. Макрофаги, моноциты, нейтрофилы, эозинофилы и лимфоцитоподобные К-клетки способны осуществлять антителозависимую клеточно опосредованную Цитотоксичность (рис. 9). Данные о значении этого типа цитотоксичности in vivo противоречивы.
В-клеточная память. Фолликулярные дендритные клетки имеют рецепторы к комплементу, которые позволяют им удерживать иммунные комплексы и представлять антиген В-лимфоци-там с высокоаффинными свойствами рецепторов, обеспечивая тем самым усиление антительного ответа.
Выявление растворимых комплексов
Иммунные комплексы осаждают ультрацентрифугированием или в градиентах плотности и преципитируют в полиэтиленгликоле (ПЭГ), а также на холоде (криопреципитация). Имея в своём составе иммуноглобулины, комплексы выявляются анти-Ig-антителами (например, ревматоидный фактор). Для обнаружения иммунных комплексов часто используют чувствительную реакцию их связывания с C1q. Выявление компонента СЗ основано на применении анти-СЗ-сывороток (иммуноконглютинин) и использовании клеток линии Raji с рецепторами комплемента. Некоторые комплексы не фиксируют комплемент, но преципитируются ПЭГ. Отдельные тесты могут выявлять также другие крупные молекулы. Поэтому для определения иммунных комплексов необходимо сочетание нескольких тестов.
