
- •Наглядная иммунология
- •Предисловие
- •1. Определение иммунологии
- •2. Естественные и адаптивные иммунные механизмы
- •3. Эволюция иммунных механизмов
- •7. Фагоцитарные клетки. Система мононуклеарных фагоцитов
- •8. Фагоцитоз
- •9. Лимфоциты
- •10. Центральные лимфоидные органы и лимфопоэз
- •11. Периферические лимфоидные органы и рециркуляция лимфоцитов
- •12. Эволюция распознающих молекул
- •13. Главный комплекс гистосовместимости (гкгс)
- •15. Синтез и многообразие антител
- •16. Структура и функции антител
- •17. Распознавание и переработка антигена
- •18. Гуморальный иммунный ответ
- •19. Взаимодействие антигена и антитела и иммунные комплексы
- •20. Клеточный иммунный ответ
- •21. Толерантность
- •22. Идиотипы, антиидиотипы и их сети
- •23. Цитокиновая сеть
- •24. Иммунитет, гормоны, мозг
- •25. Антимикробный иммунитет. Общая схема
- •26. Противовирусный иммунитет
- •27. Иммунитет к бактериям
- •28. Иммунитет к грибам
- •29. Иммунитет к простейшим
- •30. Иммунитет к гельминтам
- •32. Нежелательные проявления иммунитета. Общая схема
- •33. Аллергия и анафилаксия
- •34. Иммунные комплексы, комплемент и заболевания
- •36. Аутоиммунитет
- •37. Отторжение трансплантата
- •38. Иммуносупрессия
- •39. Иммунодефициты
- •40. Вич и спид
- •41. Иммуностимуляция и вакцинация
16. Структура и функции антител
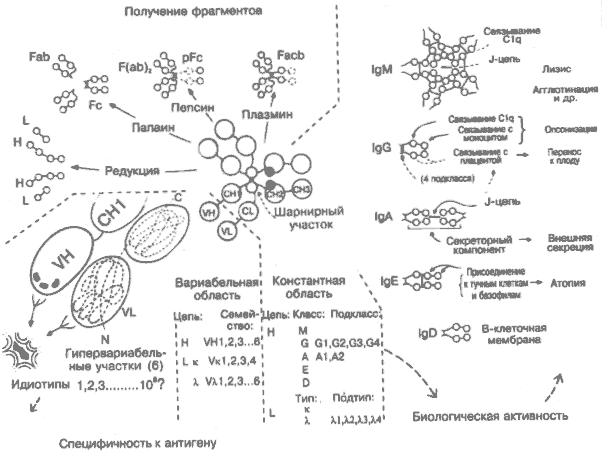
Учитывая, что антитела в сыворотке являются смесью около 100 млн мало различающихся типов молекул, легко представить, что изучение их структуры было очень нелёгкой задачей. Первым шагом в этой области было химическое расщепление молекул антител на фрагменты (на рисунке вверху слева). Более совершенные методы, такие как секвенирование аминокислотных последовательностей и рентгенокристаллография, основывались на применении полностью гомогенных (моноклональных) антител. Раньше их можно было получить в форме миеломных белков, продуцируемых опухолевыми В-лимфоцитами. С появлением метода гибридом (рис. 9) стало возможным получать моноклональные антитела разной специфичности в неограниченных количествах.
Типичная молекула антитела (IgG) состоит из 12 расположенных попарно доменов, образующих 2 лёгкие (L) и 2 тяжёлые (Н) цепи, сшитые через цистеиновые остатки дисульфидными связями. Молекула имеет гибкую структуру, напоминающую по конфигурации букву Y. В каждой цепи N-концевые домены наиболее вариабельные, остальные относительно константные. Типичная молекула IgG имеет 2 антигенсвязывающих (активных) центра, каждый из которых образован 6 (по 3 на каждой цепи) гипервариабельными участками вариабельной (V)-области (слева на рисунке). В этих участках наблюдается максимум вариаций аминокислотных последовательностей. В константной (С) области варьируют в основном участки, взаимодействующие с комплементом или различными клеточными рецепторами. В правой части рисунка схематично показаны константные области 5 классов антител Ig — М, О, А, Е и D. Сочетания различных V- и С-областей дают огромное количество молекул, способных запустить любой из имеющихся эффекторных механизмов против любого антигена. Основная структура (типа IgG; м. м. около 160000) может образовывать димеры (IgA; м. м. 400 000) или пентамеры (IgM; м. м. 900 000).
Существуют сравнительно недавно эволюционно сформировавшиеся межвидовые различия, особенно в подклассах тяжёлых цепей (на рисунке представлены примеры для Ig человека). В последнее время все больше внимания уделяется боковым углеводным цепям, составляющим иногда до 12% всей молекулы. Возможно, с ними связана секреция молекул. Выявлено их нарушение при некоторых заболеваниях. На рисунке молекула Ig изображена крайне схематично. На самом деле она имеет трёхмерную конфигурацию, что показано на примере связывания с антигеном в правой верхней части рис. 16.
Фрагменты, полученные при химической обработке молекул Ig:
Н, L: тяжёлые и лёгкие цепи, которые связаны только дисульфидными связями и легко разделяются под действием восстановителя.
Fab: антигенсвязываюший фрагмент (расщепление папайном цельной молекулы).
Fc: кристаллизуемый относительно гомогенный фрагмент (расщепление папаином).
F(ab)s: два Fab-фрагмента, объединённых дисульфидными связями (расщепление пепсином).
pFc: димер из СНЗ-доменов (расщепление пепсином).
Facb: молекула Ig без СНЗ-доменов (расщепление плазмином).
Цепи. Хотя тяжёлые (Н) и лёгкие (л., к) цепи кодируются генами разных хромосом, гомология последовательностей подтверждает, что все Ig-домены произошли от общей молекулы-предшественницы длиной около 110 аминокислот (рис. 12).
Классы. Физические, антигенные и функциональные различия между константными областями определяют 5 основных классов тяжёлых цепей — М, G, А, Е и D и соответствующие им 5 классов иммуноглобулинов. У большинства высших биологических видов присутствуют антитела всех 5 классов.
IgM. В процессе эволюции антитела класса IgM появились первыми. Они же первыми синтезируются в ответ на первичную антигенную стимуляцию (рис. 3). Так как они имеют пентамерную структуру с 10 активными центрами, то они эффективны в связывании и агглютинации микроорганизмов.
IgG — антитела класса IgG при иммунном ответе появляются в сыворотке вслед за IgM. Обладают способностью активно связываться своим Fc-участком с Clq (рис. 5) и рецепторами фагоцитов (рис. 8). Поступают во внесосудистые пространства и (через плаценту) к плоду. Большинство биологических видов имеют несколько подклассов IgG (см. ниже).
IgA — основные антитела, содержащиеся в секрете (слюна, пот), в лёгких, кишечнике, моче. Имеют дополнительную структуру — секреторный компонент, предохраняющий молекулу антитела от расщепления. Основная функция IgA — предотвращать проникновение антигенов с внешних поверхностей в ткани.
IgE способны через Fc-фрагмент связываться с тучными клетками и стимулировать их дегрануляцию (рис. 33).
IgD действуют на поверхности В-клеток, выполняя регулирующие функции. IgD мыши вместо 3 константных областей тяжёлой цепи имеет только 2.
Подклассы, подтипы. Небольшие вариации в константных областях молекул одного класса определяют подклассы антител. Больше всего их у IgG. Варианты константных областей лёгких цепей иногда обозначают как подтипы. Эти варианты, присутствующие у всех представителей данного вида, называются изотипами. Различные антигены вызывают синтез различных подклассов IgG (например, у человека вирусы стимулируют синтез IgGI и IgG3, полисахариды — синтез IgG2), однако природа этой связи ещё неизвестна.
Аллотипы Варианты иммуноглобулиновых молекул между отдельными представителями вида называются аллотипами. Они генетически детерминированы, возможно, регулируются генетическими факторами и связаны главным образом с С-областями. Их биологические функции пока точно не установлены. В отличие от групп крови, аллотипические детерминанты присущи отдельным В-клеткам. Закон аллельного исключения обеспечивает возможность экспрессии только одного аллотипа (алле-ля) Ig на отдельной В-клетке. Это означает, что для синтеза антител используется только один из двух наборов хромосом клетки, вероятно, тот, в котором раньше осуществилась успешная перестройка генов.
Гипервариабельные области — 6 участков вариабельных областей тяжёлой и лёгкой цепей (по 3 на каждой), приблизительно равные по аминокислотному набору (нижняя левая часть рисунка). При свёртывании молекулы в b-складчатую структуру сближаются и образуют антигенсвязывающий центр. Разнообразие антигенсвязывающих участков обеспечивается за счёт огромной вариабельности кодирующих участков ДНК и необычайной подверженности генов гипервариабельных областей соматическим мутациям. Сходные последовательности позволяют объединять V-гены в семейства.
Идиотипы Антигенсвязывающий участок одной молекулы антитела может быть распознан и связан другой антительной молекулой. В этом случае они называются соответственно идиотипическими и антиидиотипическими антителами. Антиидиотипические антитела присоединяются примерно к тому же участку гипервариабельной области, что и антиген. Антиидиотипические антитела образуются в норме и могут участвовать в регуляции иммунного ответа (рис. 22).
Шарнирный участок. За счёт повторных пролиновых остатков в этом участке молекулы обеспечиваются гибкость и чувствительность к протеолитическому расщеплению. В IgM шарнирный участок имеет размеры нормального домена и обозначается СН2. Два других константных домена обозначаются СНЗ и СН4. То же присуще молекуле IgE.
J-пепь — гликопептидная молекула, обеспечивающая полимеризацию IgA и IgM.
Секреторный компонент — полипептид, происходящий из поли-Ig-рецептора (рис. 15) и включаемый в структуру IgA в эпителиальных клетках, что обеспечивает транспорт через эпителий и секрецию в кишечник, слюну, слёзную жидкость, молоко и др., где IgA является преобладающим.
C1q — первый компонент классического пути активации комплемента. Шестивалентный гликопротеин, активируемый при связывании с СН2-доменом IgM и IgG некоторых подклассов (у человека IgG1 и IgG3) (рис. 5).
