
Ответы химия 9 класс
.docx
2
2 2 2 2 4 8 3 2
2
 КПС-
связь, которая образуется за счет
спаривания не спаренных электронов(разные
неМе)
КПС-
связь, которая образуется за счет
спаривания не спаренных электронов(разные
неМе)
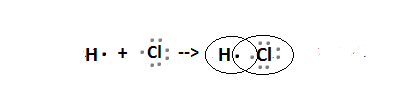 КНС-
связь, которая образуется за счет
спаривания не спаренных электронов(одинаковые
неМе)
КНС-
связь, которая образуется за счет
спаривания не спаренных электронов(одинаковые
неМе)
![]() КНС
возникает у:
Н , О , N
, F
, Cl
, P
, S
, O
, Br
, I
Металлическая связь
– связь, которая образуется в Ме и
сплавах между ион-атомами Ме и
полусвободными электронами за счет
электростатического притяжения.
КНС
возникает у:
Н , О , N
, F
, Cl
, P
, S
, O
, Br
, I
Металлическая связь
– связь, которая образуется в Ме и
сплавах между ион-атомами Ме и
полусвободными электронами за счет
электростатического притяжения.
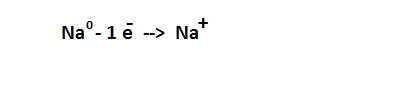
Билет №3. а) число и состав реагирующих веществ: Соединение- реакция, при которой несколько веществ соединяются в одно сложное. 4P + 5О2 = Р2О5 Разложение-реакция, при которой одно сложное вещество разлагается на несколько других. СаСО3 = СаО + СО2 Замещение- реакция, при которой атомы простых веществ замещают атомы в сложном веществе. Н2SO4+ Zn=H2+ ZnSO4 Обмен- реакция, при которой два сложных вещества обмениваются своими составными частями.
СаСО3+
2НCl=
CaCl2
+ H2CO3
б)
ОВР:
ОВР-реакции
протекающие с изменением степеней
окисления атомов элементов.
Степень
окисления- условный заряд атома в
молекуле.
ОВР:
![]() окисление:
окисление:
![]() восстановление:
восстановление:
![]() не
ОВР:
СаО +
Н2О = Са(ОН)2
в)
агрегатное состояние веществ:
Гомогенные
реакции- все вещества находятся в одном
агрегатном состоянии.
не
ОВР:
СаО +
Н2О = Са(ОН)2
в)
агрегатное состояние веществ:
Гомогенные
реакции- все вещества находятся в одном
агрегатном состоянии.
Гетерогенные реакции- все вещества находятся в разных агрегатных состояниях.
г) тепловой эффект: Экзотермические реакции – реакции с выделением тепла.
Эндотермические реакции – реакции с поглощением тепла.
д) направление химических процессов:
Обратимые реакции – реакции, которые идут в двух направлениях.
Необратимые реакции- реакции, которые идут в одном направлении.
е) использование катализатора: Катализатор – вещество, ускоряющее химическую реакцию. Каталитическая реакция:
Некаталитическая реакция:
Билет №4. Под скоростью химических реакций понимают изменения концентрации одного из реагирующих веществ в единицу времени при неизменном объеме.
Скорость химической реакции =
Скорость химической реакции зависит от: а) природы реагирующего вещества
б) концентрации реагирующего вещества
Закон действующих масс:
Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степени их коэффициентов.
в) температуры
Правило Вант-Гофа:
При увеличении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза.
г) катализаторов
д) площади соприкосновения
Чем больше площадь соприкосновения, тем быстрее скорость реакции.
Билет №5.
Обратимые химические реакции – реакции, которые протекают в двух направлениях. Они не доходят до конца ,а заканчиваются установлением химического равновесия.
Необратимые химические реакции – реакции, которые протекают в одном направлении и заканчиваются полным превращением веществ в продукты реакции.
Правило Бертолле : Реакции идут до конца, если в результате реакции получится газ, осадок или вода.
Химическое равновесие – такое состояние системы, при котором скорость прямой реакции = скорости обратной реакции.
Принцип Ле Шателье: Если на систему, находящуюся в равновесии воздействовать температурой, давлением, изменением концентрации веществ, то она будет способствовать протеканию той из реакций, которая ослабляет это воздействие.
Смещение химического равновесия:
Увеличение концентрации исходных веществ () Увеличение концентрации продуктов реакции () Увеличение температуры ( -Q) Уменьшение температуры ( +Q) Катализаторы на смещение равновесия не влияют. При увеличении давления равновесие сместится в сторону меньшего объема. Вывод продукта реакции из сферы реакции ()
Билет №6.
Растворимость вещества или k растворимости – величина, которая показывает, сколько граммов вещества растворяется в 100 гр воды при данной температуре.
Электролитическая диссоциация – распад электролитов на ионы при растворении в воде или расплавлении.
Неэлектролиты – вещества, растворы или расплавы которые не проводят электрический ток. 1. Нерастворимые соли, основания, кислоты; 2. Простые вещества; 3. Оксиды; 4. Органические вещества, кроме солей и кислот.
Электролиты – вещества, растворы или расплавы, которые проводят электрический ток.
1. Растворимые соли; 2. Щелочи; 3. Растворимые кислоты. Электролиты Сильные Слабые 1. Все растворимые соли 1. NH4OH 2. Все щелочи, кроме NH4OH 2. Вода 3. Неорганические кислоты 3. Органические кислоты (HNO3, H2SO4, HClO4, HCl, HBr, (CH3COOH уксусная, НСООН муравьиная) HI, HMnO4, H2CrO4, H2Cr2O7) 4. Неорганические кислоты (HF, H2SO3, H2S, H2SiO3, H2CO3) Механизм ЭЛД веществ:
а) с ионным видом связи
1. Ориентация 2. Гидратация
3. Диссоциация
б) с ковалентной полярной связью
1. Ориентация
2. Гидратация
3. Ионизация
4. Диссоциация
Ионы по составу бывают: Простые и сложные.
Н – кисл.; ОН – осн.; Катионы Ме + анионы кислотного остатка – соль. Ионы по заряду бывают: Катионы – положительно заряженные ионы. Анионы – отрицательно заряженные ионы. По наличию водной оболочки ионы бывают: Гидратированные – ионы, окруженные со всех сторон молекулами воды. Некоторые вещества диссоциируют ступенчато:
Билет № 11.
Генетическая связь – связь между классами веществ, заключенная в их взаимном превращении.
Билет № 12.
Положение Ме в периодической системе Д.И. Менделеева:

1.Металлы имеют на последнем энергетическом уровне 1 или 2 электрона (исключения: Висмут, Полоний, Сурьма)
2. Большой радиус 3. Низкая электроотрицательность
4. Легко отдают электроны с внешнего уровня
5. Восстановители
Физические свойства Ме:
1.Металлический блеск, звон
2.Пластичные,ковкие
3. Легкоплавкие(ртуть)
и тугоплавкие (вольфрам)
4. Токсичные (радий), тяжелые (осмий), легкие (литий), твердые (хром)
Металлическая связь – связь между ион-атомами Ме и обобществленными электронами за счет электростатического притяжения
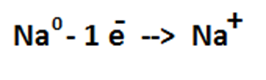
Металлическая кристаллическая решетка – решетка, в узлах которой находятся ион-атом Ме между которыми передвигаются относительно свободные электроны.
Билет № 14.
Металлы в природе.
а) только в самородном виде (Au, Pt)
б) только в соединениях (Ме, стоящие до Н)
в) в самородном виде и в соединениях (Ag, Cu, Hg)
Природные соединения Ме.
а) в виде оксидов:
Fe O – красный железняк, гематит
Fe O – магнитный железняк, магнетит
Fe O nH O – бурый железняк, мелонид
б) в виде сульфидов:
FeS - перид
CuFeS - халькоперид
в) в виде хлоридов
NaCl – галит
г) в виде нитратов:
NaNO – чилийская селитра
д) в виде карбонатов:
CaCO - мрамор
е) в виде аппатитов
Ca (PO )
Способы получения Ме.
Пирометаллургический (плавление) – восстановление Ме из их оксидов при высокой температуре с помощью углерода, водорода или углекислого газа.
Гидрометаллургия – перевод полезных компонентов руды в раствор и выделение продукта в чистом виде посредством электролиза или действия более активного Ме.
Электролиз – получение Ме с помощью электрического тока (Al).
Металлотермия – восстановление Ме из их соединений при высокой t° другими Ме.
Билет № 15.
Коррозия – разрушение металлов и их сплавов под действием окружающей среды. Это окислительно-восстановительный процесс при котором атомы Ме окисляются и переходят в ионы.
Ингибиторы коррозии уменьшают агрессивность среды.
Протектор – более активный Ме, который окисляется вместо защищаемого от коррозии.
Ингибитор воздействует на среду, а протектор на Ме.
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы. При проектировании конструкции стараются максимально изолировать от попадания коррозионной среды, применяя клеи, герметики, резиновые прокладки. Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами, такими как цинк, олово, хром, никель. Цинковое покрытие защищает сталь даже когда покрытие частично разрушено. Цинк имеет более отрицательный потенциал и коррозирует первым. Ионы Zn2+ токсичны. При изготовлении консервных банок применяют жесть, покрытую слоем олова. В отличие от оцинкованной жести, при разрушении слоя олова коррозировать, притом усиленно, начинает железо, так как олово имеет более положительный потенциал. Другая возможность защитить металл от коррозии — применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния. Для этого специально создаётся коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой. Растворяемый электрод, называют, соответственно, анодом протекторной защиты. Этот метод применяют для защиты от коррозии морских судов, мостов, котельных установок, расположенных под землей труб. Для защиты корпуса судна на наружную сторону корпуса крепят цинковые пластинки. Если сравнить потенциалы цинка и магния с железом, они имеют более отрицательные потенциалы. Но тем не менее коррозируют они медленнее вследствие образования на поверхности защитной оксидной плёнки, которая защищает металл от дальнейшей коррозии. Образование такой плёнки называют пассивацией металла. У алюминия её усиливают анодным окислением (анодирование). При добавлении небольшого количества хрома в сталь на поверхности металла образуется оксидная плёнка. Содержание хрома в нержавеющей стали — более 12 процентов.
Билет № 16.
Щелочные металлы : Li, Na, K, Rb, Cs, Fr.
Физические свойства щелочных Ме:
Низкие температуры плавления, малые значения плотностей, мягкие, режутся ножом.
Химические свойства щелочных Ме:
Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла. Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды.
Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs.
1.Активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H2 ОПЫТ
2Li + 2H2O → 2LiOH + H2
2. Реакция с кислотами:
2Na + 2HCl → 2NaCl + H2
3. Реакция с кислородом:
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2 (пероксид натрия)
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
4. В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → 2Li2C2 (карбиды)
5. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
Применение щелочных металлов:
Литий - подшипниковые сплавы, катализатор
Натрий - газоразрядные лампы, теплоноситель в ядерных реакторах
Цезий – фотоэлементы
NaOH-едкий натр, каустическая сода,
KOH-едкое кали
Na2CO3 10H2O - кристаллическая сода
Na2CO3 - кальцинированная сода
NaHCO3 - питьевая сода
K2CO3 – поташ(в золе)
Билет № 17.
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Строение молекул галогенов:
![]()
Галогеноводороды:
HF
HCl
HBr
HI
Физические свойства галогеноводородов:
- газы с резким запахом
- токсичны
- растворяются в воде
- дымят на воздухе
- при растворении в воде образуют кислоты
Строение молекулы галогеноводорода:
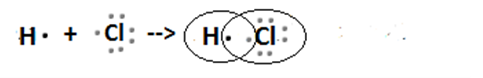
Галогениды – соли галогенов.
Биологическое значение галогенов и их применение. Вы не могли не обратить внимание, что на этикетках многих марок зубных паст указывается на содержание в них фтора — конечно, не свободного, а его соединений. Благодаря этому важному компоненту, участвующему в построении зубной эмали и костей, предотвращается такое заболевание, как кариес зубов. Кроме того, фтор является необходимым элементом в процессах обмена веществ в железах, мышцах и нервных клетках. Важное значение имеет фтор и в промышленном производстве, где основные потребители его — ядерная промышленность и электротехника. Его соединение Nа3АlF6 (как оно называется?) используется для производства алюминия. А в быту все более широкое применение находит тефлоновая посуда, название которой дано по фторсодержащей пластмассе — тефлону. Хлор — один из химических элементов, без которых немыслимо существование живых организмов. Основная форма его. поступления в организм — это хлорид натрия. Он стимулирует обмен веществ, рост волос, придает бодрость и силу. Больше всего NаСl содержится в плазме крови. Особую роль в пищеварении играет соляная кислота НСl, которая входит в состав желудочного сока. Без 0,2%-ной НСl практически прекращается процесс переваривания пищи. И хотя почти все пищевые продукты содержат некоторое количество поваренной соли, человек вынужден добавлять к пище ежедневно около 20 г соли. По масштабам промышленного применения хлор намного превосходит все галогены. Хлор и его соединения необходимы для отбеливания льняных и хлопчатобумажных тканей, бумаги и т. д. Особенно много его расходуется в органическом синтезе для производства пластмасс, каучуков, красителей и растворителей. Многие хлорсодержащие соединения используют для борьбы с вредителями сельского хозяйства. В больших количествах хлор потребляется для обеззараживания питьевой воды, правда, далеко не без отрицательных последствий (какое вещество безопаснее применять для этой цели?). В цветной металлургии методом хлорирования руд извлекают из них некоторые металлы (титан, ниобий, тантал). Хлор нашел применение и в военных целях в качестве боевого отравляющего средства. Позднее он был заменен другими, более эффективными хлорсодержащими отравляющими веществами, например фосгеном СОСl2. Хлор содержится в очень опасном для жизни и здоровья веществе — диоксине. Соединения хлора — одна из причин разрушения озонового слоя Земли. Еще один галоген — бром также весьма важен для организма человека. Соединения этого элемента регулируют процессы возбуждения и торможения центральной нервной системы, поэтому для лечения нервных болезней (бессонницы, истерии, неврастении и т. д.) врачи прописывают «бром» — бромсодер-жащие препараты. Бром активно накапливают некоторые растения, и в том числе морские водоросли. Именно в море сосредоточена большая часть брома на нашей планете, и море служит главным поставщиком брома. Подсчитано, что ежегодно вместе с морской водой в воздух переходит около 4 млн т брома. Понятно, что содержание его в воздухе приморских районов всегда больше, чем в районах, далеких от моря. Это одна из причин, почему так полезно дышать морским воздухом. Не менее важную роль бром, а точнее, бромид серебра АgВr играет в фотографии. Те, кто занимается фотографией, вероятно, сразу же вспомнят названия сортов фотобумаги — «Уни-бром», «Бромпортрет» и др. Фотобумага содержит нанесенный на нее с помощью желатина слой бромида серебра, который легко разлагается под действием света: 2АgВr = 2Ag + Br2. И наконец, последний из рассматриваемых нами галогенов — иод — это тот элемент, без которого человек не может жить: недостаток его в воде и пище снижает выработку гормона щитовидной железы и приводит к заболеванию эндемическим зобом. Под регулирующим действием гормона щитовидной железы находятся мускульное возбуждение, биение сердца, аппетит, пищеварение, работа мозга и темперамент человека. Иод попадает в организм вместе с пищей: хлебом, яйцами, молоком, водой, морской капустой и с воздухом (особенно морским) при дыхании. Спиртовой раствор иода (5—10% -ный), называемый йодной настойкой, применяется для обработки ран. Иод входит в состав многих лекарств. Главными потребителями иода являются фармацевтичеcкая и химическая промышленность, а также производство светочувствительных фотоматериалов.
Билет № 18.
Состав воздуха: Воздух — смесь газов. Основные компоненты его — азот (78% по объему), кислород (21%) и инертные газы (1%). Переменные составные части воздуха — углекислый газ и водяной пар. Пыль и различные газы, например SO2, H2S, оксиды азота и др., — примеси, наличие которых в воздухе зависит от местных условий, времени года, близости промышленных предприятий и др.
Значение воздуха: Основное назначение воздуха — это обеспечение дыхания живых организмов; кроме того, воздух используется как сырье для химической промышленности – для получения азота и кисло-рода, благородных газов (из сжиженного воздуха), при его наличии происходит горение топлива и многие другие природные процессы.
Защита атмосферы от химического загрязнения: Воздух — среда обитания всего живого на Земле, поэтому охрана воздуха — важнейшая задача человека. Первым шагом на пути к этому должно стать увеличение количества зеленых насаждений. Ведь именно растения являются основными поставщиками кислорода в атмосферу. Происходит это в процессе фотосинтеза:
6CO2 + 6 H2O = C6H12O6 + 6O2 (свет, хлорофилл)
Далее важно остановиться на источниках загрязнения атмосферы: химические производ-ства, продукты сжигания топлива, выхлопные газы автомобилей, продукты сжигания бытовых отходов (полиэтиленовые пакеты, пластик, поливинилхлоридные материалы и т. д.).
Основные загрязнители воздуха: пыль, оксиды азота (II), (IV), оксиды серы (IV), (VI), се-роводород, оксид углерода (II). Следует отметить, что большая загазованность крупных городов отрицательно сказывается на экологической обстановке, что в свою очередь влияет на самочув-ствие людей, флору и фауну. Основной вклад в высокий уровень загрязнения воздуха вносят предприятия черной и цветной металлургии, химии и нефтехимии, энергетики, целлюлозно–бумажной промышленности. Теплоэлектростанции вместе с дымом выбрасывают в воздух серни-стый и углекислый газ, а металлургические предприятия – оксиды азота, сероводород, хлор, фто-роводород, аммиак, соединения фосфора, пары и соединения ртути и мышьяка. Много пыли попа-дает в атмосферу вблизи химических и цементных заводов. Большую долю в загрязнении атмо-сферы составляют выбросы вредных веществ от автомобилей. В настоящее время основные экологические проблемы атмосферы: а) образование озоновых дыр; б) парниковый эффект (выбросы СО2); в) увеличение выбросов ионов тяжелых металлов (РЬ2+, Hg2+, Cd2+ и др.); г) выпадение кислотных дождей.
На сегодняшний день экологические бедствия приняли широкие масштабы, особенно в местах скопления крупных промышленных производств (Центр России, Урал). Можно выделить несколько способов очистки атмосферы: 1.установка очистных устройств на предприятиях (фильтры, улавливатели газов, дегазаторы и т. д.), 2.создание малоотходных экологически чистых производств; 3.разработка новых экологически чистых материалов; 4.использование пылеулавливателей; 5.очистка сточных вод.
Билет № 19.
Вода — самое распространенное в природе соединение. Молекула ее состоит из двух ато-мов водорода и одного атома кислорода (Н2О). Молекула воды имеет угловую форму и образована по типу ковалентной полярной химической связи. Ковалентная полярная связь – это связь, которая образуется за счет спаривания неспаренных электронов взаимодействующих атомов. Она образуется между атомами неметаллов. Общая электронная пара смещена к более электроотрицательному атому. Между молекулами воды образуются водородные связи (водородная связь – это связь, ко-торая образуется между сильно электроотрицательным атомом фтора, кислорода или азота одной молекулы и атомом водорода другой молекулы). Она как бы связывает молекулы. Она в 20 раз слабее ковалентной связи, но оказывает влияние на физические свойства веществ: агрегатное со-стояние, растворимость в воде, легкую сжижаемость, температуру плавления и кипения. Физически свойства воды Это единственное соединение, которое в природных условиях существует в трех агрегатных состояниях (твердом, жидком и газообразном). Она без цвета, без вкуса, без запаха. Не проводит электрический ток. Химические свойства воды 1.Разложение под действием электрического тока: 2H2O = 2H2 + O2 2.Вода взаимодействует с активными (щелочными и щелочноземельными) металлами: 2Na + 2H2O = 2NaOH + H2 Ca + 2H2O = Ca(OH)2 + H2 3.Вода взаимодействует с магнием, железом и цинком с образованием оксида при нагревании: Zn + H2O = ZnO + H2 ; 3Fe + 4H2O = Fe3O4 + 4H2 ; Mg + H2O = MgO + H2 4.Остальные металлы с водой не реагируют (алюминий с водой реагирует только амальгамированный) 2Al(без оксидной пленки) + 6H2O = 2Al(OH)3 + 3H2 Взаимодействует со всеми кислотными оксидами, кроме SiO2, с образованием кислоты SO2 + H2O = H2SO3 ; SO3 + H2O = H2SO4 ; P2O5 + 3H2O = 2H3PO4 5.Взаимодействует с оксидами щелочных и щелочноземельных металлов с образованием щелочи: CaO + H2O = Ca(OH)2 ; Na2O + H2O = 2NaOH Значение воды в природе и жизнедеятельности человека Вода составляет 2/3 от массы человеческого организма. Основные источники природной воды — лед, дождь, снег, вода рек и озер. На Земле лишь 3% приходится на пресную воду, из которых 80% недоступно для использования. Отсюда следует важность экономного и разумного использования запасов пресной воды, необходимость очистки загрязненных природных и сточных вод. К основным загрязнителям воды относятся: промышленные и бытовые стоки, твердые отходы, отходы сельского хозяйства (удобрения), естественные примеси, радиоактивные и тепловые загрязнители. Очистка воды производится в промышленных масштабах на очистных сооружениях. В общем случае очистка воды включает три стадии: 1) первичная очистка проводится с целью удаления механических примесей; 2) вторичная очистка, при которой происходит разложение содержащихся органических веществ под действием микроорганизмов или хлора; 3) третичная очистка включает биологическую, химическую и физическую обработку вод. Эта стадия позволяет довести сточные и природные воды до такого уровня чистоты, что она отвечает стандартам на питьевую воду. Особое внимание в последнее время уделяется чистоте питьевой воды.
Билет № 20. Жёсткость воды — совокупность таких свойств, которые придают воде ионы кальция и магния. Вода с большим содержанием солей кальция и магния называется жёсткой, с малым содержанием — мягкой. Введение понятия
Жёсткая вода при умывании сушит кожу.
В жесткой воде (например, ключевой) плохо образуется пена при использовании мыла, а в дождевой воде мыло пенится хорошо (мягкая вода). Мыло при стирке в жесткой воде расходуется не на стирку изделий, а на образование нерастворимых солей кальция и магния. Лишь почти после полного осаждения солей кальция и магния образуется пена.
2C17H35COONa (мыло: стеарат натрия) + CaCl2 (жесткая вода) = (C17H35COO)2Ca↓ + 2NaCl
2C15H31COONa (мыло: пальмитат натрия) + CaCl2 (жесткая вода) = (C15H31COO)2Ca↓ + 2NaCl
