
Алкалоиды группы хинолина: хинин.
ХИНОЛИНОВЫЕ АЛКАЛОИДЫ,
содержат в молекуле остаток хинолина или
нек-рых его производных. Включают более
300 представителей. Выделены из растений
14 семейств, а также нек-рых микроорганизмов и
животных. Наиб. богатые ими растения
семейства рутовых (Rutaceae), мареновых
(Rubiaceae), парнолистниковых (Zygophyliaceae) и
сложноцветных (Compositae).
Различают
след. основные группы хинолиновых алкалоидов:
1) простые хинолины (общая
ф-ла I; R = Н, ОСН3,
R' = алкил, арил),
4-хинолоны (II; R = Н, СН3,
R' = Н, алкил, арил)
и 2-хинолоны (III; R = Н, СН3,
R' = Н, алкил,
алкенил); 2) гемитерпеноидные и терпеноидные
трициклич. производные типов IV-Х; З)
фуранохинолины, к к-рым относятся, в
частности, производные диктамнина (XI;
R = ОСН3)
и соед. типа ХII; 4) димерные алкалоиды,
напр. ХIII. К хинолиновым алкалоидам иногда
относят также соед., содержащие
кроме хинолина остатки хинуклидина (в
частности, хинин),![]() -карболина
(как в XIV) и др.; однако чаще их выделяют
в отдельный класс алкалоидов,
специфичный для растений определенных
родов, напр. хинного дерева (Cinchona),
селитрянки (Nitraria).
-карболина
(как в XIV) и др.; однако чаще их выделяют
в отдельный класс алкалоидов,
специфичный для растений определенных
родов, напр. хинного дерева (Cinchona),
селитрянки (Nitraria).

Каждой
группе алкалоидов присущи
характерные хим. и спектральные св-ва.
Общие св-ва Л. а., содержащих в положениях
2 или 4 метоксигруппу: а) способность
изомеризоваться при нагр. с СН3I
в N-метил-2(или 4)-хинолоны (напр., IV
изомеризуется в V, VI - в VII); б)
легкость гидролиза(дементирования)
в щелочной или кислой среде, напр., XI (R
= OCH3)![]() XI
(R=OH). Природные и синтетич. четвертичные
хинолиновые алкалоиды припиролизе или
нагревании с безводным пиридином превращаются
в соответствующие третичные основания,
напр. соединение XV в IV.
2-Хинолоны,
напр., 4-метокси-3-пренил-2-хинолон [III; R =
CH3,
R' = СН2СН
= С(СН3)2]
при нагр. с конц. НС1 или НВr в ледяной
СН3СООН
образует трициклические
хинолиновые алкалоиды типа
VII и IX.
Характерная
р-ция фуранохинолиновых алкалоидов (XI)
-гидрогенолиз фуранового кольца с
образованием З-этил-2-хинолоновых
производных (III; R = СН3,
R' = С2Н5).
Для
исследования структуры
хинолиновых алкалоидов используют
спектральные методы. По значению
максимумов поглощения в ЙК и УФ спектрах
и характеру их смещения в зависимости
от рН среды различают не только группы
хинолиновых алкалоидов,
но и иногда положения заместителей.
Mace-спектрометрия позволяет установить
принадлежность алкалоида к
определенной группе и различать такие
близкие изомеры,
как V и VII; VIII и IX. По положению и интегральной
интенсивности полосы поглощения в
области 1610-1665 см-1 ИК
спектра можно различить 2- и 4-хинолоны,
а также изомерные соединения V и VIII, VII
и IX. В большинстве случаев о полной
структуре хинолиновых алкалоидов можно
судить по данным спектров ЯМР1Н
и 13С.
Различные
хинолиновые алкалоиды имеют
разных биогенетич. предшественников.
Так биосинтез хинина и
производных кинуреновой к-ты (I; R = ОН,
R' = СООН) осуществляется из триптофана,
а хинолиновых алкалоидов семейства
рутовых (соед. I-ХIII, XV) - из
антраниловой кислоты.
Хинолиновые алкалоиды обладают
широким спектром физиологич. активности.
Большинство алкалоидов оказывает успокаивающее действие
на центр. нервную систему: нек-рые из
них, напр. флиндерсин (X), проявляют
антифидантные св-ва. В медицине
применяется хинин и эхинопсин (II;
R = CH3,
R' = Н) как стимулятор центр. и периферич.
нервной системы.
XI
(R=OH). Природные и синтетич. четвертичные
хинолиновые алкалоиды припиролизе или
нагревании с безводным пиридином превращаются
в соответствующие третичные основания,
напр. соединение XV в IV.
2-Хинолоны,
напр., 4-метокси-3-пренил-2-хинолон [III; R =
CH3,
R' = СН2СН
= С(СН3)2]
при нагр. с конц. НС1 или НВr в ледяной
СН3СООН
образует трициклические
хинолиновые алкалоиды типа
VII и IX.
Характерная
р-ция фуранохинолиновых алкалоидов (XI)
-гидрогенолиз фуранового кольца с
образованием З-этил-2-хинолоновых
производных (III; R = СН3,
R' = С2Н5).
Для
исследования структуры
хинолиновых алкалоидов используют
спектральные методы. По значению
максимумов поглощения в ЙК и УФ спектрах
и характеру их смещения в зависимости
от рН среды различают не только группы
хинолиновых алкалоидов,
но и иногда положения заместителей.
Mace-спектрометрия позволяет установить
принадлежность алкалоида к
определенной группе и различать такие
близкие изомеры,
как V и VII; VIII и IX. По положению и интегральной
интенсивности полосы поглощения в
области 1610-1665 см-1 ИК
спектра можно различить 2- и 4-хинолоны,
а также изомерные соединения V и VIII, VII
и IX. В большинстве случаев о полной
структуре хинолиновых алкалоидов можно
судить по данным спектров ЯМР1Н
и 13С.
Различные
хинолиновые алкалоиды имеют
разных биогенетич. предшественников.
Так биосинтез хинина и
производных кинуреновой к-ты (I; R = ОН,
R' = СООН) осуществляется из триптофана,
а хинолиновых алкалоидов семейства
рутовых (соед. I-ХIII, XV) - из
антраниловой кислоты.
Хинолиновые алкалоиды обладают
широким спектром физиологич. активности.
Большинство алкалоидов оказывает успокаивающее действие
на центр. нервную систему: нек-рые из
них, напр. флиндерсин (X), проявляют
антифидантные св-ва. В медицине
применяется хинин и эхинопсин (II;
R = CH3,
R' = Н) как стимулятор центр. и периферич.
нервной системы.
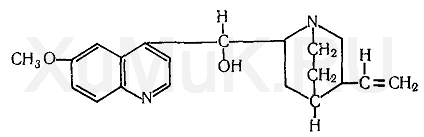
Хини́н (C20H24N2O2) — основной алкалоид коры хинного дерева с сильным горьким вкусом, обладающий жаропонижающим и обезболивающим свойствами, а также выраженным действием против малярийных плазмодиев. Это позволило в течение длительного времени использовать хинин как основное средство лечения малярии. Сегодня с этой целью применяют более эффективные синтетические препараты, но по ряду причин хинин находит своё применение и в настоящее время.
Хинин является алкалоидом, содержащимся в коре различных видов хинного дерева. В этой коре кроме хинина содержится хинидин, цинхонин, цинхонидин и ряд других алкалоидов. В состав молекулы хинина входят хинолиновый и хинуклидиновый циклы, связанные группой атомов — СН — ОН. Хинин является изомером хинидина. В медицинской практике применяются гидрохлорид, дигидрохлорид и сульфат хинина. Основание хининарастворяется в этиловом спирте (1:1), хлороформе (1 : 3), диэтиловом эфире, насыщенном водой (1 :4), слабо растворяется в воде. Гидрохлорид хинина растворяется в этиловом спирте (1:1), хлороформе (1:2), воде (1 : 23), слабо растворяется в диэтиловом эфире. Сульфат хининарастворяется в этиловом спирте (1 :95), слабо растворяется в воде (1 : 810), диэтиловом эфире и хлороформе.
Хинин экстрагируется органическими растворителями из щелочных водных растворов. Максимальные количества хинина экстрагируютсяхлороформом при рН = 9...10.
Применение. Действие на организм. В зависимости от принятой дозы хинина он может вызывать угнетение центральной нервной системы, головную боль, головокружение, нарушение зрения. Хинин возбуждает мускулатуру матки и усиливает ее сокращение. Он так же вызывает сокращение селезенки. Хинин действует на возбудителя малярии и является одним из эффективных противомалярийных лекарственных препаратов. Его применяют при аритмиях. Хинин применяется в акушерской практике для возбуждения и усиления родовой деятельности. При передозировкехинина, применяемого беременными женщинами, может наступить аборт.
Метаболизм. В организме хинин подвергается метаболизму путем окисления хинолинового и хинуклидинового циклов. При этом образуются 2-оксихинин, 2'-оксихинин, диоксихинин. При метаболизме может окисляться винильная группа в молекуле хинина с образованием хинетина. Также может окисляться хинуклидиновый цикл с образованием гемохинной кислоты (6-метокси-хинолин-4-кетокарбоновой кислоты). Метаболиты и незначительная часть несвязанного хинина выводится из организма с мочой.
Обнаружение хинина
Предварительная проба на наличие хинина в моче. В делительную воронку вносят 2 мл мочи, которую подщелачивают раствором аммиака, а затем прибавляют 4 мл хлороформа и взбалтывают в течение 5 мин. От водной фазы отделяют слой органического растворителя, который взбалтывают с 3 мл 10 %-го раствора серной кислоты. Синяя флуоресценция водной фазы указывает на наличие хинина в моче. Флуоресценция становится более выраженной, если кислую водную вытяжку облучать УФ-светом.
Реакции с реактивами группового осаждения алкалоидов. Хинин дает осадки с реактивами Бушарда, Драгендорфа, Майера, Зонненшейна и другими реактивами группового осаждения алкалоидов.
Обнаружение хинина по флуоресценции. Растворы хинина, подкисленные серной кислотой, имеют голубую флуоресценцию. При наличии ионовхлора и некоторых других ионов в растворах флуоресценция хинина ослабляется.
Флуоресценция хинина как двухосновного основания зависит от рН среды. В кислой среде хинин имеет голубую флуоресценцию. В щелочной среде (рН~9) хинин имеет фиолетовую флуоресценцию. Продукты окисления хинина имеют желто-зеленую флуоресценцию.
Выполнение опыта. Исследуемый раствор вносят в фарфоровую чашку и выпаривают досуха. К сухому остатку прибавляют 4—5 мл 0,1 н. растворасерной кислоты. Полученный раствор переносят в пробирку, которую облучают УФ-лучами. При наличии хинина появляется голубая флуоресценцияраствора. От прибавления к этой жидкости нескольких капель 0,1 н. раствора гидроксида натрия интенсивность голубой флуоресценции ослабевает, а затем (при рН~9) появляется фиолетовая флуоресценция.
Если к раствору хинина, подкисленному серной кислотой, прибавить несколько капель бромной воды, разбавленной десятикратным объемом воды(до полного тушения флуоресценции), а затем прибавить несколько капель 25 %-го раствора аммиака до щелочной реакции, то появляется желто-зеленая флуоресценция.
Талейохинная реакция. От прибавления к хинину бромной воды, а затем аммиака образуется зеленого цвета талейохин, который экстрагируетсяхлороформом:
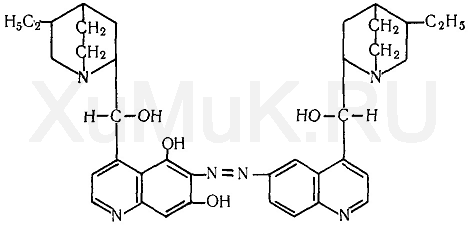
Выполнение реакции. Раствор исследуемого вещества выпаривают досуха. К сухому остатку прибавляют 1 мл воды. К полученному раствору по каплям прибавляют бромную воду (избегая ее избытка) до слабо-желтой окраски. От прибавления нескольких капель раствора аммиака к слабо-желтому раствору появляется ярко-зеленая окраска, которая при нейтральной реакции становится синей, а при добавлении кислоты переходит в красную или фиолетовую. При взбалтывании жидкости, имеющей зеленую окраску, с хлороформом последний приобретает зеленую окраску.
На воспроизводимость реакции влияет концентрация исследуемого вещества, объемы прибавляемых реактивов и т. д. Реакции мешаютамидопирин, антипирин, кофеин и др.
Эритрохинная реакция. Несколько капель исследуемого раствора выпаривают досуха, прибавляют 1 мл воды, слабо подкисленной серной илиуксусной кислотой, каплю бромной воды и каплю 10%-го раствора гексацианоферрата (III) калия. Полученную жидкость хорошо взбалтывают, затем по каплям прибавляют аммиак до щелочной реакции. При наличии хинина в исследуемом растворе появляется розовая или красно-фиолетовая окраска, которая при взбалтывании с хлороформом переходит в хлороформный слой.
Обнаружение хинина методом хроматографии. Для обнаружения хинина применяют метод хроматографии в тонком слое силикагеля. С этой целью используется та же методика, что и для обнаружения морфина (см. гл. V, § 34).
Пятна хинина на хроматограмме имеют розовато-бурую окраску (Rf = 0,39±0,01).
