
- •Часть II. Основы процессов защиты гидросферы от загрязнений
- •Составители: е. С. Гиматова, и. Г. Кобзарь, в. В. Савиных Ульяновск 2004
- •Главные загрязнители воды
- •Приоритетные загрязнители водных экосистем по отраслям промышленности
- •3.1. Фильтрование через плоские перегородки
- •3.2. Фильтрование через объемные перегородки
- •Зависимость значения коэффициентов c и m от режима течения жидкости
- •Параметры и условия процессов обратного осмоса и ультрафильтрации
- •3. Десорбция, дезодорация, дегазация
- •Электрокоагуляция
- •Контрольные вопросы
- •Значения максимальных координационных чисел (молекулярной формы) различных соединений на линии насыщения
- •Температура начала выпадения кристаллов из раствора
- •4.1. Метод жидкофазного окисления
- •4.2. Метод парафазного каталитического окисления
- •4.3. Огневой метод
- •Химические реакции нейтрализации
- •Условия применения способов нейтрализации кислых сточных вод
- •1.1. Смешивание кислых и щелочных вод
- •1.2. Реагентная нейтрализация
- •1.3. Фильтрование через нейтрализующие материалы
- •1.4. Процесс нейтрализации кислыми газами
- •Процессы окисления
- •2.1. Окисление хлором и его соединениями
- •2.2. Пероксид водорода как окислитель
- •2.3. Кислород воздуха как окислитель
- •2.4. Пиролюзит как окислитель Пиролюзит – это природный материал, содержащий MnO2. Очистку проводят фильтрацией через слой этого материала или в аппаратах с мешалкой.
- •2.5. Озонирование
- •Кинетика процессов прямого окисления подчиняется уравнению
- •3. Процессы восстановления
- •Химические методы удаления
- •Данные начала и конца осаждения различных катионов
- •1. Процессы биохимического окисления
- •Влияние различных факторов на скорость
- •3. Анаэробное биохимическое окисление
- •Теоретические основы защиты окружающей среды
- •Часть II. Основы процессов защиты
- •Гидросферы от загрязнений
- •432027, Г. Ульяновск, ул. Сев. Венец, д. 32
3. Десорбция, дезодорация, дегазация
Десорбция [3]
При пропускании воздуха или другого малорастворимого в воде инертного газа (азот, диоксид углерода, дымовые газы) через сточную воду летучий компонент (летучие неорганические и органические примеси, сероводород, диоксид серы, сероуглерод, аммиак, диоксид углерода и др.) из жидкой фазы диффундирует в газовую фазу. Десорбция обусловлена более высоким парциальным давлением газа над раствором, чем в окружающей среде. Равновесное парциальное давление удаляемого газа находят по закону Генри:
pi = Hi xi или yi* = (H/p) xi = K xi , (81)
где pi – парциальное давление i-го компонента в газе при равновесии; Hi – константа Генри i-го компонента, имеющая размерность давления; xi – молярная доля i-го компонента в газовой фазе при равновесии; р – общее давление; К = H/p – безразмерная константа.
Количество вещества М, перешедшего из жидкой фазы в газовую, определяют по уравнению массопередачи
М = КуFcр (82)
где Ку – коэффициент массопередачи (в данном случае он равен коэффициенту массопередачи в газовой фазе у); F – поверхность контакта фаз; cр – средняя движущая сила процесса десорбции.
Степень удаления летучих веществ из сточной воды увеличи-вается с ростом температуры газожидкостной смеси, коэффициента массоотдачи и поверхности контакта фаз. Десорбируемые из воды вещества направляют на адсорбцию или каталитическое сжигание (катализатор – пиролюзит, оксид хрома и др.) при 280350 оС. Боль-шинство органических соединений при этом окисляется до СО2 и Н2О.
Дезодорация [3]
Часто в сточных водах содержится аммиак, сероводород, углеводороды и другие дурнопахнущие вещества. Для удаления их из воды используют различные способы: аэрацию, хлорирование, ректи-фикацию, дистилляцию, окисление кислородом под давлением, озони-рование, экстракцию, адсорбцию.
Наиболее простым и эффективным является метод аэрации, заключающийся в продувании воздуха через слой воды. Иногда дурнопахнущие сточные воды очищают продувкой острым паром в колонне с колпачковыми или сетчатыми тарелками. От сероводорода и метилмеркаптана в этом случае степень очистки достигает 100 %, от других веществ – 90 %.
В промышленности часто используют метод хлорирования дурнопахнущих сточных вод. При этом происходит окисление хлором серосодержащих соединений. Например, при хлорировании воды серо-водородом или метилмеркаптаном реакции идут следующим образом:
в случае недостатка хлора образуется диметилдисульфид с неприятным запахом:
H2S + Cl2 2HCl +S, (83)
2CH3SH + Cl2 2HCl + (CH3)2S2. (84)
при избытке хлора (не менее 600 г на 1 м3) образуются диок-сид серы, хлорид водорода и метансульфонилхлорид
H2S + 3Cl2 + 2H2O SO2 + 6НСl, (85)
CH3SH + 3Cl2 + 2H2O CH3SO2Cl + 5НСl. (86)
Очистку сточных вод от сероводорода окислением кислородом воздуха при атмосферном давлении в присутствии катализатора (железная стружка, графитовые материалы и др.) проводят в аэрационном бассейне, куда подают сжатый воздух. В этом случае реакция может проходить следующим образом [9]:
при недостатке кислорода
2H2S + O2 2H2O + 2S , (87)
при избытке кислорода
2H2S + 3O2 2H2O + 2SO2. (88)
Большая часть сероводорода при этом окисляется до элемен-тарной серы, а другая часть отдувается воздухом. Вода очищается от серы, а воздух с сероводородом и окисью серы поступает на очистку в адсорбер с активным углем. После насыщения уголь регенерируют сульфатом аммония. При окислении продолжительностью 60–90 минут и расходе воздуха 10–12 м3/м3 степень очистки воды достигает 95– 97 %.
Сероводород из воды можно удалить гидроксидом железа по реакциям:
в щелочной среде
2Fe(OH)3 + 3H2S = Fe2S3 + 6H2O, (89)
в нейтральной среде
Fe(OH)2 + H2S = FeS + 2H2O. (90)
Для удаления запахов из сточных вод могут быть использованы процессы озонирования и адсорбции. Однако более эффективно проис-ходит очистка при одновременном введении в воду озона или диоксида хлора (ClО2) и фильтровании воды через слой активного угля. Наилуч-шие результаты очистки получены при следующих соотношениях: для сероводорода – О3/Н2S > 5; для метилмеркаптана О3/СН3SН10; для диметилсульфида – О3/(СН3)2S = 4–6. Степень дезодорации указанных веществ в этих условиях зависит от их концентрации в сточной воде и изменяется от 80 до 100 %. Доза озона в этом случае снижается по сравнению с просто озонированием. Применение диоксида хлора вместо озона при тех же соотношениях обеспечивает степень дезодорации на 90–100 %.
Дегазация [3, 9]
Присутствие в сточных водах растворенных газов затрудняет очистку и использование сточных вод, усиливает коррозию трубопро-водов и аппаратуры, придает воде неприятный запах. Растворенные газы из воды удаляют дегазацией, которую осуществляют химичес-кими, термическими и десорбционными (аэрационными) методами. Часто возникает необходимость удаления из воды диоксида углерода, аммиака, кислорода.
Для удаления из воды диоксида углерода используют методы аэрации, проводимые в пленочных, насадочных, барботажных и вакуумных дегазаторах. Пленочные дегазаторы – колонны с различ-ного вида насадками, работающие в условиях противотока дегази-руемой воды и воздуха, подаваемого вентилятором.
Вакуумные дегазаторы насадочные колонны, работающие под вакуумом, в которых вода равномерно распределяется по поверхности насадки. Наиболее полная дегазация достигается при разбрызгивании в вакууме и одновременном подогреве воды. Воду нагревают паром в котле. Пар из змеевика попадает в теплообменник, где вода подогре-вается. Вакуум создают отсасыванием парогазовой среды насосом.
При термической дегазации воды от растворенного диоксида углерода или кислорода пропускают пар через воду и нагревают ее до температуры кипения при внешнем давлении. В этом случае парциаль-ное давление газа над водой снижается до нуля и растворимость его также падает до нуля. Вследствие нарушения равновесия в системе происходит выделение избыточных газов из воды (физическая десорбция).
Аммиак из сточных вод удаляют продувкой водяным паром или воздухом. Ионы аммония в воде находятся в равновесном состоянии с аммиаком и ионами водорода (NH4+ NH3 + H+). При рН=7 в воде могут находиться ионы аммония в истинном растворе; при рН=12 – только растворенный аммиак, который можно выделить из воды.
Скорость перехода газообразного аммиака из воды в атмосферу зависит от поверхностного натяжения на границе двух фаз (воздух-вода) и от разности концентраций аммиака в воде и воздухе. Для осуществления процесса отдувки аммиака из воды повышают рН воды до значений 10,8–11,5 и создают большую поверхность контакта между воздухом или паром и водой.
Химические методы дегазации применяют при низкой концент-рации газов в воде или в случае нецелесообразности их использования, а также при условии, что продукты обработки не затрудняют дальнейшую очистку или использование воды.
Методы связаны с проведением реакций, в результате которых происходит химическое связывание растворимых газов.
Для удаления кислорода из воды ее фильтруют через легкоокисляющиеся стальные стружки. Содержание марганца в них не должно превышать 0,3 %. При фильтровании воды железо окисляется
4Fe +3O2 = 2Fe2O3 . (91)
Время контактирования зависит от температуры и при 20–80 оС равно 25–30 минут. Образовавшиеся оксиды железа удаляют обратной промывкой.
При обработке воды сульфитом натрия образуется сульфат натрия
2Na2SO3 + O2 = 2Na2SO4 . (92)
На 1 г О2 необходимо затратить 7,88 г Na2SO3.
При обработке воды диоксидом серы в присутствии катализатора имеют место следующие реакции:
SO2 + H2O = H2SO3, 2H2SO3 + O2 = 2H2SO4 . (93)
В качестве катализатора используют соли меди (1 мг/л Cu2+) или кобальта (0,001 мг/л Cо2+) в виде 0,01 %-ных растворов. Для удаления 1 г О2 расходуется 4 г SO2.
Лучшим обескислороживающим воду реагентом является гидразин:
О2 + N2H4 N2 + 2H2O. (94)
Реакция протекает значительно быстрее, чем при окислении сульфита натрия (Na2SO3). Катализатором служит металлическая медь, стекло, активный уголь. На 1 г О2 требуется 1 г N2H4.
Контрольные вопросы
Объясните сущность процесса ионного обмена.
Назовите основные свойства ионитов и примеры обменных реакций.
Охарактеризуйте основные стадии процесса переноса вещества при ионном обмене.
Напишите уравнения основных количественных критериев для определения стадии, лимитирующей скорость ионообменного процесса.
Напишите уравнения кинетики ионного обмена и ионного равновесия.
Объясните сущность процессов очистки воды обратным осмосом и ультрафильтрацией.
Назовите основные требования к мембранам.
Объясните физическую сущность процесса удаления летучих компонентов из жидкости методом десорбции.
Объясните физическую сущность удаления летучих вредных примесей из жидкости методом дезодорации: использование способов аэрации, хлорирования, окисления, адсорбции.
Объясните сущность процессов дегазации сточных вод с использованием химических, термических и десорбционных (аэрация) методов.
Лекция 6. Электрохимические явления, используемые
в технологии очистки вод
При пропускании электрического тока через какой-либо раствор можно наблюдать следующие электрохимические процессы:
анодное окисление и катодное восстановление;
электролиз воды;
электрофорез;
электрокоагуляция;
электрофлотация;
электродиализ.
Все эти процессы используются в технологии очистки сточных вод без применения химических реактивов.
1. АНОДНОЕ ОКИСЛЕНИЕ И КАТОДНОЕ ВОССТАНОВЛЕНИЕ [3, 9]
При пропускании через раствор постоянного электрического тока ионы примесей начинают перемещаться в растворе по двум противоположным направлениям: положительно заряженные ионы направляются к отрицательно заряженному электроду – катоду; отрицательные ионы, наоборот, направляются к положительному электроду – аноду (рис. 10).
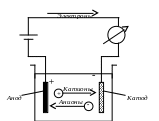
Рис. 10. Электролитическая ячейка
Ионы, перемещающиеся к катоду, называются катионами, а перемещающиеся к аноду – анионами.
Химический процесс, происходящий в растворе при пропуска-нии электрического тока, называется электролизом. Исследуя продук-ты, выделяющиеся на электродах при электролизе водных растворов кислот, оснований или солей, установлено:
на катоде ионы присоединяют электроны (т. е. происходит реакция восстановления) и выделяются металлы или водород;
на аноде ионы отдают электроны (т. е. протекает реакция электрохимического окисления) и выделяются кислотные остатки или гидроксильные группы.
Например, при электролизе хлорида меди с использованием нерастворимых электродов протекают следующие реакции:
на катоде: Cu2+ + 2e Cu (95)
на аноде: 2Cl 2Cl + 2e (2Cl Cl2) (96)
 Суммарная
реакция: Сu2+
+ 2Cl
электролиз
Cu + Cl2
. (97)
Суммарная
реакция: Сu2+
+ 2Cl
электролиз
Cu + Cl2
. (97)
При этом на катоде осаждается металлическая медь, а на аноде выделяется газообразный хлор.
В случае электролиза концентрированного раствора соляной кислоты или разбавленного водного раствора серной кислоты на электродах выделяются газообразные элементы. Реакции имеют вид:
а) при электролизе соляной кислоты:
на катоде: H+ + e H (2H H2) (98)
на аноде: Cl Cl + e (2Cl Cl2 ) (99)
 Суммарная
реакция: H+
+ Cl
электролиз
1/2
H2
+ 1/2Сl2
;
(100)
Суммарная
реакция: H+
+ Cl
электролиз
1/2
H2
+ 1/2Сl2
;
(100)
б) при электролизе серной кислоты анионы SO42- принимают участие в переносе тока, но они не разряжаются на аноде. Вместо них разряжаются анионы ОН- воды и выделяется кислород О2. Оставшиеся в растворе ионы Н+ воды образуют с ионами SO42- кислоту H2SO4. На электродах протекают реакции:
на катоде: H+ + e H (2H H2) (101)
на аноде: OH e + OH (2OH H2O + 1/2O2) (102)
Суммарная реакция: H+ + OH– электролиз H2 + 1/2O2 . (103)
Таким образом, при электролизе на аноде могут образовываться пузырьки газообразных элементов − кислорода или других газов, а на катоде – водорода.
Когда анодом является легко ионизирующийся металл, т. е. металл, легко отдающий электроны, атомы анода превращаются в ионы, и анод растворяется. Рассмотрим процесс анодного растворения на примере электролитической ячейки с анодом из железа. В щелочной среде реакция проходит в две стадии [3]:
+
OH
e
HFeO2-+H+
HFeO2
+ H+

.
+
OH
2e
HFeO2-+H+
На первой стадии происходит потеря электронов и образуются промежуточные кислородсодержащие соединения одновалентного железа, которое сорбируется на железном электроде. На второй стадии реакция протекает по двум возможным направлениям и заканчивается образованием двух- или трехвалентного железа. Общая скорость процесса анодного растворения лимитируется второй стадией.
Процесс анодного растворения в кислой среде протекает более сложно
Fe + OH – e Fe(OH)адс , Fe(OH)адс + Fe Fe(FeOH)адс , (105)
Fe(FeOH)адс + OH – 2e Fe(OH)адс + Fe(OH+), (106)
Fe(OH+) + H+ Fe2+ + H2O. (107)
Лимитирующей стадией является предпоследняя реакция. Скорость электрохимического растворения металла I определяется величиной тока, которая зависит от приложенного напряжения (потенциала анода ):
I = k[OH]2 exp{[(2 + 1)/RT] nF}, (108)
где k, – постоянные процесса; R – универсальная газовая постоянная; Т – абсолютная температура; n – число электронов, участвующих в процессе; F – число Фарадея (F = 96500 Кл).
Процессы анодного окисления используют также для обесцве-чивания сточных вод от красителей и для очистки вод целлюлозно-бу-мажных, нефтеперерабатывающих, нефтехимических и других заводов.
2. ЭЛЕКТРОКОАГУЛЯЦИЯ И ЭЛЕКТРОФЛОТАЦИЯ [3]
