
- •Часть III. Основы процессов переработки твердых промышленных и бытовых отходов
- •1. Уменьшение размеров кусков
- •2. Классификация и сортировка твердых отходов
- •3. Процессы механического обезвоживания осадков промышленных сточных вод
- •Лекция 3. Механотермические процессы обработки твердых отходов
- •3. Смешение порошкообразных и пастообразных материалов
- •1. Гравитационные методы
- •Лекция 8. Процессы и методы обработки осадков сточных вод
- •ЧастьIii. Основы процессов переработки твердых промышленных и бытовых отходов
- •432027, Г. Ульяновск, ул. Сев. Венец, д. 32
3. Смешение порошкообразных и пастообразных материалов
Метод смешения используют при переработке ТО для усреднения состава дисперсных материалов, приготовления на их основе многокомпонентных шихтовых смесей и получения различных масс для переработки их в товарные продукты. Смесительные механизмы используют различные способы механического, гравитационного или пневматического перемешивания частиц материалов. Наибольшее распространение среди смесителей периодического действия получили смесители барабанные, бегунковые, пневматические, циркуляционные и червячно-лопастные, а непрерывного действия – барабанные, вибрационные, гравитационные, лопастные, центробежные и др.
Процессы смешения обычно характеризуются степенью однородности или коэффициентом неоднородности, интенсивностью и эффективностью.
Степень однородности смешения i характеризует взаимное распределение веществ в результате реализации процесса
i = (C1+C2+...Cn)/n, (36)
где C1,C2,...,Cn - относительные концентрации одного из веществ в пробах, вычисляемые по отношениям: Сi = ei /e0 для e < e0; Сi= (1-ei)/ (1-eo) для ei > e0; где, ei, e0 - объемные доли этого вещества в i-й пробе и в аппарате соответственно.
Коэффициент неоднородности двухкомпонентной смеси:
Кс
= 100/Сo∙ ,
(37)
,
(37)
где Сi, Co - концентрация вещества соответственно в пробах и в аппарате, %; ni и n - число проб соответственно в каждой группе одинаковых значений и общее; i = n/ni - число групп проб.
Интенсивность смешения, выражаемая скоростью изменения степени смешения, наиболее точно оценивается отношением мощности N, затрачиваемой на перемешивание, к единице объема V смеси:
di/dt » N/V. (38)
Эффективность процесса может быть оценена количеством энергии, необходимой для достижения заданной величины i (или Кс).
Контрольные вопросы
Сущность метода гранулирования и основные технические характеристики процесса грануляции.
Характеристика метода брикетирования, производительность прессов.
Сущность метода смешения порошкообразных и пастообразных материалов.
Основные характеристики процесса смешения.
Лекция 4. Процессы термической обработки
твердых отходов
1. ВЫСОКОТЕМПЕРАТУРНАЯ АГЛОМЕРАЦИЯ И ТЕМПЕРАТУРНАЯ ОБРАБОТКА [1]
При переработке пыли, окалины, шламов, огарков и других дисперсных твердых отходов используют методы высокотемпературной агломерации и термической обработки. Метод высокотемпературной агломерации включает следующие технологические операции:
- приготовление шихты, содержащей твердое топливо (6- 7 % мас. коксовой мелочи) и различные примеси (руда, концентрат, флюсы и т. п.);
- усреднение шихты и ее увлажнение до 5-8 %;
- размещение шихты слоем на решетках движущихся обжиговых тележек (палет) агломерационной машины;
- пропускание через слой шихты раскаленных продуктов сжигания газообразного или жидкого топлива и воздуха для воспламенения и нагрева шихты;
- процесс спекания минеральных компонентов шихты проводят при температуре горения ее твердого топлива в интервале 1100- 1600 оС;
- дробление спеченного агломерата до крупности 100-150 мм в валковых зубчатых дробилках и грохочение его с выделением фракции – 8 мм, которую возвращают на повторную агломерацию;
- удаление (под разрежением 7-10 кПа) и очистка агломерационных газов, содержащих вредные примеси СО, SO2, NO2 .
Примером использования высокотемпературной агломерации является обработка пиритных огарков перед направлением их в доменную плавку. Пиритные огарки образуются при получении серной кислоты из серного колчедана и содержат 40-63 % железа, примеси в виде серы (до 2 %), меди, цинка, золота, свинца и др. Отходы пиритных огарков при обжиге серного колчедана составляют примерно 70 % от массы колчедана. Поэтому утилизация пиритных огарков с целью извлечения железа и цветных металлов является выгодной с экономической точки зрения.
При использовании пиритных огарков в доменной плавке необходимо удалить из огарка серу и провести его окускование. Наиболее распространенным процессом в этом случае является высокотемпературная агломерационная обработка огарка, в результате приводящая к выгоранию в нем серы и получению кускового материала, пригодного для доменной плавки. Самый распространенный способ агломерации основан на пропускании воздуха через слой спекаемой шихты на колосниковой решетке. На агломерацию в этом случае поступает шихта из пиритных огарков и топлива (кокса или угля). Шихту поджигают сверху в так называемой запальной камере. Под палетами с горящей шихтой имеются специальные камеры, в которых поддерживается разрежение. Поэтому процесс горения при медленном перемещении палет над вакуум-камерами развивается по направлению сверху вниз. Газообразные продукты горения отводят из машины через вакуум-камеры. Под действием развивающейся в процессе горения шихты высокой температуры огарковая мелочь спекается и одновременно выгорает сера. При опрокидывании палет спекшийся огарок сбрасывается с агломашины на грохот. Мелочь после грохочения возвращается снова на агломерацию. Крупные куски, являющиеся готовым продуктом, подают на охлаждение и затем подмешивают к агломерированной шихте для доменной плавки.
2. СУШКА ТВЕРДЫХ И ПАСТООБРАЗНЫХ ОТХОДОВ [2]
Сушка представляет собой процесс удаления влаги из твердого или пастообразного материала путем испарения содержащейся в нем жидкости за счет подведенного к материалу тепла. Это термический процесс, требующий значительных затрат тепла.
Сушка широко применяется в химической, химико-фармацевти-ческой, пищевой и других отраслях промышленности. Относительно широкое распространение сушка получила в области обработки осадка городских сточных вод (барабанные сушилки, сушка во встречных струях). Процессы термического удаления той части влаги, которую невозможно удалить механическим путем, могут также найти применение при обработке промышленных отходов, которые необходимо подготовить к транспортированию и дальнейшей переработке (например, гальванические шламы); а также при обработке некоторых отходов химической, пищевой и других отраслей промышленности. Сушка осуществляется конвективным, контактным, радиационным и комбинированными способами.
Метод сушки выбирают на основе технологических требований к высушиваемому продукту и с учетом технико-экономических показателей. Процесс сушки осуществляется за счет тепловой энергии, вырабатываемой в генераторе тепла. Генератором тепла могут служить паровые или газовые калориферы и топки, работающие на твердом, жидком или газообразном топливе, инфракрасные излучатели и генераторы электрического тока. Выбор генератора тепла обычно определяется схемой и методом сушки, физическими свойствами высушиваемого материала и требуемым режимом сушки при возможности целесообразно использовать тепло отходящих газов или отработанного пара. В этом случае одновременно утилизируются и тепловые отходы.
Конвективная сушка воздухом или газом является наиболее распространенной. При воздушной сушке, так же как и при газовой, тепло передается от теплоносителя непосредственно высушиваемому веществу. Для получения материала необходимого качества особое внимание должно уделяться технологическому режиму сушки, правильному выбору параметров теплоносителя и режиму процесса (выбор оптимальной температуры нагрева материала, его влажности и т. д.). Оптимальный режим сушки, влияющий на технологические свойства материала, зависит от связи влаги с материалом.
Физическая сущность сушильного процесса заключается в следующем: движущей силой процесса удаления влаги из материала является разность парциальных давлений паров Dр над материалом (рпм) и в окружающей воздушной или газовой среде (рпв):
Dр = рпм - рпв. (39)
При Dр = 0 наступает равновесие, и сушка прекращается. Если рпв > рпм, то происходит противоположный процесс - увлажнение материала. По мере удаления влаги с поверхности материала за счет разности концентрации влаги внутри материала и на его поверхности, происходит движение воды к поверхности путем диффузии. В некоторых случаях имеет место так называемая термодиффузия, когда движение влаги внутри материала происходит за счет уменьшения разности температур на поверхности и внутри материала.
Сушка - процесс тепломассообменный. Удаление влаги с поверхности тесно связано с продвижением ее изнутри к поверхности. Сушка отличается от выпаривания тем, что в первом случае удаление влаги происходит при любой температуре, если Dр = рпм - рпв, во втором - если давление образующихся паров равно давлению окружающей среды (например, кипение воды происходит при давлении, равном барометрическому). Выпаривание происходит из всей массы жидкости, при сушке же влага удаляется с поверхности высушиваемого материала. Выпаривание - более интенсивный процесс, чем сушка, однако не все материалы можно подвергать выпариванию. Так, влага из твердых материалов удаляется только тепловой сушкой.
Критериями выбора типов сушилок для обработки отходов являются их исходные свойства (консистенция, влажность, гранулометрический состав, токсичность, пожаровзрывоопасность и т. д.), требования, предъявляемые к конечному продукту (физико-химические и ме-ханические свойства), вопросы технологии, стоимостные показатели.
3. ПРОЦЕССЫ ТЕРМИЧЕСКОЙ ОБРАБОТКИ ШЛАМА ХИМВОДООЧИСТКИ [3,4]
Образование в котлах и теплообменных аппаратах отложений, нарушающих их нормальную работу, приводит к необходимости производить периодическую чистку, что сопряжено с вынужденными длительными простоями оборудования, большими трудзатратами и повышенным износом труб котлоагрегатов от технологической окалины, продуктов коррозии и накипи. Основной причиной образования накипи на поверхностях теплообменного оборудования является жесткость используемой в качестве теплоносителя воды. Жесткость воды обусловлена наличием в ней различных солей, в основном солей кальция и магния. В технике процесс, приводящий к понижению жесткости воды, т. е. к уменьшению концентрации солей кальция и магния, называют умягчением воды. Существует несколько способов умягчения воды: нагревание воды, реагентный метод, метод ионного обмена и др.
Термическое умягчение воды методом нагревания основано на сдвиге углекислотного равновесия в сторону образования карбоната кальция [3]:
Са(НСО3)2 Û СаСО3 + СО2 + Н2О (40)
¯
Смещение равновесия происходит в результате понижения растворимости углекислого газа при повышении температуры. Кипячением можно полностью удалить углекислый газ и, следовательно, намного снизить карбонатно-кальциевую жесткость. Однако полностью устранить указанную жесткость не удается, так как карбонат кальция, хотя и незначительно (13 мг/л при t =18 °С), но растворим в воде.
При наличии в воде бикарбоната магния процесс перехода его в осадок происходит следующим образом: вначале образуется сравнительно хорошо растворимый (10 мг/л при t =18 °С) карбонат магния [3]:
Мg(НСО3)2 Û МgСО3 + СО2+ Н2О. (41)
¯
Эта соль при продолжительном кипячении подвергается гидролизу, в результате которого выпадает осадок малорастворимой (8,4 мг/л) гидроокиси магния
МgСО3 + Н2О Û Мg (ОН)2 + СО2 (42)
¯
Таким образом, при кипячении воды жесткость, обусловленная наличием бикарбонатов кальция и магния, значительно снижается.
Кипячением устраняется и часть жесткости, обусловленной наличием сульфата кальция, растворимость которого падает до 0,65 г/л при температуре 100 °С. Для более глубокого умягчения воды применяют реагентные методы.
В качестве реагентов для умягчения воды используют известь, кальцинированную соду, едкий натр, гидроокись бария и др. Одним из наиболее дешевых реагентов является известь (оксид кальция). Известь при умягчении воды чаще всего применяют в виде известкового молока, а на установках малой производительности - в виде насыщенного раствора извести, который приготовляют в специальных сатураторах.
Известковое молоко получают в результате гашения твердой извести водой:
СаО + Н2О ® Са(ОН)2 (43)
(известь) (известковое молоко)
Процесс умягчения воды известкованием основан на реакции:
Са(ОН)2 + Са(НСО3)2 = 2СаСО3 + 2Н2О (44)
¯
Более широкое распространение получил известково-содовый способ умягчения воды благодаря более широким границам его применимости. При этом происходит осаждение и магния в виде Мg(ОН)2, и устраняется жесткость некарбонатная. Например, осаждение магния:
Мg(HСО3)2 + Са(ОН)2 = СаСО3 + МgСО3 + 2Н2О, (45)
¯ ¯
далее, при избытке извести, карбонат магния взаимодействует с ней, образуя гидроокись магния, выпадающую в осадок:
МgСО3 + Са(ОН)2 = СаСО3 + Мg (ОН)2 , (46)
¯ ¯
или удаление некарбонатной жесткости с использованием кальцинированной соды:
СаSO4 + NaCO3 = СаСО3 + Na2SO4 (47)
¯
MgSO4 + NaCO3 = MgСО3 + Na2SO4 и др. (48)
¯
Для улучшения осаждения взвесей и очистки воды от коллоидных примесей применяют метод коагуляции. В качестве коагулянтов наиболее часто используют железный купорос FeSO4·7H2O или Al2(SO4)3. В результате после обработки воды на всех энергоустановках образуется большое количество шлама, состоящего в основном из СаСО3 (неактивная известь - карбонат кальция) и MgCO3 с примесями Fe(ОН)3, Mg(OH)2, СаSO4, Ca(OH)2 и адсорбированных минеральных взвесей. Образующийся шлам в виде шламовой воды в соответствии с технологией размещается на длительное хранение в специальные сооружения - шламохранилища. Площадь земель, отводимых под такие шламохранилища, может достигать несколько десятков тысяч квадратных метров и более. Шламохранилища остаются потенциально опасными объектами, и размещение в них шламовых вод можно рассматривать лишь как временную меру до появления возможности их переработки и повторного использования.
Известно несколько способов повторного использования шламов:
внесение в почву в качестве удобрения и средства понижения ее кислотности;
использование в процессах сероулавливания на установках ТЭЦ;
регенерация извести для ТЭЦ;
в качестве наполнителя при производстве строительных материалов.
Если в первом и втором случаях необходимы дополнительные исследования, чтобы убедиться в экологической безопасности и экономической целесообразности способов, то в отношении последних двух способов уже имеются определенные наработки. Так, в случае применения способа умягчения воды известкованием основная масса шлама будет приходиться на долю известняка CaCO3. При температуре 800-1100 °С известняк разлагается на известь и двуокись углерода [5]:
СаСО3 ® СаО + СО2 (49)
Регенерация извести таким способом потребует предварительной сушки шлама (150-350 °С) и последующего обжига в шахтной циклонно-вихревой печи при температуре 900-1200 °С. Производительность печи по извести составляет около 0,5 т/ч (45 % активности СаО).
В случае образования шлама смешанного состава (СаСО3, MgCO3 и другие компоненты) после предварительной его сушки и последующего обжига при температуре 800-1000 °С возможно получение продукта, характеризующегося содержанием активных СаО и MgO ³ 40 %, что позволит использовать его в качестве бесцементного вяжущего для замены цемента при формовке строительных изделий, приготовлении тампонажных материалов и др.
Контрольные вопросы
Сущность метода высокотемпературной агломерации и термической обработки твердых пылеобразных промышленных отходов.
Физическая сущность процесса сушки твердых и пастообразных ТО.
Особенности образования, поведения и необходимость удаления нерастворимых примесей солей жесткости.
Способы утилизации шламов, образующихся при процессах умягчения воды.
Лекция 5. Процессы сжигания твердых отходов
1. ХАРАКТЕРИСТИКА ПРОЦЕССА ГОРЕНИЯ [6]
В обычных условиях горение представляет собой процесс окисления или соединения горючего вещества и кислорода воздуха. Наибольшая скорость горения наблюдается в чистом кислороде, наименьшая - при содержании в воздухе 14-15 % кислорода. Горение веществ происходит тем быстрее, чем больше их удельная поверхность; при хорошем перемешивании горючего вещества и кислорода (окислителя) скорость горения увеличивается. Для возникновения и развития процесса горения необходимы: горючее, окислитель и источник поджигания. При отсутствии любого из этих условий горение прекращается. При недостатке кислорода горение является неполным, обычно образуются едкие, ядовитые, горючие и взрывоопасные продукты.
Необходимое для сгорания 1 кг вещества ориентировочное количество воздуха (в м3) можно рассчитать по формуле
Vo
=
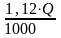 ,
(50)
,
(50)
где Q - теплотворная способность горючего, ккал/кг.
Теплотворная способность твердых веществ (и жидкостей) определяется по формуле (ккал/кг)
Q
=
 ,
(51)
,
(51)
где М- молекулярный вес вещества; Qгор- теплота сгорания, ккал/моль.
Теплотворную способность каменного угля, торфа, нефти можно оценить по формуле Д. И. Менделеева:
Q = 81∙C + 300∙H + 26∙(Sл - О), (52)
где С, Н, Sл - содержание углерода, водорода и серы летучей, соответственно, %; О - суммарное содержание кислорода и азота, %.
Различают беспламенное горение твердых веществ (кокс, сажа, древесный уголь, щелочные и щелочноземельные металлы) и горение с образованием пламени (древесина, торф и т. п.). В случае беспламенного (гетерогенное) горения окисление происходит на поверхности раздела фаз (твердое вещество и парообразная фаза его составляющих); при этом концентрация реагирующих веществ в пограничном слое уменьшается, а концентрация продуктов сгорания увеличивается. Скорость горения данного вещества зависит от температуры, давления, величины удельной поверхности вещества, скорости диффузии кислорода через пограничный слой и скорости окислительных реакций.
При горении щелочных металлов: калия, натрия, магния, кальция и других элементов образующиеся окислы остаются на поверхности расплавленного металла и представляют собой пористую массу. Одновременно образуются густые белые облака окислов этих металлов. По мере горения жидкий металл, поднимаясь по капиллярам пористой массы, пропитывает ее и окисляется при выходе на поверхность этой массы. У поверхности горящего металла температура достигает 1100-1500 °С, а окислы создают светящийся ореол, похожий на пламя. В действительности горение этих металлов происходит в тонком слое паров над поверхностью жидкой массы. Частично окисление происходит на самой поверхности.
Процесс горения любого органического вещества требует:
достаточного времени для развития и завершения химических реакций;
достаточной температуры для нагрева горючей массы до последовательных стадий разложения и загорания углерода и водорода;
достаточного количества и хорошего перемешивания кислорода с горючими элементами для обеспечения полноты сгорания;
При сжигании топлива или твердых отходов, содержащих органические вещества, образуются различные соединения, которые могут быть безвредными или токсичными.
Основные окислительно-восстановительные реакции процесса горения органического топлива или твердых горючих отходов следующие:

 C + O2
=
CO2
+
тепло
C + O2
=
CO2
+
тепло
C + 1/2O2 = CO + тепло
C + CO2 = 2CO - тепло
C + H2O = CO + H2 - тепло
C + 2 H2O = CO2 + 2H2 - тепло
C + 2H2 = CH4 - тепло
 CO + 1/2O2
=
CO2
+
тепло
CO + 1/2O2
=
CO2
+
тепло
 H
+ 1/2O2
=
H2O
+ тепло
(53)
H
+ 1/2O2
=
H2O
+ тепло
(53)
 H2
+
1/2O = H2O
+ тепло
H2
+
1/2O = H2O
+ тепло
CH4 + 2O2 = CO2 + 2H2O + тепло
CO + H2O = CO2 + H2 + тепло
C2H4 + 3O2 = 2CO2 + 2H2O + тепло
S + O2 = SO2 + тепло
H2S + 3/2O2 = H2O + SO2 + тепло
 H2
+ 2Cl = 2HCl + тепло
H2
+ 2Cl = 2HCl + тепло
H2 + 2F = 2HF + тепло
В начале нагревания угля или твердых отходов, содержащих серу, происходит испарение органических и частично неорганических соединений, причем образуются Н2S, CS2, COS и другие сложные соединения с серой. Механизм сгорания этих компонентов хорошо изучен. При сжигании СОS образуются окислы СO, SO2 и СО2. Продуктами сжигания H2S и CS2 является вода, окислы СО, SO2. Сжигание отходов пластмассового производства может привести к образованию коррозионно-активных и токсичных хлористых соединений, окислов азота и других веществ. Аналогично сжигание мусора или других отходов на воздухе чаще всего происходит при неполном сгорании органического вещества и поступлении в атмосферу химически вредных веществ.
2. ПРОЦЕССЫ ПРОКАЛИВАНИЯ, ПИРОЛИЗА И ГАЗИФИКАЦИИ ОТХОДОВ [1,2]
Прокаливание представляет собой сжигание отходов, осуществляемое с целью уменьшения объема и массы реагирующих компонентов. При этом имеет место сушка отходов (удаление влаги), сжигание их органической части и окисление минеральных веществ. Таким образом, в процессе прокаливания образуется достаточно большое количество различных отходов: зола, шлак, дымовые газы, летучая зола (аэрозоли), сточные воды. Кроме того процесс требует больших затрат электроэнергии на его осуществление. Поэтому прокаливание не является лучшим методом ликвидации твердых органических отходов.
Метод прокаливания и обжига нашел применение при обра-ботке шлаков цветной металлургии, пиритных огарков, гальваношламов и др.
Пиролиз (иногда называемый деструктивной перегонкой) представляет собой процесс разложения органических примесей под действием температур в отсутствие или при недостатке кислорода. Он характеризуется протеканием реакций взаимодействия и уплотнения образующихся компонентов, в результате чего происходит расщепление органической массы, рекомбинация продуктов расщепления с получением термодинамически стабильных веществ: твердого осадка, смол, газа. В результате пиролиза происходит распад органического материала и синтез новых продуктов. Обе стадии процесса взаимно связаны и протекают одновременно с той лишь разницей, что отдельно каждая стадия может превалировать в определенные промежутки времени и температуры.
Общую схему пиролиза можно представить следующим образом:
твердые отходы+Q® твердый остаток+жидкие продукты+газы ± Qi, (54)
где Q - дополнительное тепло, Qi - вторичное тепло.
Следует отличать пиролиз от близкого к нему процесса газификации. Газификация является термохимическим высокотемпературным процессом взаимодействия органической массы или продуктов ее термической переработки с газифицирующими агентами, в результате чего органическая часть или продукты ее термической переработки обращаются в горючие газы. В качестве газифицирующих агентов применяют воздух, водяной пар, диоксид углерода, а также их смеси.
Процессы пиролиза отходов получили большее распространение, чем газификация. Пиролизу подвергаются твердые бытовые и близкие к ним по составу промышленные отходы, отходы пластмасс, резины (в том числе, автомобильные покрышки), другие органические отходы.
Относительно защиты окружающей среды процесс пиролиза обладает лучшими показателями по сравнению с сжиганием. Количество отходящих газов, подвергаемых очистке, намного меньше, чем при сжигании отходов. Объем твердого остатка, получаемого по схеме высокотемпературного пиролиза, может быть значительно уменьшен. Твердый остаток можно использовать в промышленности (сажа, активированный уголь и др.). Таким образом, некоторые схемы пиролиза отходов могут быть безотходными.
Высокотемпературный пиролиз по сравнению с другими методами имеет ряд преимуществ: при нем происходит более интенсивное преобразование исходного продукта, скорость реакций с увеличением температуры возрастает по экспоненте, в то время как тепловые потери возрастают линейно, увеличивается время теплового воздействия на отходы, происходит более полный выход летучих продуктов, сокращается количество остатка после окончания процесса.
Контрольные вопросы
Дайте характеристику процесса горения твердых материалов.
Назовите основные требования для обеспечения процесса горения.
Назовите основные окислительно-восстановительные реакции процесса горения твердых материалов.
Назовите особенности процессов прокаливания и обжига, их недостатки.
Физическая сущность процессов пиролиза и газификации при обработке твердых отходов.
Лекция 6. Процессы обогащения при переработке
твердых отходов
В практике рекуперации твердых промышленных отходов используют различные методы обогащения перерабатываемых материалов, подразделяемые на гравитационные, магнитные, электрические, флотационные и специальные.
