
Лекции по курсу патологической физиологии 2004-2005 г. VI семестр. Лекции проф. В.Т. Долгих.
Тема: Основные этапы развития отечественной патофизиологии.
История возникновения и развития отечественной патофизиологии неразрывно связана с именем замечательного русского ученого, профессора Виктора Васильевича Пашутина, которого по праву считают одним из основоположников патофизиологии как науки и учебной дисциплины в России. Поэтому выделяют «допашутинский» и «послепашутинский» периоды в истории отечественной общей патологии и патологической физиологии.
«Допашутинский» период начинается с 30-х годов XVIII столетия, когда начинают открываться российские университеты, и продолжается до 1874 года – года открытия В.В. Пашутиным первой в России кафедры общей и экспериментальной патологии в Казанском университете. На этом этапе патофизиология (общая патология) как самостоятельная наука и учебная дисциплина не существовала. Вопросы общей патологии и патологической физиологии изучали на курсах и кафедрах патологической анатомии, физиологии, терапии. Так, в Московском университете общую патологию преподавали терапевты и патологи.
С открытием в 1874 году в Казанском университете первой в России кафедры общей и экспериментальной патологии начинается второй период в развитии отечественной патофизиологии – «послепашутинский». В России создаются патофизиологические школы.
В.В. Пашутин (1845-1901) – один из основоположников патологической физиологии в России, почетный член Лондонского королевского общества, ученик И.М. Сеченова и С.П. Боткина. Он создал первую в России кафедру патофизиологии при Казанском университете в 1874 году, а через 5 лет открыл аналогичную кафедру в Военно-медицинской академии, кардинально переработав курс общей патологии в новом экспериментально-физиологическом направлении. Основные труды Виктора Васильевича посвящены разработке фундаментальных проблем голодания, обмена веществ, теплообмена и кислородной недостаточности. Им написан и издан двухтомник «Лекции по общей патологии (патологической физиологии)».
А.В. Репрев (1853-1903) – отечественный патолог, один из родоначальников отечественной эндокринологии. Научные работы Александра Васильевича посвящены обмену веществ при лихорадке, опухолях, беременности, рентгеновском облучении. Его фундаментальное руководство «Основы общей и экспериментальной патологии» (1908) способствовало выделению патофизиологии в самостоятельную отрасль медицины.
А.А. Богомольцев (1881-1946) – отечественный патофизиолог и общественный деятель, академик АН и АМН СССР, Герой Социалистического Труда, Лауреат Государственной премии СССР, создатель крупной школа патофизиологов. Основное направление исследований Александра Александровича – изучение реактивности организма в нормальных и патологических состояниях. Его учение о трофической функции соединительной ткани являются основой современных представлений о коллагенозах. Он был организатором и руководителем научной разработки консервирования крови.
А.Д. Сперанский (1888-1961) – российский патолог, академик АН и АМН СССР, лауреат Государственной премии СССР, заслуженный деятель науки РСФСР, ученик И.П. Павлова. Алексей Дмитриевич, развивая идеи нервизма И.П. Павлова, создал оригинальное направление в патологии, выявил общие закономерности развития нервно-дистрофических процессов и их генерализации, выдвинул концепцию о нервной системе как ведущем звене в механизмах заболевания, выздоровления и компенсации.
И.Р. Петров (1893-1970) – российский патофизиолог, академик АМН СССР, генерал-майор медицинской службы. Иоакимом Романовичем успешно разрабатывались проблемы кислородного голодания, кровопотери, шока и терминальных состояний, посттрансфузионных осложнений, электротравмы, профессиональной патологии. Всеобщее признание получили его научные работы по проблеме гипоксии. Им разработана плазмозамещающая жидкость (жидкость Павлова), которая широко использовалась во время Великой Отечественной войны, и принципы терапии шока.
Г.Н. Кражановский (родился в 1922 году) – российский патофизиолог, академик АМН СССР. Основные направления научных исследований, проводимых Георгием Николаевичем, посвящены проблемам патофизиологии нервной системы, общей и инфекционной патологии. Он сформулировал теорию генераторных механизмов нейропатологических синдромов и концепцию о роли доминантных структур в деятельности нервной системы; разработал экспериментальные модели ряда нейропатологических синдромов.
В.А. Неговский (1909-2003) – лауреат Государственный премий СССР, академик АМН СССР – известен своими разработками в области патофизиологии и терапии терминальных и постреанимационных состояний. В 1936 году им создана Лаборатория экспериментальной физиологии по оживлению организма, преобразования в 1986 году в Институт общей реаниматологии АМН СССР. Владимиром Александровичем и его многочисленными учениками изучены основные закономерности умирания и оживления организма и создана такая молодая еще наука, как реаниматология. При его активном участии в нашей стране создана реаниматологическая служба. В.А. Неговский избран почетным членом многих зарубежных Академий Наук.
Н.Н. Зайко (1908-1992) – отечественный патофизиолог, член-корреспондент АМН СССР, заслуженный деятель науки Украины. Его научные разработки посвящены проблемам проницаемости биологических барьеров и исследованию механизмов неврогенных дистрофий. Николаем Никифоровичем написан учебник «Патологическая физиология», выдержавший уже четыре издания.
Н.Н. Спиротинин (1896-1977) – отечественный патофизиолог, академик АМН СССР и член-корреспондент АН Украины. Ученик А.А. Богомольца. Основное направление его исследований – изучение реактивности организма при инфекционных и неинфекционных заболеваниях и патологических состояниях в сравнительно-эволюционном аспекте. Николаем Николаевичем разработаны практические рекомендации по проблеме гипоксии в космической медицине.
Большое влияние на развитие отечественной патофизиологии оказала ленинградская школа академика АМН СССР Николая Николаевича Аничкова (1885-1965), заведующего кафедрой общей и экспериментальной патологи Военно-медицинской академии. Аничков широко включал в лекционный курс разнообразные, порой технически сложные опыты на животных, первый в стране ввел практические знания по патофизиологии; выдвинул теорию атеросклероза, признанную ныне во всем мире. Классическая работа Аничкова «Учение о ретикуло-эндотелиальной системе» - первая отечественная монография по этому вопросу. Основное его внимание было сосредоточена на разработке четырех проблем: патология сердечно-сосудистой системы, физиологии и патологии ретикулоэндотелиальной системы, кислородного голодания, патологии желудочно-кишечного тракта.
П.Д. Горизонтов (1902-1987) – выдающийся российский патофизиолог, академик АМН СССР, лауреат Ленинской и Государственной премий СССР, крупный организатор медицинской науки. Петр Дмитриевич окончил Омский медицинский институт и работал ассистентом на кафедре патофизиологии в 30-х годах. Он активно разрабатывал наиболее актуальные проблемы теоретической патологии (этиология, патогенез, роль внешней среды в возникновении заболеваний), изучал патогенез лучевой болезни, стресс, разработал методологические аспекты экспериментальной медицины.
Тема: Патофизиология внешнего дыхания.
Дыхание – совокупность процессов обеспечивающих поступление в организм кислорода из окружающей среды, использование его в биологическое окисление и удаление из организма углекислого газа.
Различают тканевое и внешнее дыхание.
Тканевое дыхание – совокупность процессов дыхания в ткани живого организма, представляющие собой окислительно-восстановительные реакции, приводящие к образованию энергии используемой организмом.
Внешнее дыхание – совокупность процессов газообмена осуществляющаяся благодаря функции дыхательных мышц, бронхо-легочного аппарата и системы регуляции, обеспечивающих легочную вентиляцию и диффузию газов через альвеолярно-капиллярные мембраны.
Аппарат внешнего дыхания включает дыхательные пути, респираторный отдел легких грудной клетки, нервные центры регулирующие дыхание. Он обеспечивает альвеолярную вентиляцию и перфузию ткани легкого.
Парциальное или комбинированное нарушение функционирования аппарата внешнего дыхания приводит к дыхательной недостаточности.
Дыхательная недостаточность – состояние, характеризующееся развитием гипоксии и гиперкапнии в результате нарушения газообменной функции легких.
Типовые формы расстройства внешнего дыхания.
К типовым формам расстройства внешнего дыхания относят нарушение вентиляции, нарушение вентиляционно-перфузионного соотношения, диффузии кислорода и углекислого газа через альвеолярно-капиллярную мембрану.
Нарушение вентиляции.
Вентиляция – циклическое чередование вдоха и выдоха, во время которого попеременно поступает определенный объем воздуха и выделяется примерно равное его количество. Основной показатель вентиляции – минутная альвеолярная вентиляция – определяется как произведение частоты дыхания на разность между дыхательным объемом и объемом мертвого пространства.
Выделяют 2 показателя:
Эффективность вентиляции – определяет напряжение кислорода (рО2) в альвеолах. Вентиляция считается эффективной если удается поддерживать напряжение кислорода в пределах 95-100 мм рт ст.
Экономичность – определяется затратой энергии и работы расходуемой организмом на 1 л альвеолярного воздуха. В норме эта работа равна 0,01-0,04 кгм. В патологии эта величина может повышаться.
Нарушение вентиляции проявляется:
Гиповентиляция.
Гипервентиляция.
Альвеолярная гиповентиляция характеризуется уменьшением минутной альвеолярной вентиляции и возникает вследствие расстройства механики дыхания, либо нарушении нейрогенных механизмов регуляции внешнего дыхания.
Обструктивный тип альвеолярной гиповентиляции заключается в понижении проходимости дыхательных путей. Это обуславливает снижение объема вентиляции, увеличение работы дыхательных мышц и повышение расхода энергии аппаратом внешнего дыхания.
Основные причины:
Обструкция верхних дыхательных путей инородным телом, пищей, западающим языком, слизью, экссудатом, растущей опухолью.
Спазм бронхов или бронхиол.
Спазм мышц гортани. Возникает при вдыхании раздражающих газов, нервозах.
Сдавление дыхательных путей извне опухолью, лимфоузлом, увеличенной щитовидной железой.
Адинамическое сдавление бронхов среднего и мелкого калибра во время форсированного выдоха, либо при сильном кашле у пациентов с эмфиземой легких.
Проявление:
Уменьшение объема форсированной жизненной емкости легких и объема форсированного выдоха за 1 секунду – индекс Тиффно. В норме он находится в пределах 70%.
ОФвыд.
 ФЖЕЛ = индекс
Тиффно.
ФЖЕЛ = индекс
Тиффно.
Увеличение остаточного объема легких.
Остаточный объем легких – объем воздуха остающегося в легки после максимально удлиненного выдоха.
Рестриктивный тип – характеризуется снижение и ограничением растяжимости легких и уменьшением степени их расправления. Проявляется уменьшением вентиляции легких, увеличением нагрузки на дыхательную мускулатуру и повышением энергозатрат.
Этиологические факторы делятся на 2 группы.
1 группа – внутрилегочные (паренхиматозные) – снижают растяжимость легочной ткани; фиброзирующие процессы в легочной ткани (пневмофиброз); обширные и множественные ателектазы и диффузные опухоли.
2 группа – внелегочные – ограничивающие дыхательную экскурсию легких – при сдавлении грудной клетки, снижении подвижности суставов грудной клетки (кифосклероз), воспаление плевры, фиброз плевры.
Проявляется уменьшением остаточного объема легких и жизненной емкости легких, повышается индекс Тиффно.
Альвеолярная гиповентиляция может быть вызвана нарушениями механизма регуляции внешнего дыхания, что может быть обусловлено поражением дыхательного центра и нарушение афферентных и эфферентных связей этого центра. Наиболее частыми причинами являются травмы и опухоли в области продолговатого мозга, сдавление головного мозга (отек, кровоизлияние), острая гипоксия, интоксикация этанолом, наркотическая передозировка, уремия, печеночная недостаточность, деструктивные изменения в ткани мозга (энцефалит, рассеянный склероз).
Клиника.
Апнестическое дыхание – характеризуется удлиненным вдохом за счет судорожного сокращения дыхательных мыщц и непродолжительным, прерываемым выдохом. Апнестический центр обладает способностью возбуждать инспираторные нейроны, которые периодически тормозятся импульсами поступающими из ядер блуждающего нерва и пневмотоксического центра – при инфаркте баролиева моста, гипоксии и отравлениях барбитуратами.
Дыхание типа gasping (удушье) – этот тип дыхания наблюдается в агональном состоянии и в заключительной стадии асфиксии. Характеризуется единичными глубокими, судорожными, короткими вдохами. Они убывают по силе, а между вдохами большие промежутки. Появление этого дыхания связано с возбуждением клеток находящихся в каудальной части продолговатого мозга.
Периодические формы дыхания – характерны периоды усиления дыхательных движений с последующим их ослаблением и периоды апное (дыхание Чайна-Стокса, дыхание Биотто). Возникновение периодического дыхания обусловлено периодическим нарастанием недостатка энергетического обеспечения нейронов дыхательного центра, нарушением физико-химических свойств мембран этих нейронов, а также колебания возбудимости нейронов дыхательного центра.
Дыхание Чайна-Стокса характеризуется нарастанием амплитуды до выраженного гиперпное, а затем уменьшение амплитуды до апное.
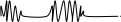
Встречается при сердечной недостаточности, заболеваниях головного мохзга и его оболочек, при уремии, при передозировке морфина.
Д
 ыхание
Биотто характеризуется дыхательными
движениями постоянной амплитуды, которые
внезапно прекращаются и внезапно
возобновляются (менингит и энцефалит).
ыхание
Биотто характеризуется дыхательными
движениями постоянной амплитуды, которые
внезапно прекращаются и внезапно
возобновляются (менингит и энцефалит).


Нарушение афферентной регуляции дыхательного центра: может быть недостаток возбуждающей афферентации (отравление этанолом и наркотиками) - при низкой возбудимости хеморецепторов, снижение тонической активности нейронов ретикулярной формации ствола мозга. Может быть избыток возбуждающей афферентации – при стрессе, энцефалите, кровоизлияниях в область продолговатого мозга, при невритических состояниях, раздражении хемо- и механорецепторов, при травме органов дыхания. Избыток возбуждающей афферентации вызывает частое поверхностное дыхание (тахипное), гипоксию, ацидоз.
Нарушение эфферентной нервной регуляции дыхания может возникнуть при повреждении на разных уровнях эффекторных путей, регулирующих работу дыхательных мышц. Например: поражение ствола мозга, кортикоспинальных путей, поражение нисходящих спинальных путей, мотонейронов спинного мозга, патология синапсов.
Альвеолярная гипервентиляция характеризуется увеличением вентиляции за единицу времени.
Причины:
Неадекватный режим искусственной вентиляции легких (наркоз).
Стресс, невротические состояния (фобии и истории).
Гипертермические состояния (лихорадка, тепловой удар).
Органические поражения головного мозга (ишемия, кровоизлияния, опухоли).
Экзогенная гипоксия.
Проявления:
Гипокапния – торможение утилизации кислорода тканями, снижение мозгового и коронарного кровотока.
Дыхательный алкалоз.
Снижение потребления кислорода – гипоксия тканей.
Дисбаланс ионов в плазме крови в виде гипокалиемии, гипомагниемии.
Парестезии как следствие элитного дисбаланса и ишемии головного мозга.
Нарушение регуляции внешнего дыхания.
В норме человек дышит без каких-либо видимых усилий (элпное – состояние дыхательного комфорта). При патологии в следствие рефлекторного и гуморального воздействия на дыхательный центр меняется ритм дыхания, его глубина, частота, появляется одышка.
Возникновение брадипное – редкое дыхание – обусловлено изменением характера импульсации идущих от органов к дыхательному центру, либо вследствие нарушения деятельности самих нейронов дыхательного центра.
Брадипноэ наблюдается при артериальной гипертензии (барорецепторы с дуги аорты), гипероксии, повышении сопротивляемости току воздуха в дыхательный центр (стенозирующее дыхание), вдох и выдох совершается медленно в силу запаздывание рефлекса Геринга-Брира.
Полипноэ (тахипное) – частое поверхностное дыхание, обусловленное перестройкой дыхательного центра (гипертермия, истерия, пневмония, ателектаз, застойные явления).
Тахипноэ снижает эффективность дыхания, поскольку снижает дыхательный объем, а вентилируется мертвое пространство.
Гиперпноэ – это частое глубокое дыхание. Может быть в норме при физической нагрузке. В условиях патологии гиперпное развивается вследствие интенсивной рефлекторной и гуморальной стимуляции дыхательного центра. Это происходит при снижении концентрации кислорода в воздухе, либо при повышении концентрации углекислого газа, либо при тяжелых анемиях.
Крайняя степень возбуждения дыхательного центра проявляется в виде дыхания Кусмауля – глубокое шумное дыхание, при котором после глубокого вдоха следует усиленный выдох с активным участием экспираторных мышц. Бывает при диабетической коме.
Апноэ – функциональная остановка дыхания, которая нарушает газообмен в организме. Может возникнуть рефлекторно, либо под наркозом.
Одышка (диспноэ).
Одышка – нарушение частоты, ритма и глубины дыхания. При ней повышается работа дыхательных мышц, и появляется субъективное ощущение недостатка воздуха или затруднения дыхания.
Ощущая недостаток воздуха человек непроизвольно и осознано увеличивает активность дыхательных движений. Одышки в бессознательном состоянии (под наркозом) не бывает.
Одышка возникает чаще при патологических процессах и состояниях. Возникает при понижении оксигенации крови в легких. Возникает при нарушении транспорта газов кровью при анемии и недостатке кровообразования, при ацидозе, повышенном обмене веществ, при патологии центральной нервной системы (энцефалиты, невротические состояния).
Развитие одышки обусловлено как перевозбуждением центра вдоха, так и не прекращающейся стимуляцией этого центра. Дыхание при одышке частое и глубокое, выдох носит активный характер и совершается при участии экспираторных мышц.
Одышка бывает инспираторная, когда затруднен и усилен вдох и экспираторная, когда затруднен и усилен выдох.
Инспираторная одышка наблюдается: при физической нагрузке, у больных с недостаточностью кровообращения, пневмотораксе, первой стадии асфиксии, при общем возбуждении ЦНС.
Экспираторная одышка встречается редко при бронхиальной астме, эмфиземе.
Расстройство кровообращения в легких.
Значение расстройства кровообращения в легких наблюдается при гипер- и гипотензии в сосудах малого круга кровообращения.
Легочная гипертензия.
Выделяют 3 формы:
прекапиллярная.
посткапиллярная.
смешанная.
Прекапиллярная гипертензия характеризуется повышением давления в прекапиллярах и капиллярах – систолическое повышается на 30 мм рт ст; диастолическое – на 12 мм рт ст.
Причины:
спазм стенок артериол, бывает при стрессах: эмболия легочных сосудов, острое снижение рО2, выброс катехоламинов, гипоксия.
сдавление легочных артериол (увеличенный лимфоузел, опухоли, повышение давления в альвеолах и бронхах при остром притупленном кашле).
Посткапиллярная гипертензия характеризуется повреждением оттока крови из легочных сосудов в левое предсердие.
Причины: стеноз митрального клапана, сдавление легочных вен опухолью или лимфоузлом, недостаточная сократительная функция миокарда левого желудочка (при инфаркте миокарда, гипертонической болезни, миокардиодистрофии).
Смешанная – оба механизма.
Смешанная форма легочной гипертензии проявляется признаками сердечной недостаточности в виде застоя крови в венозных сосудах малого круга, отека, уменьшением жизненной емкости легких, гипоксемии, гиперкапнии и дыхательным ацидозом. Развитие легочной гипертензии способствует:
Рефлекс Эйлера-Лильестранда – это физиологический рефлекс. При снижении напряжения кислорода в альвеолах возникает рефлекторный спазм легочных альвеол.
Недостаточная резервная емкость венозного русла малого круга кровообращения. В норме параллельно с увеличением кровенаполнения растягиваются легочные вены, чтобы стабильно поддерживать давление в капиллярах. Но при перерастяжении возникает спазм артериол (рефлекс Кетаева).
Анатомические факторы, которые обуславливают нарушение проходимости артерий малого круга (тромбоз, эмболия легочной артерии), воспалительные процессы в сосудах (васкулиты).
Эти факторы вызывают остро возникающую легочную гипертензию и легочную недостаточность. Вместе с тем она может развиться постепенно при медленном склерозировании сосудов малого круга кровообращения. При легочной артериальной гипертензии увеличивается нагрузка на правый желудочек, он постепенно гипертрофируется, а затем наступает его дилатация и формируется легочное сердце.
Легочное сердце – поражение правого желудочка вследствие гипертензии малого круга кровообращения, вызванные заболеванием легких.
По мере развития легочного сердца кроме нагрузки давлением возрастает его нагрузка объемом. В правом желудочке повышается конечное диастолическое давление подобно росту давления в легочной артерии. В силу того, что развитие гипертензии правого желудочка происходит в условиях дефицита кислорода, то это приводит к ранней гипоксической дистрофии миокарда и декомпенсации легочного сердца. Оно развивается не сразу.
Механизм стабилизации артериального давления в легочной артерии.
Артерио-венозное шунтирование крови: сброс крови через артерио-венозные анастомозы. При повышении давления в легочной артерии крови, минуя капилляры, по шунтам поступает в легочную вену и левое предсердие, благодаря этому давление в малом круге кровообращения понижается, но одновременно с этим в большой круг кровообращения поступает кровь с повышенным содержанием углекислого газа, что приводит к учащению и углублению дыхания, повышению минутной альвеолярной вентиляции. Нормализуется напряжение кислорода в альвеолах – устраняется рефлекс Эйлира-Лильестранда.
Рефлекторная дистония сосудов большого круга кровообращения (Швичека-Парина). Как только повышается давление в легочной артерии рефлекторно расходятся артерии большого круга кровообращения. Приток крови к правым отделам сердца снижен – левый желудочек успевает перекачать кровь – разгрузка малого круга кровообращения.
Гиперпноэ, если оно способно повышать легочную вентиляцию.
Легочная гипотензия.
Характеризуется стойким снижением давления в сосудах малого круга кровообращения и наблюдается: при пороках сердца с шунтированием крови справа налево (недостаточность клапанов легочной аорты); гиповолемия (кровопотеря); системная артериальная гипотензия.
Нарушение вентиляционно-перфузионых отношений.
В нормальных условиях существует оптимальное соотношение между величинами вентиляции и перфузии как в отдельных областях и в легких в целом – нормальный газообмен.
Норма равна 0,8-1.
Нарушение сопряжения вентиляции и перфузии ведет к развитию дыхательной недостаточности.
Причины:
Факторы, которые приводят к локальной гиповентиляции легких.
Инородное тело.
Аллергены.
Равномерная перфузия, но неравномерная вентиляция. Кровь недостаточно обогащается кислородом, что приводит к гипоксии. Гипокапнии не будет, т.е. его скорость перфузии возрастает в 20-30 раз.
Факторы, которые могут снижать локальную перфузию в связи с васкулитами, обтурацией ветвей легочной артерии, тромбозы, тромбоэмболии, сдавление легочных сосудов опухолью, рубцовой тканью, спазмом мышц ветвей легочной артерии.
Достаточная вентиляция, недостаточная перфузия – гипоксемия.
Неравномерная вентиляция и неравномерная перфузия (пневмосклероз, эмфизема) – гипоксемия, гипокапния.
Нарушение диффузии кислорода и углекислого газа.
Нарушение диффузии кислорода и углекислого газа – одно из причин развития дыхательной недостаточности.
Для того, чтобы кислород соединялся с гемоглобином, он должен преодолеть аэро-гематический барьер.
Аэро-гематический барьер: сурфактант, альвеолярный эпителий, базальная мембрана, интерстиций, базальная мембрана капилляра, эндотелий, слой плазмы, мембрана энтероцита, гемоглобин.
Суммарная площадь диффузионной мембраны ровна 180-200 м2, а толщина 0,2-2 мн.
Эта диффузная способность определяется градиентом концентрации этих газов в альвеолярном воздухе и в крови, адекватным кровотоком в легких, площадью диффузии и физико-химическим состоянием аэро-гематического барьера.
В норме диффузная способность кислорода составляет 15 мл в минуту при градиенте давления в 1 мм рт ст; углекислого газа – 300 мл в минуту. Скорость диффузии углекислого газа увеличена в 20 раз.
Основные причинны снижения диффузионной способности.
Увеличение толщины мембраны вследствие возрастания количества жидкости на поверхности альвеолярного эпителия (пневмония, аллергический альвеолит); отек интерстиции (интерстициальная пневмония); увеличение толщины эпителия капилляров (альвеолярно-капиллярный блок).
Увеличение плотности альвеолярно-капиллярной мембраны вследствие кальцификации – уплотнение стромы интерстиция; увеличение количества эластических и коллагеновых волокон в межальвеолярной перегородке.
Снижение площади диффузии: резекция доли легкого; очаги легочной деструкции (туберкулез, абсцесс, ателектаз).
Снижение времени контакта крови с альвеолярным воздухом.
Установлено, что во время прохождения крови по легочным капиллярам должен быть хороший контакт и для полной диффузии достаточно 0,2 секунды.
В здоровом легком – 0,6-0,7 секунд.
При изменении альвеолярно-капиллярной мембраны и ускорении кровотока (анемия, горная болезнь) газы не успевают диффундировать через мембрану – сниженное количеств кислорода связывается с гемоглобином – гипоксемия.
Снижение диффузионной способности аэро-гематогенного барьера.
Пневмонии с хроническим течением.
При пневмоканиозе, возникает при вдыхании пыли содержащей кремнезем, асбест – асбестоз.
Диффузный и очаговый фиброзный альвеолит.
Аллергический альвеолит (поллинозы).
Сердечная недостаточность.
Дыхательная недостаточность.
Дыхательная недостаточность – состояние, характеризующееся снижением в крови напряжения кислорода и нарастанием напряжения углекислого газа, наступающего в результате патологии аппарата внешнего дыхания.
«Формула дыхательной недостаточности» - гипоксия + гиперкапния.
Дыхательная недостаточность – патологический процесс, развивающийся вследствие нарушения внешнего дыхания, при котором не обеспечивается поддерживание адекватного потребностям организма газового состава, как в покое, так и при физической нагрузке (Зайко).
Дыхательная недостаточность:
Компенсированная – неизмененный газовый состав крови поддерживается за счет усиления работы дыхания, т.е. углубления и учащения дыхания, увеличения МАВ, усиления работы дыхательной мускулатуры – вентиляционное дыхание, при котором компенсация достигается за счет мобилизации функциональных резервов.
Некомпенсированная – когда присоединяется артериальная гипоксемия и гиперкапния – снижается напряжение кислорода и развивается респираторный (дыхательный) ацидоз, как проявление декомпенсации.
Причины:
I группа – легочные (интрапульмональные).
Нарушение вентиляции.
Нарушение перфузии.
Нарушение вентиляционно-перфузионного соотношения.
Нарушение диффузии газов через альвеолярно-капиллярную мембрану.
Расстройство газообменной функции легких.
II группа – внелегочные (экстрапульмональные).
Нарушение механизмов нейрогенной регуляции внешнего дыхания, т.к. вентиляция альвеол регулируется нейронами дыхательного центра, расположенными в продолговатом мозге и варолиевом мосту, то при инсультах, опухолях и травмах мозга нарушается ритм, глубина и частота дыхания.
Нарушение функции мотонейронов спинного мозга, которые иннервируют дыхательные мышцы – травмы, опухоли, кровоизлияния спинного мозга.
Нарушение эффективного регуляторного влияния в нервно-мышечных синапсах мышц и диафрагмы – полиомиелит, остеомиелит.
Нарушение функции дыхательной мускулатуры – дистрофия межреберных мышц (миозиты), нарушение работы диафрагмы.
Расстройство дыхательной экскурсии грудной клетки, что может быть обусловлено травмой ребер и позвоночника, анкилоз суставов, плевральные спайки, асцит.
Нарушение целостности грудной клетки и плевральной полости (ранения, разрыв легкого при абсцессе).
Недостаточность кровообращения в легких – сердечная недостаточность, анемии.
Существуют 3 фазы дыхательной недостаточности.
Гипоксемическая (паренхиматозная, I тип) – возникает вследствие нарушения диффузии газов через альвеолярно-капиллярную мембрану при нарушении перфузии легких, при нарушении вентиляционно-перфузионного соотношения. Этот пит дыхательной недостаточности встречается при тяжелых поражениях паренхимы легких (генерализованое инфицирование легочной ткани, бронхиты, бронхиолиты, отек легкого, вдыхание токсических газов). Признаки: гипоксемия (падение напряжения кислорода в крови).
Гиперкапническая (гиповентиляционная, II тип) – возникает при бронхиальной астме, бронхопневмонии, опухоли бронхов – те процессы, которые обуславливают альвеолярную гиповентиляцию, нарушают вентиляционно-перфузионное соотношение в связи с недостаточностью вентиляции альвеол. Признаки: гипоксемия, гиперкапния.
Смешанная – возникает при острых и хронических заболеваниях легких, которые обуславливают гиповентиляцию обструктивного типа, она встречается при обструктивной эмфиземе, бронхоэктатической болезни, пневмонии и абсцессе легких и характеризуется первичной гиперкапнией и гипоксемией.
Респираторный дистресс-синдром.
Респираторный дистресс-синдром – острая форма дыхательной недостаточности, преимущественно гипоксемического типа. Синонимы: «влажное легкое», «шоковое легкое», «респираторное легкое», «травматическое легкое», «геморрагический ателектаз», «гиалиновые мембраны».
Название синдрома отражает определенное сходство клинических и морфологических функциональных изменений с респираторным дистресс-синдромом новорожденных, основной причиной которого служит нарушение сурфактанта и выделение этого сурфактанта на поверхности альвеолоцитов.
Причины респираторного дистресс-синдрома взрослых.
Диффузная инфильтрация легочной ткани.
Аспирация жидкости (в том числе – желудочного содержимого).
Перитонит.
Сепсис.
Диабетический кетоацидоз, уремия.
Переливание большого объема крови.
Состояние после трансплантации сердца и легких.
Отек легких.
Аутоиммунные заболевания.
Шоковые состояния.
Критические и постоперационные состояния.
Обширные хирургические вмешательства.
Жировая эмболия легочной артерии.
Вдыхание ядовитых и раздражающих газов.
Патогенез респираторного дистресс-синдрома.
Патогенные факторы, действующие на ткань легких, вызывают генерализованное воспаление альвеолярно-капиллярной мембраны, повышается их проницаемость и проницаемость легочных капилляров.
Последствия:
снижение диффузии кислорода через альвеолярно-капиллярную мембрану,
повышение выхода фибрина и клеток крови в интерстиции – фиброз.
гипоксия при сочетании первого и второго.
Так как эти факторы воспаляют эпителий альвеол, это сопровождается выходом жидкости в просвет альвеол, внутрилегочным шунтированием кровотока, проникновением фибрина и других белков в просвет бронхиол и бронхов. В результате возникает гиалиноз мембраны.
Возникает недостаточность сурфактантной системы, что приводит с слипанию альвеол и прогрессии гипоксемии.
Респираторный дистресс-синдром характеризуется прогрессирующим течением и проявляется одышкой, тахипноэ, уменьшением МАВ, но снижением легочных объемов, объемной емкости легких, остаточного объема легких, жизненной емкости легких, ФОЕЛ.
Респираторный дистресс-синдром взрослых характеризуется общим дыхательным алкалозом, увеличением сердечного выброса (минутного объема). Этот синдром развивается постепенно и достигает своего пика через 24-48 часов от начала воспаления и заканчивается массивным двусторонним воспалением легочной ткани.
Клинически выделяют 4 стадии:
I стадия воспаления – 6 часов, нет клиники, рентгенологические изменения в легких.
II стадия кажущейся устойчивости – 6-12 часов после воздействия патогенных факторов. Характер: тахикардия, тахипноэ, умеренное снижение напряжения кислорода в артериальной крови (на 5-7 мм рт ст.), но гипоксемия нарастает. Рентгенографически: усиление сосудистого компонента легочных рисунка, переходящего в интерстициальный отек легкого.
III стадия дыхательной недостаточности – до конца первых суток (12-24 часа). Характер: выраженная острая дыхательная недостаточность, одышка типа гиперпноэ, в дыхании участвует вспомогательная мускулатура, усиленно нарастает напряжение кислорода до 500 мм рт ст. в артериальной крови.
Дыхание жесткое, влажные хрипы свидетельствуют о накоплении жидкости в альвеолах. Рентгенографически выражен интерстициальный отек легких, в краевых отделах средней и нижней долей на фоне усиления сосудистого рисунка появляется очагово-подобные тяни, иногда горизонтальные линии. Тени сосудов размыты, т.к. появляется периваскулярные и перибронхиальные муфты. Видны инфильтративные тени – периваскулярная жидкость.
IV терминальная стадия – все симптомы прогрессируют: глубокая, артериальная гипоксемия, цианоз, дыхательный и метаболический ацидоз, сердечно-сосудистая недостаточность, альвеолярный отек легких, полиорганная недостаточность.
Тема: Печеночная недостаточность.
Печеночная недостаточность – состояние, характеризующееся нарушением функции печени и проявляющееся желтухой, геморрагическим синдромом и нервно-психическими расстройствами. По течению может быть острой и хронической. По выраженности клинических симптомов может быть явной и скрытой. По количеству нарушенных функций может быть парциальной и тотальной.
Печеночная недостаточность = шоковая печень, холемия, печеночная кома, гепатаргия.
Причины печеночной недостаточности:
1 группа – биологические факторы – вирусы гепатита А, В, С, инфекционный мононуклеоз, бактерии (возбудители брюшного тифа, туберкулеза), гельминты (альвеококки, описторхии, эхинококки).
2 группа – опухоли печени.
3 группа – аутоиммунные процессы – хронический активный гепатит – трансплантация печени.
4 группа – воздействие на печень токсинов и лекарственных веществ: грибной яд, свинец, фосфорорганические инсектициды, хлороформ, сульфаниламиды, антибиотики, гексинал, туберкулостатические препараты.
5 группа – закупорка желчных протоков опухолью или камнем.
6 группа – заболевания органов и систем, приводящих к печеночной недостаточности – хроническая сердечно-сосудистая недостаточность (нарушение гемодинамики), обширные ожоги.
7 группа – воздействие экстремальных факторов на организм – травматический и гемотрансфузионный шоки, злоупотребление алкоголем.
8 группа – злоупотребление алкоголем. Стадии алкогольного воздействия:
жировая дистрофия,
алкогольный гепатит,
цирроз.
Жировая дистрофия (синонимы: жировой гепатоз, стеатоз) – развивается при длительном употреблении алкоголя. Протекает бессимптомно, иногда обнаруживается увеличение печени. Обнаруживается гемааглютаминтрансфераза, АсАТ, АлАТ в гепатоцитах. Обратима.
При более длительном употреблении алкоголя возникает алкогольный гепатит, структурной основой которого служит сочетание жирового гепатоза с некрозом гепатоцитов и появлением в них алкогольного геалина. Происходит инфильтрация нейтрофилами печени – показатель воспалительного процесса. Полного восстановления печени нет. Процесс частично обратим. Макро- и микропрепараты – нодулярный склероз.
При еще более длительном приеме алкоголя развивается цирроз.
На ряду с этиологическими факторами особое значение играют провоцирующие факторы – способствующие или усугубляющие тяжесть течения.
Алкогольные напитки.
Желудочно-кишечные кровотечения.
Интоксикация барбитуратов (большие дозы).
Патогенез печеночной недостаточности.
При действии патогенных факторов повреждаются гепатоциты, а это обусловлено нарушением биологических процессов в печени (обмен веществ – углеводный обмен).
Нарушение углеводного обмена.
Уменьшается образование гликогена и отложение его в гепатоцитах. Тормозится глюконеогенез. Наклонность к гипогликемии. Нарушается превращение галактозы и фруктозы в глюкозу. Нарушается синтез глюкуроновой кислоты.
Нарушение со стороны белкового обмена:
Нарушения расщепления и перестройки аминокислот (дезаминирование и переаминирование).
Снижается синтез белков в печени (уменьшается содержание альбуминов).
Появляются необычные белки – парапротеины.
Снижается синтез и содержание фибриногена, протромбина, проконвертина – развивается геморрагический синдром.
Нарушается образование конечных продуктов белкового обмена – образование мочевины (гиперазотемия, снижение синтеза креатинина).
Нарушение процессов дезаминирования и переаминирования, снижение синтеза необходимых аминокислот в ткани, но увеличение их содержания в крови называется аминоацидемия.
В основе нарушения белкового обмена при печеночной недостаточности лежит повреждение рибосом и зернистого эндоплазматического ретикулума.
Нарушение жирового обмена.
Нарушение синтеза триглицеридов, фосфолипидов, липопротеидов и холестерина, но повышается синтез кетоновых тел и жирных кислот. Уменьшение образования фосфолипидов снижает активность ферментов – страдают энергетический обмен и трансмембранные процессы.
Нарушение обмена жирорастворимых витаминов (А, D, Е, К).
Эти витамины всасываются только после эмульгирования желчью - авитаминозы.
Гормоны (альдостерон, вазопрессин, тироксин, андрогены, эстрогенны) инактивируются печенью. Создается ложное впечатление о гиперпродукции гормонов.
Отражением патологии всех видов обмена служат характерные изменения физико-химических свойств крови:
гипогликемия,
гипопротеинемия,
гипербилирубинемия,
уменьшение белков, которые участвуют в гемостазе,
гипохолестеринемия,
аминоацидемия,
гиперкетонемия,
метаболический ацидоз,
геморрагический синдром.
При поражении печени нарушается обезвреживающая функция печени:
коньюгирование,
ацетилирование,
гидролиз,
метилирование,
восстановление.
Они все будут нарушены, из-за недостаточности ферментов.
Снижается избирательное поглощение печенью из крови токсических продуктов и выведение их из организма. Это приводит к накоплению в сыворотке крови ароматических и серосодержащих аминокислот, кетоновых тел, лактата, пирувата, низкомолекулярных жирных кислот (НЖК).
Острая печеночная недостаточность, печеночная кома.
Острая печеночная недостаточность возникает при отравлении гепатотропными ядами, при тяжело протекающих инфекциях, при злоупотреблении алкоголем, при холестазе, при повреждении мембран гепатоцитов. В основе острой печеночной недостаточности лежит цирроз гепатоцитов.
Гепатоцеллюлярная недостаточность и печеночно-клеточная недостаточность – поражение гепатоцитов. Характеризуется их местным некрозом и проявляющимися тяжелыми формами печеночной недостаточности.
В развитии острой печеночной недостаточности выделяют 3 стадии:
стадия психо-эмоционального расстройства. Характеризуется эмоциональной неустойчивостью;
стадия неврологических расстройств и нарушения сознания – характеризуется резким возбуждением, которое сменяется заторможенность;
стадия комы (с греч. «глубокий сон»).
Кома – состояние глубокого угнетения функций центральной нервной системы. Она характеризуется полной потерей сознания, утратой реакции на внешнее раздражение и расстройством регуляции жизненно важных функций организма.
Кома обусловленная крайней степенью печеночной недостаточности называется печеночная кома, а комплекс нарушения деятельности центральной нервной системы называется печеночной энцефалопатией. Печеночная кома называется также гепатаргией («аргия» с греч. - бездеятельная).
Гепатаргия – клинический синдром развивающийся при тяжелой печеночной недостаточности или печеночной интоксикации и проявляется нервно-психическими нарушениями и появлением «печеночного запаха» изо рта.
В зависимости от механизмов развития выделяют 3 формы печеночной недостаточности, печеночной энцефалопатии:
эндогенная или печеночно-клеточная – связана с поражением самой печени.
экзогенная (портоковальная).
смешанная – обусловлена сочетанием первого и второго механизмов.
Наиболее часто печеночная энцефалопатия встречается при заболеваниях, которые сопровождаются прогрессирующим уменьшением паренхимы печени, а провоцирует это употребление алкоголя, гепатотоксическое и церебротоксическое действие, наркоз, операции, острые инфекции, желудочно-кишечные кровотечения, перегрузка пищевым белком.
Патогенез печеночной энцефалопатии.
Выделяют ведущие патогенетические факторы:
Нарушение метаболизма аммиака и меркаптанов приводит к накоплению их в организме и оказывает резко выраженный депрессивный эффект на регенерацию гепатоцитов. Аммиак угнетает тканевое дыхание, активирует К-Na АТФазу и хлорный насос, уменьшая АТФ в клетках.
Фенолы, ароматические спирты и их дереваты. Они поступают в большом количестве из кишечника, должны метабализироваться в печени и удалятся почками. При поражениях печени они накапливаются и усугубляют тяжесть печеночной энцефалопатии, больные впадают в кому.
Нарушение кислотно-основного состояния и электролитного состава крови. Развивается ацидоз, накапливается углекислота, возбуждается дыхательный центр, гиповентиляция, гипокапния – алкалоз. Сосуды мозга суживаются.
Почечная недостаточность.
Нарушение углеводного обмена. Образуются токсические продукты – бутиленгликоль, ацетон.
Появление ложных нейротрансмиттеров, которые представляют собой метаболиты обычных нейротрансмиттеров (метаболиты норадреналина, аспарагин, гутамин).
Избыток азота. Азот имеет эндогенное происхождение. Развивается гиперазотемия (остаточный азот, мочевана) – поступают в кишечник, на них действуют микроорганизмы, образуется NH3, который всасываясь обратно проявляет токсическое действие.
Печеночная энцефалопатия возникает при наличии в организме тяжело протекающих инфекций – острые пиелонефриты, сепсис, бактериальный распад.
В развитии печеночной энцефалопатии различают 4 стадии. Это зависит от выраженности клинических симптомов, которые оцениваются по степени нарушения сознания, мышления, поведения и неврологического статуса.
1 стадия – характеризуется нарушением сна и бодрствования (сонливость или бессонница), раздражительностью. Появляются ошибки при счете, эйфория или депрессия, мелкий тремор, нарушение координации при выполнении точных движений и письма.
2 стадия – характеризуется патологической сонливостью (летаргия), замедлением реакции на происходящее, дезориентацией во времени. Появляются грубые ошибки при счете, ретроградная амнезия, неадекватное поведение, гнев, апатия, нарушение речи, гипорефлексия, тремор, атаксия – нарушение движения.
3 стадия – характеризуется спутанностью сознания, дезориентацией в пространстве, амнезией, паранойяльным бредом, гиперрефлексией, нистагмом, пирамидной симптоматикой (симптом Кернига). Появляются выраженные структурные повреждения коры головного мозга.
4 стадия – характеризуется ступором, комой, расширением зрачков.
Клинические проявления широко варьируют от скорости наступления печеночной энцефалопатии и объема некротизации ткани. Начало печеночной энцефалопатии может быть постепенным или внезапным (токсический гепатит – фульминантная печеночная недостаточность).
Острая печеночная энцефалопатия возникает в короткие сроки, интенсивно проходит фаза возбуждения. Появляются множественные подергивания мышц – предвестники комы. Состояние больного резко ухудшается. Нарастает желтуха и интоксикация, исчезает аппетит, присоединяется икота, рвота, тошнота, повышается температура, появляются геморрагии. Затем появляются зрительные и слуховые галлюцинации, головокружение вплоть до обморока, появляются боли в правом подреберье, печень уменьшается в размерах, появляется «печеночный» запах изо рта. На ввысоке комы отсутствует болевая реакция. В терминальном состоянии появляется расходящееся косоглазие, исчезает зрачковый рефлекс, нарастает церебрацтионная ригидность.
Принципы патогенетической терапии.
Инфузионная терапия.
Правильно организовать парентеральное питание.
Нормальный уровень гемодиляции.
Детоксикация организма путем связывания и удавления токсических веществ.
Нормализация электролитного баланса.
Нормализация клеточно-основного состояния.
5-10% раствор глюкозы 1,5-2 л/сутки, гемодез (связывает токсины), маннитол (противоотечное), препараты, устраняющие парез кишечника, карбоксилаза, никотинамид, аскорбиновая кислота.
Возникает опасность возникновения отека мозга, поэтому назначают мочегонные (лазекс – 40 мг). Средства, нормализующие гемостаз.
Тема: Желтухи.
Нарушение пигментного обмена печени.
Желтухи (icterus) – окрашивание в желтый цвет слизистых оболочек, кожи и склер, обусловленное отложением в них желчных пигментов.
В норме концентрация билирубина в сыворотке крови равна 3-10 мг/л (5-17 ммоль/л). Когда содержание билирубина повышается до 20-25 мг/л появляется желтушное окрашивание. Особенно много желтушного окрашивания при механической желтухе.
Образование и метаболизм билирубина.
Билирубин образуется в результате катаболизма гемоглобина стареющих эритроцитов, которые разрушаются в клетках макрофогальной системы. В течение суток образуется 80-85% билирубина.
Гемоглобин распадается на глобин и гемм. Гемм окисляется, превращается в биливердин, а под влиянием биливердинредуктазы биливердин превращается в билирубин. 15% билирубина образуется из разрушающихся в костном мозге эритроцитов, из белков цитохромов, миоглобина и гем-содержащих ферментов.
Высвобождающийся в плазму билирубин связывается с альбумином и транспортируется в печень. В гепатоците эта связь разрывается, альбумин возвращается в кровь, а билирубин соединяется с белком - лигандином. Этот белок доставляет его к ферменту глюкоронилтрансферазе, при участии которой образуется либо би- (80%) либо моноглюкоронид билирубина (15%). Он секретируется в желчные капилляры и по общему желчному протоку поступает в двенадцатиперстную кишку. В нижних отделах тонкого кишечника и в толстой кишке при участии бактериальных ферментов билирубин трансформируется в уробилиноген. Часть уробилиногена выделяется с калом в виде стеркобилиногена, незначительная часть всасывается геморроидальными венами и минуя печень поступает в общий кровоток, выделяется с мочой. Другая часть всасывается в систему воротной вены, поступает в печень, трансформируется в прямой билирубин, который поступает в двенадцатиперстную кишку.
В норме уробилиноген в крови отсутствует. Его появление – ранний признак поражения печени – гепатита.
Желтуха печеночная (icterus hepaticus) – гепатоцеллюлярная, паренхиматозная, эпителиально-клеточная – желтуха обусловленная поражением гепатоцитов. Характеризуется повышенным содержанием в крови прямого и непрямго билирубина и увеличением выделением уробилина с мочой, стеркобилина с калом.
Классификация.
По этиологии и патогенезу.
Механическая (подпеченочная).
Паренхиматозная.
Гемолитическая.
По происхождению.
Желтухи печеночные (паренхиматозная и энзимопатическая).
Непеченочные желтухи – не связаны с поражением гепатоцитов (механическая и гемолитическая).
Печеночные желтухи.
Печеночные (клеточные или паренхиматозные) желтухи.
Этиологические факторы: инфекционные, неинфекционные, вирусы (гепатит А, В, С), бактерии и плазмиды.
Неинфекционные делятся на: органические (метанол, этанол, аллергические тела, и т.д.) и неорганические гепатооксичные вещества.
Выраженность нарушенных функций зависит от тяжести альтерации и количества поврежденных гепатоцитов. Повреждения начинаются с изменения структуры клеточных мембран и подавления активности ферментов, что приводит к расстройству желчеобразования и желчевыделения. Различают 3 стадии печеночной желтухи:
1 стадия – преджелтушная. Под воздействием патогенных факторов происходит альтерация мембран гепатоцитов, повышается их проницаемость и выход в интерстицию и кровь ферментов и электролитов (трансмембранвзы, аланил, гаммаглютамилтрансфераза), повышается уровень калия, но снижается активность ферментов разрушающих уробилиноген. Он накапливается в крови и моче – ранние признаки поражения печени. Стул может быть гипохоличным.
2 стадия – желтушная. Характерно дальнейшее усиление альтерации и разрушение ферментов, повреждение гепатоцитов и появление «соустья» между желчными и кровеносными капиллярами. Развивается холемический синдром, т.е. повышается содержание прямого билирубина в крови. Появляются желчные кислоты в крови, повышается содержание холестерина. Появляется геморрагический синдром.
3 стадия – Альтеративные процессы еще больше усиливаются, прогрессирующе снижается активность глюкоронилтрансферазы. Появляется кожный зуд. Снижается содержание уробилиногена и в крови и в моче. Появляется стеаторея и ахолический синдром. Гиперкалиемия. Это способствует развитию печеночной комы.
Энзимопатические желтухи делятся на: первичные и вторичные.
Первичные возникают в следствие поражения генов кодирующих синтез либо ферментов, либо белков.
Синдром Жильбера (семейная негемолитическая желтуха) – доброкачественная хроническая болезнь, для которой характерна незначительная, но не купируемая гипербилирубинемия (нарушается захват непрямого билирубина). Клинически проявляется после 20 лет. Содержание билирубина 12-30 мг/л. Этот синдром связан с дефицитом глюкоронилтрансферазы, либо белка – лигандина. Встречается у 3-5% населения. Признаков поражения печени и гемолиза эритроцитов нет. Умеренно выражены печеночные пробы.
Синдром Дабина-Джонсона (хроническая идеопатическая желтуха). Протекает доброкачественно. Наследуется аутосомно и характеризуется появлением темного пигмента в центрально расположенных гепатоцитах. В основе лежит нарушение транспорта билирубина из гепатоцитов в желчь. Содержание билирубина 50-130 мг/л. Не требует лечения.
Синдром Криглера-Нояра. Обусловлен отсутствием глюкоронилтрансферазы (тип I), или частичного дефицита этого фермента (тип II). Нарушается конъюгация непрямого билирубина. Тип I встречается редко у детей, которые обычно погибают в течение первого года жизни. Уровень непрямого билирубина повышается до 200-450 мг/л в сыворотке крови. Желчь бесцветная. Неконьюгированный билирубин накапливается в крови и поступает к нейронам ядер черепно-мозговых нервов, возникает энцефалопатия (билирубиновая энцефалопатия). Тип II – частичный дефицит глюкоронилтрансферазы. Содержание билирубина 40-60 мг/л. Желтуха проявляется после юношеского возраста. Неврологические осложнения редки. Доминирует моноглюкоронид. Заболевание доброкачественное.
Непеченочные желтухи.
Гемолитическая.
Механическая.
Гемолитическая желтуха – желтушность возникает с следствие повышения гемолиза эритроцитов. Характеризуется повышенным содержанием в крови непрямого билирубина, повышенным содержанием стеркобилинас калом, уробелина с мочой.
Этиология.
Отравление гемолитическими ядами (змеиный яд, мышьяковистый водород).
Возникает после переливания крови не совместимой по группе или резус-фактору. У новорожденных на почве резус-конфликта.
Образование антител против эритроцитов, которые вызывают аутоиммунную гемолитическую анемию.
Наследственно обусловленные анемии.
Повышение гемолиза эритроцитов в костном мозге (неэффективность эритропоэза).
Эти факторы могут вызывать внутрисосудистый и внесосудистый гемолиз, обуславливая клинические признаки поражения гепатоцитов с характерными симптомами печеночной недостаточности и паренхиматозной желтухи.
Проявляются клинические признаки гемолиза эритроцитов в виде анемии, гипербилирубинемии, гемоглобинурии.
Механическая желтуха.
Обусловлена механическим препятствием для тока желчи по желчевыделительным путям. Наиболее частые причины:
Закупорка желчевыделительных путей опухолью, камнем, паразитами, гранулематозной тканью (билиарный цирроз).
Сдавление желчных путей снаружи опухолью головки поджелудочной железы, увеличенным лимфатическим узлом, либо рубцовой тканью.
Дискинезии желчного пузыря – нарушение тонуса и снижение моторики стенок желчевыделительных путей.
Эти факторы обуславливают повышение давления выше препятствия, перерастяжение желчных капилляров, вплоть до их разрыва, появляются «соустья» между желчными и кровеносными капиллярами. Появляются симптомы холимического синдрома.
Холимия – комплекс расстройств возникающих вследствие проникновения в кровь компонентов желчи и особенно желчных кислот, прямого билирубина и холестерина.
Клинические проявления.
Желтуха.
Билирубинурия (темный цвет мочи) – желчные кислоты в моче.
Гиперхолестеринемия и избыточное поглощение холестерина макрофагами, которые накапливаются в коже конечностей (кисти, предплечья) и стоп в виде ксантом. Могут быть вокруг глаз – ксантелазм.
Кожный зуд.
Брадикардия – замедление сердечных сокращений. Обусловлено влиянием прямого билирубина и особенно желчных кислот на клетки САУ.
Артериальная гипотензия. Обусловлена снижением базального тонуса гладкомышечных клеток сосудов, особенно артериол, а также повышением тонуса бульбарных ядер блуждающего нерва под действием желчных и жирных кислот.
Повышение раздражительности и возбудимости за счет снижения активности тормозных нейронов коры головного мозга под влиянием компонентов желчи.
Повышение кровоточивости.
Ахолический синдром.
Ахолия – состояние обусловленное значительным уменьшением, либо полным прекращением поступления желчи в кишечник, сочетающееся с нарушением полостного и пристеночного пищеварения.
Стиатарея.
Дисбактериоз.
Кишечная аутоинфекция и интоксикация.
Это способствует усилению процессов гниения и брожения в кишечнике и развитию метеоризма.
Полигиповитаминоз.
Ахоличный стул.
Цирроз печени.
Цирроз печени (от греч cirrosis – лимонно-желтый), термин введен в 1819 г.
Цирроз – разрастание соединительной ткани в паренхиматозном органе, которое сопровождается его морфологической перестройкой, уплотнением и деформацией.
Цирроз печени – хронически-прогрессирующее полиэтиологическое заболевание, которое характеризуется диффузным разрастанием соединительной ткани, патологической узловой регенерацией паренхимы с образованием псевдодолек.
Снижается количество функционально полноценных гепатоцитов, а также перестройка стромы и сосудистой сени, это приводит к портальной гипертензии, асциту и печеночной недостаточности.
С учетом этиологических факторов и патогенетических механизмов циррозы печени делятся на:
Постнекротический.
Билиарный.
Портальный.
Смешанный.
По морфологическому критерию делятся на
Макронадулярные.
Микронадулярные.
Макронадулярный характеризуется развитием крупных, а микронадулярный – мелких узловых утолщений регенерирующей печеночной ткани.
Этиология.
Наиболее частой причиной постнекротического цирроза печени является вирусный гепатит (болезнь Боткина), алкогольная интоксикация и действие гемолитических ядов.
Билиарный цирроз.
Причины: аутоиммунные поражения эпителия внутрипеченочных желчных протоков. Это приводит к абтурации и холестазу.
Портальный цирроз.
Возникает при хронической застойной сердечной недостаточности или окклюзии нижней полой вены.
Патогенез.
Не зависимо от природы этиологического фактора механизм развития цирроза имеет 2 общих звена – гипоксия и некроз гепатоцитов. Они обуславливают патологическую регенерацию печени с образованием псевдодолек, диффузное разрастание соединительной ткани, что приводит к деформации печени.
При циррозе происходит гибель части печеночных клеток, это приводит к бурной регенерации невоспаленной ткани. Происходит сдавление окружающих их паренхимы, замещение ее соединительной тканью. Формируется порочный круг.
Основные проявления:
Портальная гипертензия обусловлена дезорганизацией внутрипеченочного кровотока. Эта гипертензия влечет за собой расширение вен пищевода, кардиального отдела желудка, вен передней брюшной стенки. Это опасно развитием кровотечения, которое трудно остановить.
Гепато- и спленомегалия - гепатолиенальный синдром, нарушение элиминирующей функции селезенки, анемия, тромбоцитопения.
Асцит.
В крови снижается онкотическое давление (из-за снижения альбумина) – отеки, появляются необычные белки – диспротеинемия, печеночная недостаточность – печеночная энцефалопатия.
Главная причина смерти больного при циррозе печени – инфекционно-септические осложнения и кровотечения из варикозно-расширенных вен пищевода и желудка.
Экспериментальное моделирование патологической печени.
Прямая фистула Экка (барьерная функция) – 1877г. накладывались соустья между воротной веной и нижней полой веной. Это приводит к общей интоксикации организма. Если животное кормить мясной пищей, то смерть наступает через 2-3 дня. Если кормить растительной – то до 10 дней.
Обратная фистула Экка-Павлова. Соустья между воротной и нижней полой веной и перевязывают ниже соустья нижней полой вены, это приводит к повышению давления в воротной вене – портальная гипертензия, кава-кавальные анастамозы.
Частичное удавление печени.
Одномоментная деваскуляризация – острая печеночная недостаточность. Многомаментная – хроническая печеночная недостаточность.
Снисостамия по Лондону.
Тема: Патофизиология почек.
Заболевания почек различной природы наблюдаются у 1,5-2% населения, что составляет 5-6% в структуре общей заболеваемости. Примерно 2/3 обследованных лиц даже не подозревают о наличии у них почечной патологии. Заболевания почек характеризуются наклонностью к длительному течению, низкой эффективностью терапевтических мероприятий, частичной утрате трудоспособности при этом и отличаются повышенной летальностью. В последние годы возросло число случаев поражения почек лекарственными препаратами.
Основные функции почек и этиология почечных нарушений.
Почки выполняют разнообразные функции, но основная – это избирательное удаление различных веществ из организма с целью поддержания относительного постоянства химического состава плазмы крови и внеклеточной жидкости, т.е. поддерживать гомеостаз/гомеокинез в организме.
1. Почки очищают плазму крови от некоторых веществ, концентрируя их в моче. Большая часть таких веществ представляет собой конечные продукты обмена: мочевина, креатинин, мочевая кислота, избыточное накопление которых может вызвать отравление организма.
2. Почки удаляют с мочой из организма многие экзогенные соединения: лекарственные препараты (антибиотики, сульфаниламиды, препараты йода и т.д.), ядовитые и токсические вещества (мышьяк, ртуть, свинец и т.д.).
3. Почки участвуют в регуляции важнейших параметров организма:
- регулируют выведение натрия из организма путем усиления или уменьшения его реабсорбции в почечных канальцах, поддерживая тем самым осмотическое равновесие внутренней среды организма;
- почки поддерживают постоянство объема воды в организме за счет изменения клубочковой фильтрации, проксимальной и дистальной реабсорбции и осмотического концентрирования мочи;
- поддерживают постоянный уровень различных ионов крови: калия, кальция, магния, натрия, железа, хлора, а также фосфат-, сульфат, карбонатанионов;
- почки принимают участие в удалении из организма нелетучих кислот и избытка щелочных радикалов и таким образом, участвуют в поддержании постоянства рН.
4. Почки осуществляют мочеобразование и мочевыделение путем фильтрации, реабсорбции и секреции.
5. Почки участвуют в регуляции гемопоэза посредством синтеза и секреции эритропоэтина – гликопротеида, стимулирующего эритропоэз в костном мозге. Эритропоэтин синтезируется в юкстагломерулярном аппарате.
6. В почке вырабатываются биологически активные вещества, обладающие системным и локальным действием:
- ренин. Он образуется в ЮГА, его секреция возрастает при уменьшении кровенаполнения клубочковой артерии и повышении концентрации хлорида натрия в дистальном отделе нефрона. Ренин, воздействуя на ангиотензин, косвенно участвует в поддержании АД и ОЦК;
- простагландины (Е1 и Е2), оказывающие депрессорное действие на сосуды и усиливающие кровоток;
- витамин Д3, образующийся в почках, стимулирует всасывание Са в кишечнике, а также участвует в реабсорбции Са и неорганического фосфата в почечных канальцах;
- урокиназа синтезируется в почках, является активатором плазминогена (фибринолизина). 96% образующейся урокиназы поступает в кровь и 4% выводится с мочой. Урокиназа стимулирует фибринолитическую активность крови. Кроме того, почки активно влияют на свертывание крови, участвуя в регуляции выделения гепарина из организма, а также путем инактивации его почечной гепариназой.
Таким образом, почки выполняют многообразные функции, при нарушении которых возникает почечная недостаточность. Что же такое почечная недостаточность?
Почечная недостаточность – синдром, развивающийся в результате нарушения почечного кровотока, клубочковой фильтрации, канальциевой реабсорбции и секреции, а также концентрационной способности почек. Почечная недостаточность характеризуется гиперазотемией, нарушением вводно-электролитного баланса и кислотно-щелочного равновесия.
В зависимости от скорости возникновения и дальнейшего развития различают острую (она возникает внезапно вследствие острого, чаще всего обратимого поражения почек) и хроническую (развивается постепенно вследствие прогрессирующей необратимой утраты функционирующей паренхимы почек) почечную недостаточность, полную (нарушены все функции) и неполную (парциальную), для которой характерно нарушение лишь некоторых функций почек. Почечная недостаточность может быть скрытой (или компенсированной), которая выявляется при вводно-солевой нагрузке, и декомпенсированной, которая выявляется в покое.
Этиологические факторы, вызывающие почечную патологию, отличаются большим разнообразием. С учебной целью их подразделяют на инфекционные (бактерии, вирусы) и неинфекционные (химические, механические, физические и биологические – например, противопочечные антитела, иммунные комплексы, натуральные киллеры, макрофаги).
По происхождению этиологические факторы подразделяются на первичные (наследственно обусловленные: мутации генов, обеспечивающих функции почек: почечный сахарный диабет, мембранопатии, поликистоз, дисплазии, энзимопатии) и вторичные (приобретенные; они являются наиболее частой причиной почечной патологии).
