
Российский Университет Дружбы Народов
Аграрный факультет
Кафедра морфологии, физиологии животных и ветсанэкспертизы
Курсовая работа по нормальной физиологии
«Гемоглобин. Химическое строение, физиологическое значение»
выполнила Шуралёва Н. И.
группа: СВ-21
руководитель: к.в.н., доцент Забалуев Г.И.
зав. кафедрой: д.в.н., профессор Никитченко В.Е.
дата сдачи – 26.05.2005
личная подпись
г. Москва, 2005г.
ХИМИЧЕСКОЕ СТРОЕНИЕ
Гемоглобин является наиболее распространенным кровяным пигментом. Он содержится в эритроцитах всех позвоночных и некоторых беспозвоночных животных (черви, моллюски, членистоногие, иглокожие), а также в корневых клубеньках некоторых бобовых растений.
В одном эритроците находится 340-400 млн. молекул гемоглобина. [1]
Гемоглобин позвоночных (за исключением круглоротых) – это вещество с молекулярной массой порядка 64 500дальтон, которое с химической точки зрения представляет собой сложный белок – хромопротеид, состоящий из белковой части и небелковой (пигментной) группировки, придающей гемоглобину, а следовательно и крови, красный цвет. [4]
В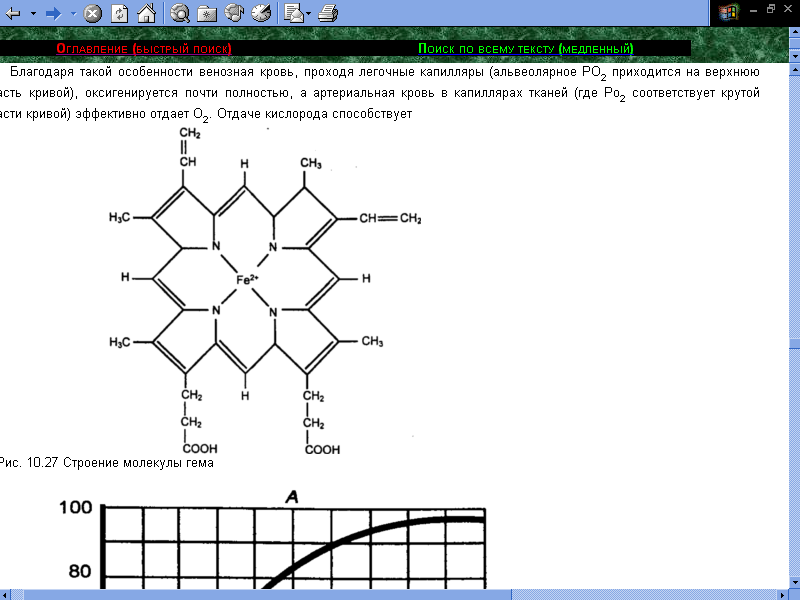 составе гемоглобина различают белокглобин, и
небелковую пигментную группу – гем,
соединенные
между собой гистидиновым мостиком;
каждая молекула гемоглобина содержит
четыре гема и четыре полипептидные
цепи. На долю гема по массе приходится
4% молекулы гемоглобина, глобина - 96 %.
[8]
составе гемоглобина различают белокглобин, и
небелковую пигментную группу – гем,
соединенные
между собой гистидиновым мостиком;
каждая молекула гемоглобина содержит
четыре гема и четыре полипептидные
цепи. На долю гема по массе приходится
4% молекулы гемоглобина, глобина - 96 %.
[8]
Б
Рис.1 Схема строения
гема
Строение небелкового компонента
У всех видов животных гем имеет одинаковое строение, в то время как глобин несколько отличается по аминокислотному составу. [6] Гем в виде гем-порфирина является простетической группой не только гемоглобина и его производных, но и миоглобина, каталазы, пероксидазы и группы цитохромов. [5]
Гем построен из четырёх пирроловых колец и содержит двухвалентное железо. Атом двухвалентного железа образует координационные связи с четырьмя атомами азота, входящими в состав пиррольных группировок, точнее, с двумя атомами азота координационные связи, а с двумя другими – связи с замещением водорода. Оставшиеся две координационные связи используются для присоединения гема к имидазольному кольцу глобина и для связывания кислорода. Структура гема целиком расположена в одной плоскости.
При потере железа гем превращается в гематопорфирин. [5]
Строение белкового компонента, пространственная конфигурация молекулы
Б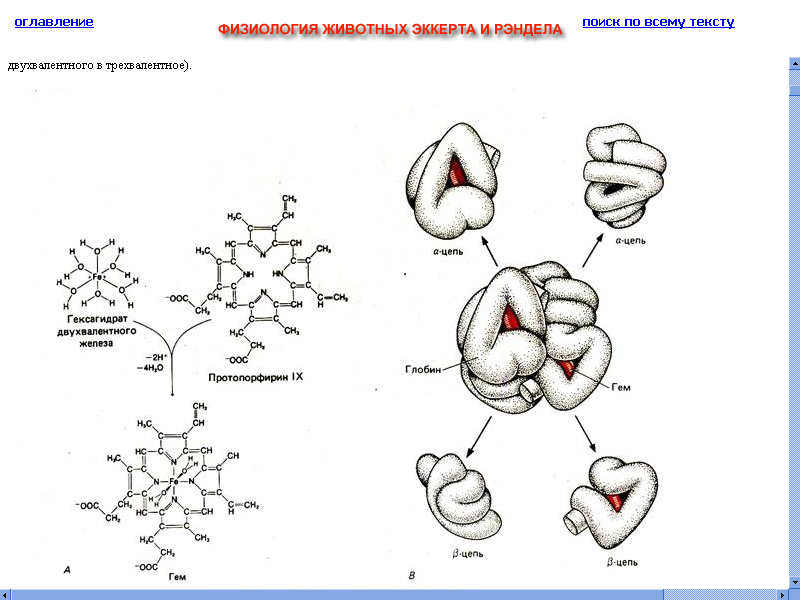 ольшая
часть молекулы гемоглобина, состоящей
примерно из 10000 атомов, приходится на
долю белкового компонента.
ольшая
часть молекулы гемоглобина, состоящей
примерно из 10000 атомов, приходится на
долю белкового компонента.
Э
Рис.2
Схематизированное изображение молекулы
гемоглобина в «разобранном» виде.
(McGilvery, 1970)
При помощи рентгеноструктурного анализа было установлено пространственное расположение этих цепей (Дж. Кендрью, М. Перутц, Нобелевская премия 1962 г.)
Вся молекула имеет приблизительно сферическую форму. Гемовые группы, изображенные в виде красных дисков, располагаются в нишах вблизи поверхности. [3]
Глобин относится к олигомерным белкам (состоящим из нескольких отдельных полипептидных цепей, которые связаны между собой нековалентными связями) и является тетрамером. Молекула состоит из двух одинаковых частей, каждая из которых включает две полипептидные цепи (α–, содержат каждая 141 аминокислотный остаток и β–, содержат по 146 аминокислотных остатков). α– и β–цепи во многом сходны между собой, во многих последовательностях содержат одинаковые аминокислотные последовательности. Соответственно, гемоглобин диссоциирует на четыре субъединицы (протомера) примерно одинакового молекулярного веса, в состав каждой из которых входит одна полипептидная цепь и один гем. [5]
Диссоциация на две α– и две β–цепи как правило обратима, и может быть обусловлена присутствием солей, мочевины или резким изменением рН. После удаления этих факторов происходит автоматическая асоциация исходной молекулы гемоглобина. [5]
Химические свойства
Гемоглобин представляет собой своеобразное химическое вещество, вступающее в обратимое соединение с кислородом при любом его напряжении. [1]
Ключевую роль в активности гемоглобина играет ион железа, расположенный в центре молекулы протопорфирина. В процессе переноса кислорода гемоглобином молекула O2 обратимо связывается с гемом, при этом валентность железа не изменяется.
П
Рис.3 Соединения,
образуемые гемом (железо двухвалентное)
и окисленным гемом (железо трёхвалентное).
Протопорфириновые кольца лежат в одной
плоскости.
Гемоглобин, отдавший кислород, называют дезоксигемоглобином, или редуцированным гемоглобином (Нb). Именно он определяет вишневый цвет венозной крови. [1]
Рис.3 Соединения,
образуемые гемом (железо двухвалентное)
и окисленным гемом (железо трёхвалентное).
Протопорфириновые кольца лежат в одной
плоскости.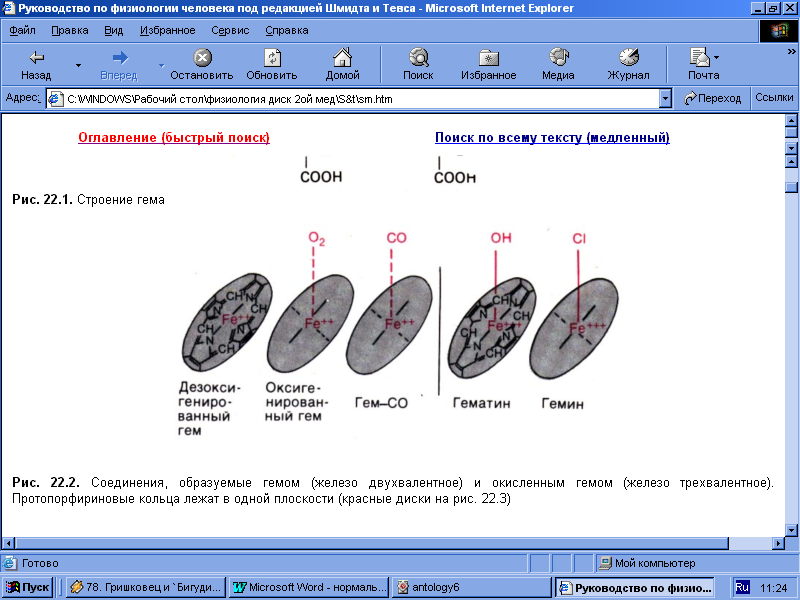
Гем может подвергаться не только оксигенации, но и истинному окислению при действии сильных окислителей, таких как бертолетова соль, нитробензол, анилин и др. При этом железо становится из двухвалентного трехвалентным, гем приобретает коричневую окраску. [6]
Окисленный гем называется гематином (метгемом), а вся полипептидная молекула в целом – метгемоглобином. Метгемоглобин образуется в организме в естественных условиях, однако в эритроцитах содержится фермент метгемоглобинредуктаза, восстанавливающий его до «нормального» гемоглобина с двухвалентным железом. [4] В крови человека и животных метгемоглобин в норме содержится в незначительных количествах, но при некоторых заболеваниях и отравлениях некоторыми токсинами его содержание возрастает. [3]
В результате истинного окисления гемоглобин прочно удерживает кислород и в итоге перестает быть его переносчиком. При наследственной метгемоглобинемии происходит нарушение равновесия между процессами окисления гемоглобина и метгемоглобина и восстановления гемоглобина. [1]
Реакция связывания гемоглобина с СО2. сложнее, чем присоединение 02. Это объясняется прежде всего ролью СO2 в создании кислотно-щелочного равновесия в организме. Механизмы, обеспечивающие транспорт газа, призваны также поддерживать и это равновесие. Гемоглобин, связанный с С02, называют карбогемоглобином. [1]
Гемоглобин особенно легко соединяется с угарным газом — оксидом углерода — СО. Происходит образование карбоксигемоглобина (НbСО), не способного к переносу 02. В этом случае закономерности его реакции те же, что и для кислорода, но химическое сродство СО к гемоглобину почти в 300 раз выше, чем к 02. Это означает, что достаточно в воздухе оказаться небольшому количеству СО, чтобы произошло образование значительного числа связанных молекул гемоглобина. Образовавшееся соединение — блокированный угарным газом гемоглобин — уже не может служить переносчиком кислорода. Так, при концентрации СО в воздухе, равной 0,1%, около 80% гемоглобина крови оказываются связанными не с кислородом, а с угарным газом. В результате в организме возникают тяжелые последствия кислородного голодания (рвота, головная боль, потеря сознания).
Слабые отравления угарным газом являются процессом обратимым: СО постепенно отщепляется и выводится при дыхании свежим воздухом. Использование искусственного дыхания чистым кислородом ускоряет примерно в 20 раз эту реакцию. При концентрации СО, равной 1%, через несколько минут наступает гибель организма. В нормальных условиях на долю НbСО приходится лишь 1% общего количества гемоглобина крови. [1]
При действии соляной кислоты на гемоглобин образуется гемин. В этом соединении железо находится в окисленной трёхвалентной форме. Для его получения каплю высушенной крови нагревают на предметном стекле с кристалликами поваренной соли и 1-2 каплями ледяной уксусной кислоты. Коричневые ромбические кристаллы гемина, хорошо различимые в микроскоп различаются по своей форме у разных видов животных. Данная реакция, получившая название геминовой пробы, может применятся для обнаружения следов крови и их видовой идентификации [6]
