- •2 (АДсорбция газов)
- •3 ( Адсорбция на неподвижной поверхности раздела фаз)
- •По агрегатному состоянию фаз
- •9,Тонкослойная хроматография (тсх) является планарной разновидностью жидкостной хроматографии , в которой подвижная фаза (пф) движется в пористой среде адсорбента
- •13. Кондуктометрические методы анализа основаны на измерении электропроводности исследуемых растворов. Существует несколько методов кондуктометрического анализа:
- •14)Электрическая проводимость биологических объектов и её использование в мед.Практике
- •22Ионоселективные электроды
13. Кондуктометрические методы анализа основаны на измерении электропроводности исследуемых растворов. Существует несколько методов кондуктометрического анализа:
· прямая кондуктометрия - метод, позволяющий непосредственно определять концентрацию электролита путем измерения электропроводности раствора с известным качественным составом;
· кондуктометрическое титрование - метод анализа, основанный на определении содержания вещества по излому кривой титрования. Кривую строят по измерениям удельной электропроводности анализируемого раствора, меняющейся в результате химических реакций в процессе титрования;
· хронокондуктометрическое титрование - основано на определении содержания вещества по затраченному на титрование времени, автоматически фиксируемого на диаграммной ленте регистратора кривой титрования.
Кондуктометрия используется в работе анализаторов детергентов в сточных водах, при определении концентраций синтетических удобрений в оросительных системах, при оценке качества питьевой воды. В дополнение к прямой кондуктометрии для определения некоторых видов загрязнителей могут быть использованы косвенные методы, в которых определяемые вещества взаимодействуют перед измерением со специально подобранными реагентами и регистрируемое изменение электропроводности вызывается только присутствием соответствующих продуктов реакции. Кроме классических вариантов кондуктометрии применяют и ее высокочастотный вариант (осциллометрию), в котором индикаторная электродная система реализуется в кондуктометрических анализаторах непрерывного действия.
14)Электрическая проводимость биологических объектов и её использование в мед.Практике
Кондуктометрический метод анализа основан на измерении электрической проводимости ( электропроводности) растворов. Растворение в воде электролитов характеризуется появлением ионов, что обусловливает электрическую проводимость растворов. Эта величина зависит от состава раствора и концентрации.; это-количественная характеристика способности живых объектов (тканей) проводить электрический ток. Электропроводность обратно пропорциональна величине электрического сопротивления системы.
В медицине и биологии электропроводность биологических систем чаще всего исследуют в области так наз. р-дисперсии, которая наблюдается в диапазоне частот 102—108 гц и определяется поляризацией границ раздела и неоднородностью структуры объекта. Измерения электропроводность биологических систем.показали, что по мере повышения частоты электропроводность возрастает, достигая предельной величины. При переживании и отмирании ткани возрастает электропроводность биологических систем на низких частотах. Это связано с тем, что при отмирании ткани растет проницаемость мембран для ионов, и они уже не являются границей, на которой может происходить поляризация;может быть использовано при исследовании проницаемости клеточных мембран и других границ раздела в клетках, тканях, органах.
15. Электролиты — это вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания и соли. Электролиты выполняют в организме важную роль: отвечают за осмолярность и величину ионной силы биосред, образуют биоэлектрический потенциал, катализируют процессы обмена веществ, стабилизируют определенные ткани (костная), служат в качестве энергетических депо (фосфаты), участвуют в свертывающей системе крови.
Слюна является ионодисперсным раствором и обладает свойствами электролитов. Количество ионов Н+ и ОН" определяет рН слюны, который в норме равен 6,9. Величина водородного показателя изменяется в зависимости от характера патологического процесса в полости рта. Так. при инфекционных заболеваниях реакция слюны кислая; при ряде общих заболеваний, например, при нефрите, сопровождающемся уремией, в слюне возрастает количество остаточного азота; содержание азота увеличивается также при язвенной болезни желудка и двенадцатиперстной кишки; при инсульте слюнные железы на стороне кровоизлияния выделяют слюну с повышенным количеством белка. Таким образом, исследование состава слюны можно предпринимать с диагностической целью. Кроме того, изменения состава слюны как при общих болезнях, так и при старении организма ведут к отложению зубного камня, что является предрасполагающим фактором в возникновении воспалительных заболеваний па-родонта. Чувствительность слизистой оболочки полости рта отличается от чувствительности других слизистых оболочек и кожи. В слизистой оболочке полости рта заложены рецепторы, обеспечивающие вкусовую, болевую, холодовую, тепловую, тактильную, мышечную чувствительность. Вкусовые рецепторы заножены в основном в сосочках языка. Тактильная чувствительность наиболее выражена в красной кайме губ и особенно в кончике языка. Болевая чувствительность в основном выражена слабо, несколько лучше она развита на нёбных дужках, мягком нёбе, в преддверии полости рта. Температурная рецепция неодинакова на разных участках: например, на дне полости рта и дёснах она совсем отсутствует. Порог температурной чувствительности слизистой оболочки значитель- но ниже, чем кожи, причем холодовая чувствительность лучше развита, чем тепловая.
16. ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом . Возникновение электродного потенциала обусловлено пространств. разделением зарядов противоположного знака на границе раздела фаз и
Электрохимические электроды подразделяют на два основных типа:
обратимые электроды и необратимые электроды.
На обратимых электродах при изменении направления тока протекает таже реакция, но в обратном направлении. На необратимых электродах при перемене направления тока возникает новый химический процесс. По природе окислителей и восстановителей, которые участвуют в электродном процессе, обратимые электроды подразделяются на следующиеклассы:
а) Электроды 1-го рода – металл в контакте с раствором своей соли. Эти электроды являются основой конструкций большинства гальванически элементов.
б) Электроды 2-го рода – на поверхность металла наносится слой его труднорастворимой соли, а раствор содержит анионы этой соли. Используются для определения произведения растворимости (ПР) солей.
в) Электроды 3-го рода (окислительно-восстановительные электроды) –платиновая пластина, погруженная в раствор смеси веществ, содержащей химический элемент в различных степенях окисления. С помощью таких электродов определяются электрохимические потенциалы окислительно-восстановительных реакций.
г) Ионообменные (ионоселективные) электроды – мембранные конструкции, содержащие растворы солей, ионы которых могут проходить сквозь мембрану. Применяются для измерения концентраций ионов.
Стандартный электродный потенциал.
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H−(−2,23 В), Na+(−2,71 В), Li+(−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гибса ΔGo должна быть отрицательной, в соответствии со следующим уравнением: ΔGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянная фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила: если Eoяч> 0, тогда процесс самопроизвольный)
если Eoяч< 0, тогда процесс несамопроизвольный

18

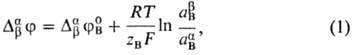
где F-число Фарадея, R-газовая постоянная, Т-абс. т-ра, Bb, Ba - активности иона В в р-рах b и a, DabjB -стандартный потенциал распределения иона В, равный
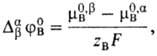
где m0,bB, m0,aB -стандартные хим. потенциалы иона В в р-рах b и a соответственно. В такой системе М. п. не зависит от толщины мембраны и ее структуры, механизма переноса иона и его подвижности.
Мембрана живой клетки поляризована
Мембрана обладает избирательной проницаемостью
Мембрана возбудимой клетки способна быстро менять свою проницаемостъ
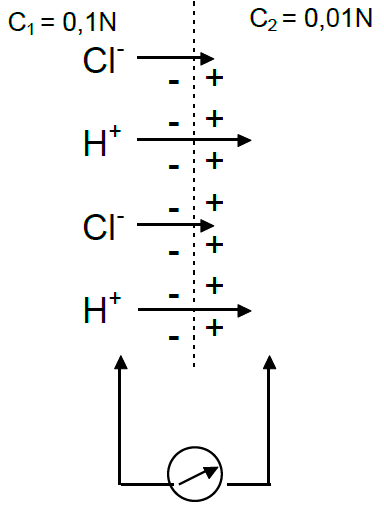
19. Мембранный диффузионный потенциал
Рисунок 1 - Возникновение диффузионного потенциала на мембране |
Для его возникновения необходим контакт электролитов с различной концентрацией и различной подвижностью анионов и катионов. Например, ионов водорода и хлора (рис. 1.). Граница раздела одинаково проницаема для обоих ионов. Переход ионов H+ и Cl- будет осуществляться в сторону меньшей концентрации. Подвижность Н+ при перемещении через мембрану намного выше Cl-, в силу этого, будет создаваться большая концентрация ионов с правой стороны от границы раздела электролитов, возникнет разность потенциалов.
Возникающий потенциал (поляризация мембраны) тормозит дальнейший перенос ионов, так что, в конце концов, суммарный ток через мембрану прекратится.
В растительных клетках главные потоки ионов – это потоки К+, Na+, Cl-; они в значительных количествах содержаться внутри и снаружи клетки.
Учитывая концентрации этих трёх ионов, их коэффициенты проницаемости, можно рассчитать величину мембранного потенциала, обусловленного неравномерным распределением этих ионов. Это уравнение получило название уравнение Гольдмана, или уравнение постоянного поля:
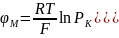
где φM - разность потенциалов, В;
R - газовая постоянная, T - температура; F - число Фарадея;
P - проницаемость иона;
[K+]0 - концентрация иона снаружи клетки;
[K+]i - концентрация иона внутри клетки;