
- •1.2 Материальный баланс.
- •1.3 Уравнения рабочих и равновесных линий.
- •1.4 Различные модификации уравнений массоотдачи и массопередачи.
- •1.4.1 Уравнения массоотдачи и массопередачи в локальной форме.
- •Соответственно. Используя допущение об отсутствие сопротивления переносу вещества со стороны межфазной поверхности равновесии на границе раздела фаз, запишем:
- •1.4.2 Интегральная форма уравнений массоотдачи и массопередачи
- •1.4.3 Объёмные коэффициенты массоотдачи и массопередачи.
- •1.4.4 Число и высота единиц переноса
- •1.5 Аналогия тепло - и массообмена.
- •1.6 Упрощенные модели массоотдачи.
- •1.7. Классификация и основы расчета массообменных аппаратов.
- •1.7.1 Технологический расчет аппарата с непрерывным контактом фаз
- •Используя величину удельной поверхности контакта фаз вначале можно определить рабочий объем аппарата:
- •1.7.2 Технологический расчет аппарата со ступенчатым контактом фаз.
- •2. Абсорбция.
- •2.1. Равновесие при абсорбции. Закон Генри.
- •2.2. Материальный баланс и расход абсорбента
- •2.3 Тепловой баланс абсорбции.
- •2.4 Кинетика абсорбции.
- •2.5 Конструкции абсорберов.
- •Плёночные абсорберы.
- •Насадочные абсорберы.
- •Выбор насадки.
- •Тарельчатые абсорберы.
- •Распыливающие аппараты.
- •3. Перегонка жидкостей.
- •3.1. Равновесие в системах жидкость – пар.
- •3.2 Простая перегонка(дистилляция).
- •Однократная дистилляция.
- •Постепенная дистилляция.
- •Материальный баланс постепенной дистилляции.
- •3.4.Ректификация.
- •3.4.1. Материальный баланс непрерывной ректификации бинарных смесей.
- •Материальный баланс колонны по всему потоку:
- •Материальный баланс по нк:
- •Уравнения рабочих линий.
- •Выбор флегмовога числа.
- •3.4.2. Тепловой баланс ректификационной колонны.
- •3.5 Периодическая ректификация
- •3.6. Ректификация многокомпонентных смесей.
- •3.7. Экстрактивная и азеотропная ректификация.
- •3.8. Ректификационные установки.
- •4. Экстракция.
- •4.1.Жидкостная экстракция
- •4.1.1 Равновесия в системе жидкость – жидкость.
- •4.1.2 Материальный баланс процесса жидкостной экстракции. Однократная (одноступенчатая) экстракция.
- •4.1.3 Кинетика жидкостной экстракции.
- •4.1.3 Основные способы проведения жидкостной экстракции. Однократная (одноступенчатая) экстракция.
- •Многоступенчатая экстракция с перекрестным током растворителя.
- •Многократная экстракция с противоточным движением растворителя.
- •Непрерывная противоточная экстракция.
- •4.1.4. Классификация и конструкции экстракторов
- •4.1.4.1. Ступенчатые экстракторы
- •4.1.4.2 Дифференциально-контактные экстракторы. Экстракторы без подвода дополнительной энергии.
- •Экстракторы с подводом дополнительной энергии.
- •4.2. Экстрагирование в системе твердое тело – жидкость (выщелачивание).
- •4.2.1 Экстрагирование растворенного вещества.
- •4.2.2 Экстрагирование твердого вещества.
- •4.2.3. Способы и схемы экстрагирования.
- •5. Сушка.
- •5.1. Параметры влажного воздуха.
- •5.2. Диаграмма состояния влажного воздуха.
- •5.3 Равновесие при сушке.
- •5.4. Формы связи влаги с материалом.
- •5.4.1. Перемещение влаги внутри твердого материала
- •5.5 Материальный баланс конвективной сушки.
- •5.6 Тепловой баланс конвективной сушки.
- •5.7 Кинетика процесса конвективной сушки.
- •5.8. Устройство и принцип действия сушилок.
- •6.1 Адсорбенты.
- •6.2 Равновесие при адсорбции.
- •6.3 Материальный баланс адсорбции.
- •6.4. Кинетика периодической адсорбции.
- •6.5. Непрерывная адсорбция
- •6.6. Десорбция
- •6.7. Устройство и принципы действия адсорбционных аппаратов.
- •7. Кристаллизация.
- •7.1 Равновесие при кристаллизации.
- •7.2. Кинетика процессов кристаллизации.
- •7.3. Материальный и тепловой балансы кристаллизации. Материальный баланс.
- •7.4. Конструкции кристаллизаторов.
- •8. Мембранные процессы.
- •8.1. Классификация методов мембранного разделения. Типы мембран.
- •8.2. Механизм и кинетика мембранных процессов.
- •8.2.1. Баромембранные процессы.
- •8.2.2. Диффузионно-мембранные процессы.
- •8.2.3. Элетромембранные процессы.
- •8.2.4. Термомембранные процессы.
- •8.3. Конструкции мембранных аппаратов.
3.8. Ректификационные установки.
Основное оборудование ректификационных установок – колонна, кипятильник и дефлегматор. Ректификационные колонны – тарельчатые и насадочные колонны, которые по устройству принципиально не отличаются от абсорберов. Пленочные колонны применяются при ректификации под вакуумом. Основной особенностью ректификационных колонн состоит в том, что они покрыты тепловой изоляцией. В качестве кипятильника используется кожухотрубчатые и змеевиковые теплообменники, а в качестве дефлегматоров (конденсаторов) – кожухотрубчатые теплообменники.
4. Экстракция.
Экстракция – процесс извлечения одного или нескольких компонентов из растворов или твердых тел с помощью избирательных растворителей (экстрагентов). При взаимодействии с экстрагентом в нем хорошо растворяются только извлекаемые компоненты и значительно слабее или практически вовсе не растворяются остальные компоненты исходной смеси. Экстракцию из твердых тел жидкостью (растворителем) называют экстрагированием. Если в этом процессе в качестве растворителя используется вода, то такой процесс называется выщелачиванием. В химической технологии экстракция из растворов экстрагентами более распространена, чем экстракция из твердых тел.
4.1.Жидкостная экстракция
Процессы жидкостной экстракции применяются в химической, нефтехимической, фармацевтической, гидрометаллургической и других отраслях промышленности получении редких и рассеянных элементов из растворов. Жидкостная экстракция, наряду с перегонкой, является одним из основных методов разделения однородных жидких смесей. Процесс экстракции обычно экономически выгоднее ректификации, поскольку при экстракции не нужно испарять всю жидкую смесь. Обычно жидкостную экстракцию с сочетают с ректификацией, которую применяют для регенерации экстрагента. Экстракт – раствор извлеченных веществ в экстрагенте, рафинат – остаточный исходный раствор.
На
рис. 4.1 представлена схема без регенерации.
Чаще всего используются схемы с
регенерацией экстрагента. Исходный
раствор
![]() и экстрагент
и экстрагент
![]() подается в экстракционный аппарат –
экстрактор, в котором происходит перенос
вещества М из фазы
подается в экстракционный аппарат –
экстрактор, в котором происходит перенос
вещества М из фазы
![]() в фазу
в фазу
![]() .
В результате, получают экстракт
.
В результате, получают экстракт
![]() и
рафинат
.
и
рафинат
.
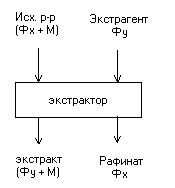
Рис. 4.1. Схема проведения экстракции.
4.1.1 Равновесия в системе жидкость – жидкость.
Для
трехкомпонентной системы жидкость –
распределяемое вещество–жидкость
![]() можно изменять концентрацию одной из
фаз без нарушения равновесия. По правилу
фаз Гиббса:
можно изменять концентрацию одной из
фаз без нарушения равновесия. По правилу
фаз Гиббса:
![]()
В
процессе жидкостной экстракции обычно
Т не меняется, Р на равновесие системы
не влияет. По этому для экстракции
![]() .
.
Данной
концентрации распределяемого вещества
х в одной фазе в состоянии равновесия
соответствует определенная концентрация
![]() вещества в другой фазе. Эта связь
соответствует закону распределения:
отношение равновесных концентраций
распределяемого между двумя жидкими
фазами вещества при Т=const
есть величина постоянная:
вещества в другой фазе. Эта связь
соответствует закону распределения:
отношение равновесных концентраций
распределяемого между двумя жидкими
фазами вещества при Т=const
есть величина постоянная:
![]() или
или
![]() (4.1)
(4.1)
где у* и х – равновесные концентрации распределяемого вещества соответственно в экстракте и рафинате, m – коэффициент распределения.
По формуле (4.1) линия равновесия должна быть прямой, выходящей из начала координат. Однако это справедливо для случая полной взаимной нерастворимости участвующих в процессе фаз, что довольно редко встречается в реальных условиях. Обычно m зависит от концентрации распределяемого вещества при Т=const, если же меняется и Т, то величина m может меняться еще сильнее.
Линии равновесия на диаграмме у-х при постоянной темпиратупе называют изотермами экстракции (рис. 4.2). Если известны изотермы для разных Т, то становится возможным выбрать наиболее приемлемое Т.
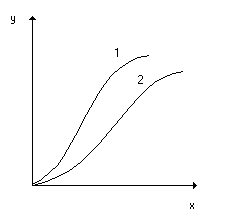
Рис.4.2. Типичные изотермы экстракции неэлектролитов (1) и электролитов (2).
Треугольные диаграммы. Составы тройных смесей в состоянии равновесия удобно изображать в треугольной диаграмме Гиббса. Отметим, что часто фазы, участвующие в процессе экстракции, частично растворимы друг в друге. Тогда экстракт помимо экстрагента и растворенного вещества содержит еще некоторое количество растворителя из исходного раствора, а рафинат помимо первоначального раствора и некоторого количества растворенного вещества – определенное количество экстрагента. Оба раствора состоят из трех компонентов.
А, В, С – чистые компоненты. В точке А – чистый Фх, в точке В – чистый М, в точке С – чистый Фу. Точки на площади треугольника соответствуют составам трехкомпонентных растворов.
Определим
концентрации компонентов в точке М. Для
этого через точку М проведем параллельные
линии к линиям АВ, ВС и АС до пересечения.
При этом отрезок
![]() определяет концентрацию компонент А в
точке М,
определяет концентрацию компонент А в
точке М,
![]() – компонента В,
– компонента В,
![]() – компонента С.
– компонента С.
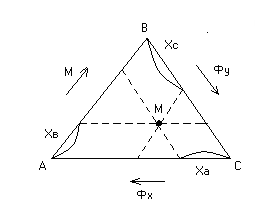
Рис. 4.3. Треугольная диаграмма.
С помощью треугольных диаграмм, используя правила рычага, можно достаточно просто определить не только состав, но и количество (массу) фаз (рис.4.4).
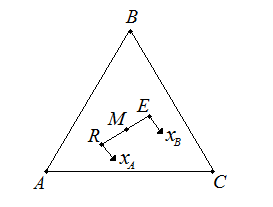
Рис.4.4. Правила рычага на треугольной диаграмме.
Средний
состав смеси, образующихся при смешении
двух трехкомпонентных смесей (например,
состава R
и E)
лежит на отрезке прямой, соединяющей
эти точки (например, состава М). Эта точка
М по правилу рычага разделяет отрезок
на отрезки, обратно пропорциональные
количествам (массам) исходных смесей.
При разделении М кг смеси
![]() по правилу рычага имеем:
по правилу рычага имеем:
 (4.2)
(4.2)
где R и E – количества рафината и экстракта соответственно, кг. Выражение (4.2) позволяет найти положение точки М, если известны количества растворов R и E.
При расчете процесса экстракции, как и для любого массообменного процесса, необходимо знание равновесных концентраций. Рассмотрим кривую равновесия в треугольной диаграмме.
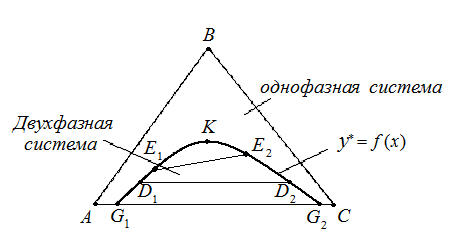
Рис. 4.5. Равновесная кривая в треугольной диаграмме.
А – 100% - растворитель в исходном растворе, В – 100% - растворенное вещество, С – 100% - экстрагент.
Линии АВ, ВС, СА – характеризуют состав двухкомпонентных растворов. Пусть А и В, В и С, неограниченно растворимы друг в друге, а А и С – ограниченно растворимы. На участке G1 и G2 любая смесь компонентов А и С расслаивается на два однородных двухкомпонентных раствора, состава которых отвечают точкам G1 и G2 . Если к ним добавить В, получим трехкомпонентный расслаивающий раствор соответствующий точкам D1 и D2. Хорда соединяющие точки D1 и D2 соответствует растворам, находящихся в равновесии друг с другом. При дальнейшим добавлении компонента В получим расслаивающиеся системы характеризующиеся точкам Е1 и Е2 и т.д. Эти точки постепенно сближаются, наконец соединятся в точке К. Точка К– критическая точка, соответствует однофазному раствору.
Соединяя точки G1 , D1 , Е1 , … , G2 , D2 , Е2 и т.д. получают равновесную (бинодальную) кривую, выше которой система однофазна и для процесса экстракции интереса не представляет.
Хорды, соединяющие точки D1 и D2 , E1 и E2 и т.д. на бинодальной кривой, называют конодами, которые непараллельны друг другу, так как компонент В неравномерно распределяется между компонентами А и С. Любая точка, лежащая на площади, ограниченной равновесной кривой кривой, соответствует двухфазной системе
Взаимная растворимость с увеличением температуры повышается, поэтому область существования гетерогенных систем уменьшается. При высоких температурах может вообще исчезнуть (точка Ткр на рис. 4.6).
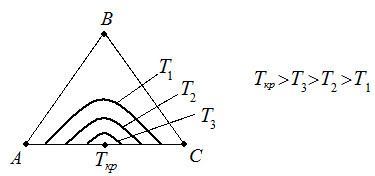
Рис. 4.6. Влияние Т на равновесную кривую.
Селективность
экстрагента. Основным
свойством экстрагента является
селективность, которая характеризует
его способность преимущественно
извлекать один из двух, трех и более
компонентов раствора. Селективность С
по отношению к В выражается отношением
концентраций компонентов В и А в фазе
экстракта
![]() ,
разделенным на отношение концентраций
в фазе рафината
,
разделенным на отношение концентраций
в фазе рафината
![]() .
Селективность экстрагирования по
отношению к распределяемому компоненту
характеризуется коэффициентом
селективности (коэффициент разделения)
.
Селективность экстрагирования по
отношению к распределяемому компоненту
характеризуется коэффициентом
селективности (коэффициент разделения)
![]() :
:
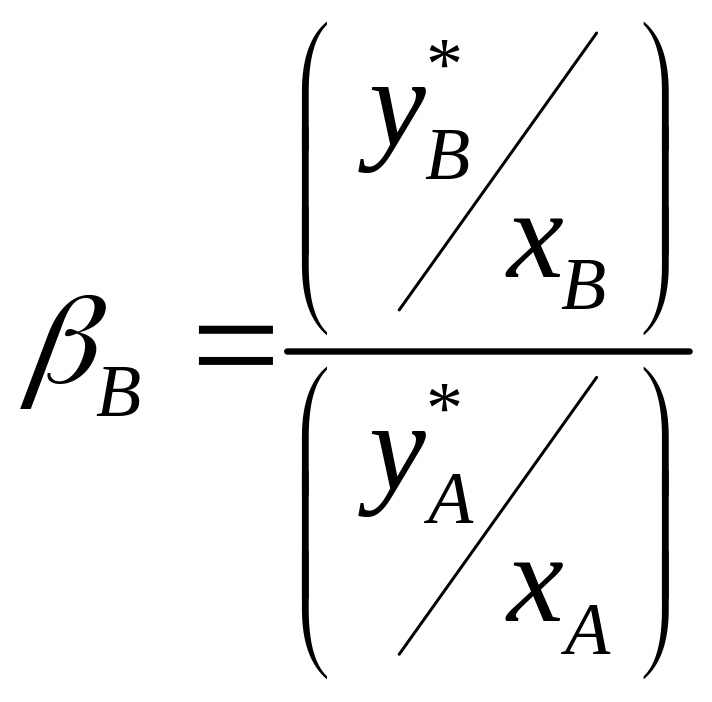 (4.3)
(4.3)
или с учетом (4.1)
![]() (4.4)
(4.4)
Как
видно, чем больше
![]() тем больше
.
Если
=1,
то селективность равна 0. В реальных
условиях
больше 2. Увеличение
можно добиться изменением рН раствора.
тем больше
.
Если
=1,
то селективность равна 0. В реальных
условиях
больше 2. Увеличение
можно добиться изменением рН раствора.
