
- •Тема 1. Введення в фізико-хімічні методи аналізу.
- •Тема 2. Основи спектроскопії
- •2.1. Характеристика і діапазони електромагнітного випромінювання
- •Тема 3. Рефрактометричний метод аналізу
- •1. Суть рефрактометричних методів аналізу.
- •2. Показник заломлення.
- •3. Вимірювання показника заломлення.
- •3.1. Граничний кут заломлення
- •3.2. Граничний кут повного внутрішнього відбивання.
- •4. Дисперсія речовини і молекулярна рефракція.
- •4. Практичне застосування рефрактометричним вимірів.
- •4.1. Аналіз двокомпонентних систем.
- •4.2. Аналіз трикомпонентних систем.
- •Тема 4. Молекулярно-абсорбційна оптична спектроскопія
- •Загальна характеристика абсорбційних оптичних методів
- •Повна енергiя молекули як сума трьох складових.
- •Особливостi молекулярних спектрiв в уф I видимій областях спектру.
- •Види спектрів
- •Основний закон світлопоглинання (Бугера-Ламберта-Бера)
- •Прилади абсорбційної спектроскопії
- •Кількісний фотоколориметричний аналіз. Фотометричні реакції
- •Вибір оптимальних умов утворення забарвлених сполук
- •Умови фотометрування.
- •13.Переваги та недоліки фотометричних методів
- •Тема 5. Люмінісцетний аналіз
- •5.1. Суть методу.
- •5.2. Механізм люмінесценції
- •5.3. Характеристики люмінесценції
- •5.4. Основні закони люмінесценції
- •Закон Стокса–Ломмеля.
- •Правило дзеркальної симетрії Льовшина.
- •Закон Вавілова с.І.
- •5.5. Гасіння люмінесценції.
- •5.6. Якісний і кількісний люмінесцентний аналіз
- •5.7. Обладнання для проведення люмінесцентного аналізу.
- •Тема 7. Хроматографія
- •7.1. Основні поняття хроматографії
- •1.Суть і особливості хроматографічних методів аналізу
- •2.Основні етапи розвитку хроматографії (на самостійне опрацювання)
- •Класифікація хроматографічних методів аналізу
- •IV. За методикою проведення аналізу:
- •Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
- •5. Сорбція та розподіл молекул між фазами
- •5.1. Сили міжмолекулярної взаємодії.
- •7.2. Основні положення теорії хроматографічного аналізу
- •Хроматограма та її характеристики
- •Пояснення причин розмивання хроматографічних піків.
- •Селективність колонки
- •Ефективність хроматографічного розділення. Теорія еквівалентних тарілок.
- •Дифузійна (кінетична) теорія
- •Критерій розділення.
- •Вибір температури
- •Газова хроматографія
- •1. 3Агальні положення. Рухома фаза у газовій хроматографії
- •2. Вплив різних факторів на хроматографічне розділення суміші речовин
- •2.1. Вплив швидкості потоку і тиску газу-носія на ефективність розділення.
- •2.3. Хроматографія з програмуванням температури.
- •3. Особливості газоадсорбційної хроматографії. Адсорбенти
- •4. Особливості газорідинної хроматографії
- •Іонообмінна хроматографія
- •1. Загальні відомості. Іонний обмін як принцип розділення.
- •2. Класифікація та властивості іонообмінних сорбентів
- •3. Основні властивості іонітів
- •5.4. Підготовка іонообмінних смол (самостійно з лабораторної роботи)
- •5.5. Застосування іонообмінної хроматографії
4.2. Аналіз трикомпонентних систем.
Залежність між величиною показника заломлення та складом використовується і при аналізі трикомпонентних систем, однак тут ця залежність має більш складний характер. У цьому випадки завжди є ряд сумішей різного складу, що володіють деяким однаковим для всіх цих сумішей показником заломлення. Тому для однозначного визначення вмісту компонентів в суміші необхідно вимір ще однієї з властивостей системи, наприклад, густини. Деякого даному значенням густини також будуть відповідати різні за своїм складом суміші, що володіють, однак, різною заломлюючої здатністю. І тільки поєднання двох параметрів – певних чисельних значень показника заломлення і густини – відповідає цілком певний, єдиноможливий склад системи.
Практично робять так: готують стадартні розчини з відомим вмістом компонентів і визначають для них величини показників заломлення. Отримані дані можна згрупувати таким чином, щоб виділити всі показники заломлення, які відповідають певному значенню густини і побудувати два графіки, які показують залежнсть величини показника заломлення (при даній густині) від вмісту якого-небудь одного, а потім і іншого компонента. Визначивши показник заломлення і густину досліджуваного розчину, встановлюють вміст того і іншого компонента за ізоденсами (криві однакової густини) в залежності від величини показника заломлення.
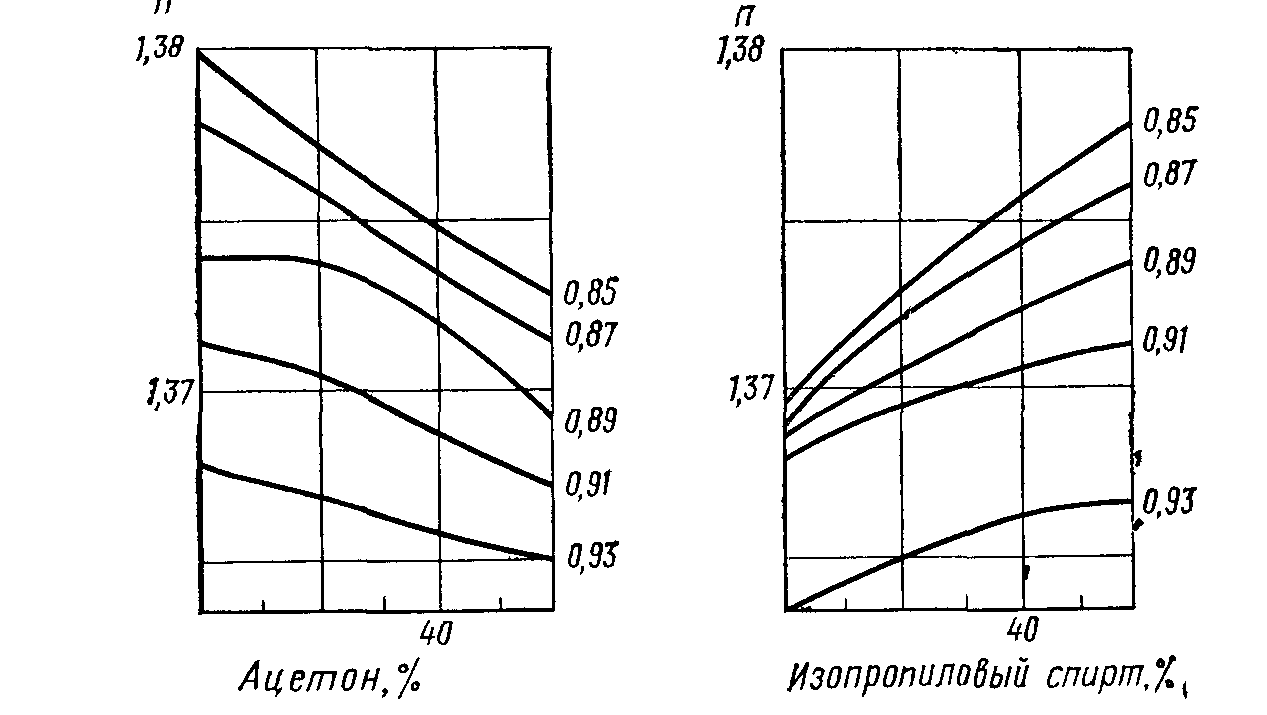
Рис. 6. Діаграми для рефрактометричного аналізу трійних систем
На рис. 6 представлені графіки для розчину ацетону і ізопропілового спирту у воді. Якщо коефіцієнт заломлення деякого розчину, який має густину 0,85 становить 1,375, то згідно рис. 6 ацетону в ньому близько 40 % і ізопропілового спирту стільки ж. Вміст третього компонента – води – може бути легко знайдено за різницею і складає відповідно близько 20 %.
Тема 4. Молекулярно-абсорбційна оптична спектроскопія
Загальна характеристика абсорбційних оптичних методів
Для хімічного аналізу використовуються закономірності як випромінювання електромагнітних хвиль об'єктом аналізу, так і взаємодії випромінювання від стороннього джерела з матеріалом об'єкту аналізу.
Методи аналізу, які ґрунтуються на поглинанні світлової енерґії атомами і молекулами речовин, що аналізуються, об’єднуються в загальну групу абсорбційних оптичних методів. Ці методи мають широке застосування як на промислових підприємствах, так і в науково-дослідних лабораторіях.
При поглинанні світла атоми і молекули речовин переходять в новий енерґетично-збуджений стан. Надлишкова енерґія атомів і молекул в одних випадках витрачається на підвищення їх поступальної, обертальної або коливальної енерґії, в інших — виділяється у вигляді вторинного випромінювання або витрачається на фотохімічні реакції. Залежно від вигляду поглинаючих частинок і від способу трансформування надлишкової енерґії збудження розрізняють:
1. Атомно-абсорбційний аналіз, що ґрунтується на поглинанні світлової енерґії атомами аналізованої речовини.
2. Молекулярний абсорбційний аналіз, що ґрунтується на вибірковому поглинанні світла молекулами речовини або складними йонами в ультрафіолетовій, видимій та інфрачервоній областях спектра – оптичний діапазон ЕВ (спектрофотометрія, фотоколориметрія, ІЧ-спектроскопія). Часто фотоколориметричний і спектрофотометричний методи об’єднують в групу, яку називають фотометричними методами аналізу.
3. Турбідиметрія та нефелометрія — ґрунтуються на поглинанні та розсіюванні світла диспергованими частинками аналізованої речовини.
4. Люмінесцентний (флуорометричний) аналіз, ґрунтується на вимірюванні випромінювання, яке виникає в результаті виділення надлишку енерґії збудженими молекулами аналізованої речовини.
Схема електронних рiвнiв молекули.
Молекула може поглинати випромінювання в результаті трьох основних процесів. В будь-якому випадку вона при цьому переходить в стан з більш високою внутрішньою енергією, причому приріст енергії рівний енергії фотону поглинутого випромінювання (hν).
Три типи внутрішньої енергії молекули квантуються – це значить, що енергія може приймати тільки певні значення, утворюючи систему дискретних рівнів.
Розглянемо типи електронів в молекулі і структуру енергетичних рівнів молекули, яка складається з атомів, пов'язаних між собою хімічними зв'язками.
Електрони в молекулі можна класифікувати за 4 типами:
Електрони заповнених рівнів. Енергії їх збудження дуже високі, і вони не вносять вклад в поглинання у видимій і УФ-областях.
Електрони ковалентних одинарних зв’язків (σ-зв’язків), наприклад, одинарні зв’язки в насичених вуглеводнях –СН2–СН2–). Їх енергії збудження також дуже великі, щоб давати вклад в поглинання у видимій і УФ-областях),
Електрони вільних (незв’язуючих) електронних пар валентної оболонки атомів (n-електрони), анаприклад, в атомах N, О, S і галогенів. Ці електрони зв’язані слабше, ніж σ-електрони, і можуть збуджуватися під дією видимого і УФ-випромінювання.
Електрони π-орбіталей (π-електрони), наприклад, подвійних і потрійних зв’язків. Ці електрони збуджуються найлегше і зумовлюють більшість електронних спектрів поглинання у видимій і УФ-областях.
Електрони розміщуються на орбіталях. В молекулі є також незаселені в нормальному стані орбіталі, які називаються розпушеними. Вони відповідають енергетичному рівням збуджених станів і позначаються як σ*- або π*-орбіталі. Поглинання випромінювання призводить до переходу електрону на розпушуючу орбіталь. Найчастіше здійснюються переходи з π- і валентних (n) орбіталей на π*-розпушуючі орбіталі: π → π* або n → π* відповідно. Незв’язуючі n-електрони під дією короткохвильового випромінювання (довжини хвилы менше 200 нм) можуть також збуджуватися до розпушуючих σ*-станів: n → σ*.
Переходи типів π → π* або n → π* характерні для молекул кетонів.
Електронні переходи можна представити з допомогою схеми валентних зв’язків:
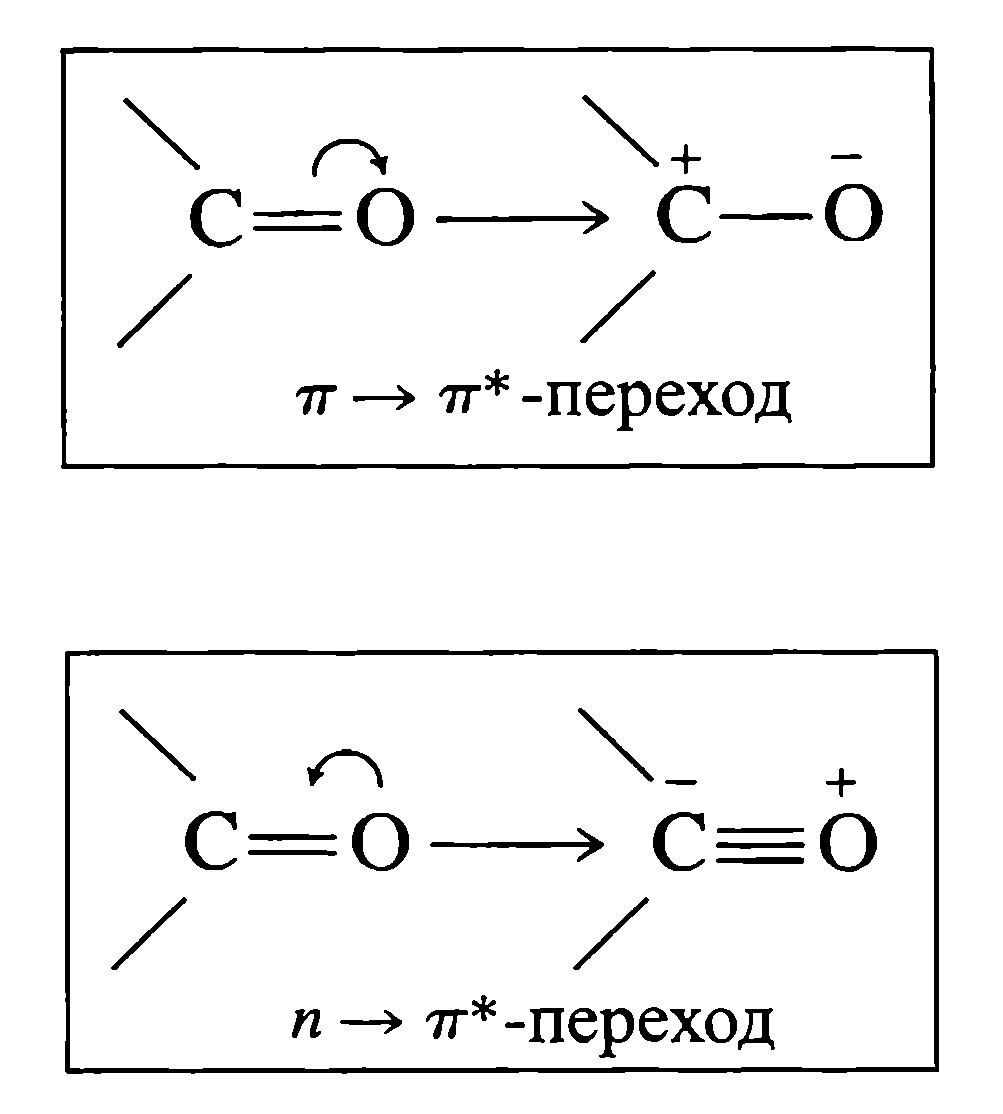
Наприклад, для простих ефірів (R-O-R') характерні переходи n → π* типу, однак вони відбуваються під дією випромінювання з довжиною хвилі менше 200 нм, тому прості ефіри, а також прості тіоефіри (R-S-R'), дисульфіди (R-S-S-R) , алкіл аміни (R-NH2) і алкілгалогеніди (R-X) прозорі (тобто не мають смуг поглинання) у видимій і УФ-областях.
Ймовірність переходів π → π* вища, ніж n → π*; інтенсивність смуг поглинання для перших вища. Типові значення молярного коефіцієнта поглинання – кількісного критерію інтенсивності смуги – у максимумах смуг π → π*-перехходів складає від 1000 до 10000, в той час як для n → π*-переходів вони менше 1000.
Електронні переходи, викликані поглинанням строго певних квантів світлової енерґії, характеризуються появою строго певних смуг поглинання в електронних спектрах поглинаючих молекул. Причому поглинання світла відбувається тільки в тих випадках, коли енерґія кванта співпадає з різницею енерґій (ΔЕ) між квантованими енерґетичними рівнями в кінцевому (Е2) і початковому (Е1) станах поглинаючої молекули:
hν = ΔЕ = Е2 – Е1 (1)
де h — постійна Планка (h = 6.62510–34 Джс); ν — частота випромінювання, що поглинається, яка визначається енерґією поглиненого кванта і виражається відношенням швидкості світла у вакуумі с = 31010 см/с до довжини хвилі (λ).
