
- •Тема 1. Введення в фізико-хімічні методи аналізу.
- •Тема 2. Основи спектроскопії
- •2.1. Характеристика і діапазони електромагнітного випромінювання
- •Тема 3. Рефрактометричний метод аналізу
- •1. Суть рефрактометричних методів аналізу.
- •2. Показник заломлення.
- •3. Вимірювання показника заломлення.
- •3.1. Граничний кут заломлення
- •3.2. Граничний кут повного внутрішнього відбивання.
- •4. Дисперсія речовини і молекулярна рефракція.
- •4. Практичне застосування рефрактометричним вимірів.
- •4.1. Аналіз двокомпонентних систем.
- •4.2. Аналіз трикомпонентних систем.
- •Тема 4. Молекулярно-абсорбційна оптична спектроскопія
- •Загальна характеристика абсорбційних оптичних методів
- •Повна енергiя молекули як сума трьох складових.
- •Особливостi молекулярних спектрiв в уф I видимій областях спектру.
- •Види спектрів
- •Основний закон світлопоглинання (Бугера-Ламберта-Бера)
- •Прилади абсорбційної спектроскопії
- •Кількісний фотоколориметричний аналіз. Фотометричні реакції
- •Вибір оптимальних умов утворення забарвлених сполук
- •Умови фотометрування.
- •13.Переваги та недоліки фотометричних методів
- •Тема 5. Люмінісцетний аналіз
- •5.1. Суть методу.
- •5.2. Механізм люмінесценції
- •5.3. Характеристики люмінесценції
- •5.4. Основні закони люмінесценції
- •Закон Стокса–Ломмеля.
- •Правило дзеркальної симетрії Льовшина.
- •Закон Вавілова с.І.
- •5.5. Гасіння люмінесценції.
- •5.6. Якісний і кількісний люмінесцентний аналіз
- •5.7. Обладнання для проведення люмінесцентного аналізу.
- •Тема 7. Хроматографія
- •7.1. Основні поняття хроматографії
- •1.Суть і особливості хроматографічних методів аналізу
- •2.Основні етапи розвитку хроматографії (на самостійне опрацювання)
- •Класифікація хроматографічних методів аналізу
- •IV. За методикою проведення аналізу:
- •Практичне використання найпоширеніших хроматографічних методів (на самостійне опрацювання).
- •5. Сорбція та розподіл молекул між фазами
- •5.1. Сили міжмолекулярної взаємодії.
- •7.2. Основні положення теорії хроматографічного аналізу
- •Хроматограма та її характеристики
- •Пояснення причин розмивання хроматографічних піків.
- •Селективність колонки
- •Ефективність хроматографічного розділення. Теорія еквівалентних тарілок.
- •Дифузійна (кінетична) теорія
- •Критерій розділення.
- •Вибір температури
- •Газова хроматографія
- •1. 3Агальні положення. Рухома фаза у газовій хроматографії
- •2. Вплив різних факторів на хроматографічне розділення суміші речовин
- •2.1. Вплив швидкості потоку і тиску газу-носія на ефективність розділення.
- •2.3. Хроматографія з програмуванням температури.
- •3. Особливості газоадсорбційної хроматографії. Адсорбенти
- •4. Особливості газорідинної хроматографії
- •Іонообмінна хроматографія
- •1. Загальні відомості. Іонний обмін як принцип розділення.
- •2. Класифікація та властивості іонообмінних сорбентів
- •3. Основні властивості іонітів
- •5.4. Підготовка іонообмінних смол (самостійно з лабораторної роботи)
- •5.5. Застосування іонообмінної хроматографії
5.4. Основні закони люмінесценції
Правило Каші стосується форми спектрів люмінесценції (флуоресценції, фосфоресценції) при збудженні їх випромінюванням різних довжин хвиль. Оскільки випускання квантів люмінесценції завжди відбувається з нижчого електронно-збудженого рівня молекули, спектр люмінесценції буде завжди одним і тим же незалежно від того, на якій енергетичний рівень потрапив електрон в результаті поглинання фотона. Це означає, що спектр люмінесценції не залежить від довжини хвилі збуджуючого випромінювання.
Закон Стокса–Ломмеля.
За відомим правилом Д. Стокса, встановленим ще в 19 ст., тобто до квантової теорії, на основі простих спостережень, енергія кванта люмінесценції завжди менша за енергію кванта збудження hνлюм < hνзб , тобто лише частина поглинутої енергії перетворюється у випромінювання, решта витрачається на збільшення коливної енергії молекул, енергії теплового руху молекули, передачу іншим молекулам. Довжина хвилі люмінесцентного світла буде завжди більша, ніж довжина хвилі збуджуючого світла.
Проте експериментальні дослідження довели, що правило Стокса не завжди виконується, що є очевидним через часткове перекривання спектрів поглинання і люмінесценції.
Правило виконується лише у випадку простих молекул у газовій фазі. Загальніша закономірність, яка витримується завжди, відома як закон Стокса–Ломмеля: спектр люмінесценції загалом і його максимум зсунуті щодо спектра поглинання і його максимуму в довгохвильову ділянку (рис. 3). Це означає, що речовини, які поглинають УФ-світло, можуть люмінесценціювати будь-яким світлом, але речовини, люмінесценція яких збуджується, наприклад, синім світлом, не можуть світитися фіолетовим, а тільки зеленим, жовтим, червоним, тобто, розміщеним в більш довгохвильовій частині спектру.
Правило Стокса стосується окремої молекули і характеризує одиничний акт поглинання і випромінювання світла. Воно стверджує, що молекула не може випромінити більших за енергією квантів за рахунок поглинання менших. Закон Стокса-Ломмеля, навпаки, розглядає поглинання і випромінювання світла всією сукупністю молекул, тому має статистичний характер. Наявність антистоксової ділянки (на рис. 3 – невеличка ділянка спектра, де смуги збудження і люмінесценції перекриваються) свідчить про те, що можлива нерівність hνлюм > hνзб, тобто утворення більших за енергією квантів люмінесценції, яке можливе за рахунок комбінації наявної коливної енергії з поглинутими квантами.
Спектри поглинання і люмінесценції перетинаються в точці при ν0, яка відповідає збудженню електрона і випромінюванню кванта без втрат на переходи без випромінювання.
Відстань між максимумом спектра поглинання і максимумом спектра люмінесценції називається стоксовим зміщенням. Люмінофори характеризуються величиною стокового зміщення. Чим воно буде більше, тим більш надійне визначення речовини люмінесцентним методом.
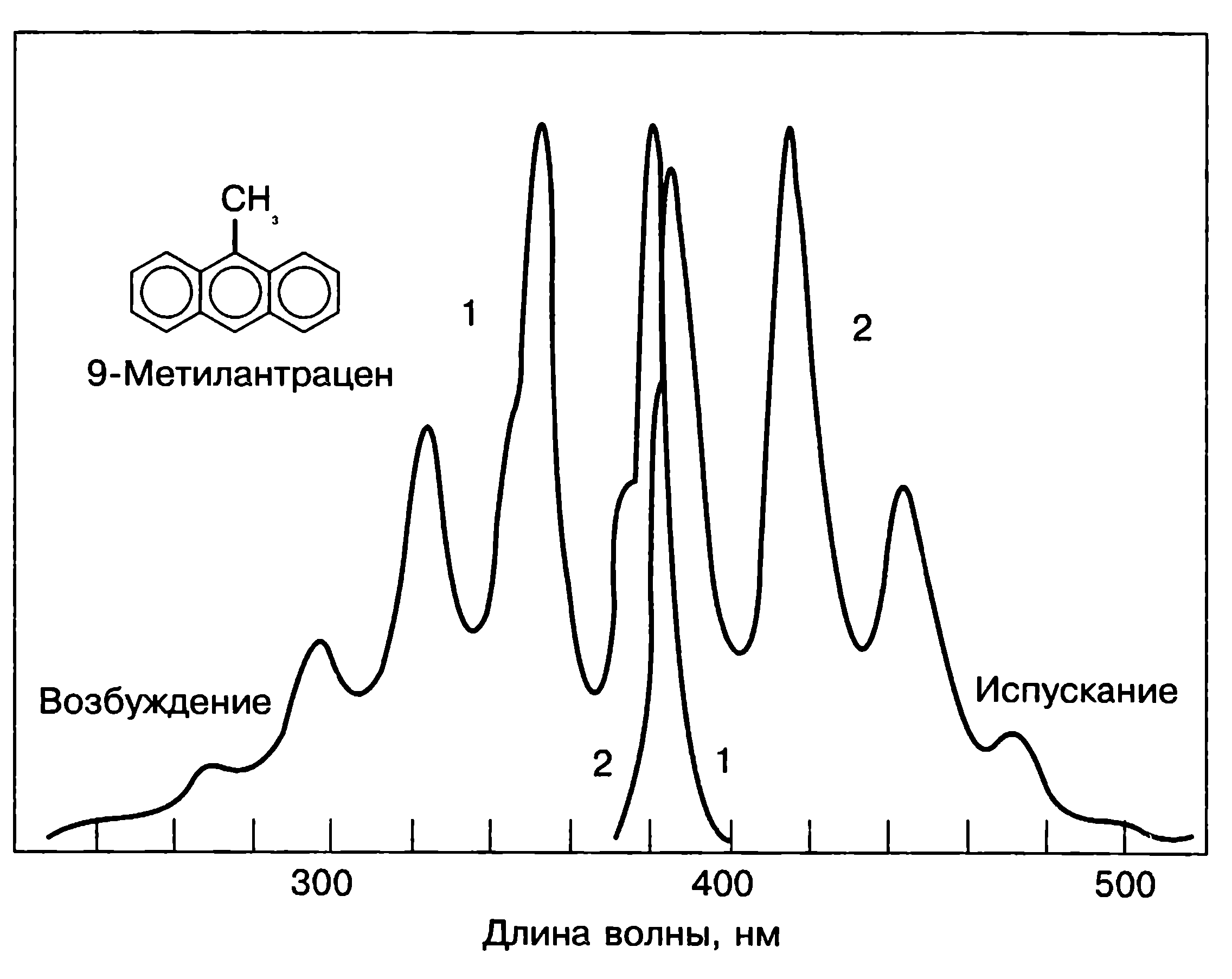
Рис. 3. Спектр збудження і випромінювання люмінесценціюючої молекули
Правило дзеркальної симетрії Льовшина.
За цим правилом нормовані (зведені до одного максимуму і подані у функції частот) спектри поглинання і люмінесценції дзеркально симетричні щодо прямої, проведеної через точку перетину спектрів перпендикулярно до осі частот (рис. 2.6). Це правило справджується для більшості молекул, особливо великих. Якщо виконується це правило, то правильне відношення
νпогл + νлюм = 2ν0 ,
тому νпогл – νлюм = 2(νпогл – ν0 ).
νпогл і νлюм – частоти max поглинання і люмінесценції, ν0 – частота в точці перетинання спектрів.
Графік залежності (νпогл – νлюм) – νпогл повинен бути прямою з tg кута нахилу рівним 2.
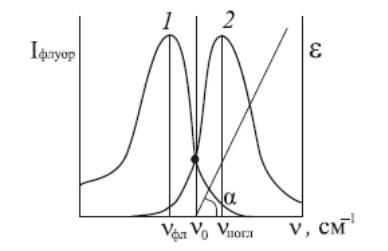
Рис.4. Дзеркальна симетрія спектрів люмінесценції (1) і поглинання (2)
Встановлена дзеркальна подібність спектрів поглинання і випромінювання для досить широкого ряду речовин. Ця симетрія проявляється для складних молекул і відсутня для простих молекул, що зв’язано, найімовірніше, зі значними внутрішньомолекулярними взаємодіями складних молекул. Збереження правила дзеркальної симетрії дозволяє побудувати спектр люмінесценції чи поглинання, маючи тільки один із них.
