
- •Раздел 1 Физико-химические закономерности влияния биосферы на состояние объектов недвижимости Тема 1.1 Биодеструкторы строительных материалов и их биопоражения
- •Тема 1.2 Микробиологическая коррозия древесины
- •Тема 1.3 Биохимическая и микробиологическая коррозия бетона
- •Тема 2.2 Воздействие загрязняющих веществ атмосферы на строительные и конструкционные материалы, объекты недвижимости
- •Тема 2.3 Оценка агрессивного воздействия газообразных сред по отношению к строительным конструкциям
- •Тема 2.4 Соли, повреждающие строительные объекты, их происхождение
- •Тема 2.5 Виды повреждений солями. Разрушение строительного камня (кирпич, блоки) и раствора
- •Тема 2.6 Распространённость солей. Солевая нагрузка на материалы. Образование новых солей в строительных материалах
- •Раздел 3 физико-химические закономерности влияния гидросферы на состояние объектов недвижимости Тема 3.1 Физические и химические свойства воды. Агрегатные состояния и аномальные свойства воды
- •Тема 3.2 Процессы миграции влаги и механизм повреждения пористых строительных материалов
- •Тема 3.3 Виды коррозионных повреждений строительных металлических конструкций
- •Тема 3.4 Виды коррозии бетона. Оценка агрессивности природных и технологических средств по отношению к бетону
- •Раздел 4 физико-химические закомерности влияния литосферы на состояние объектов недвижимости Тема 4.1 Составляющие компоненты почв. Основные окислительно-восстановительные реакции в почве
- •Тема 4.2 Вода в почвах. Гравитационная и гигроскопическая влага. Оценка степени агрессивного воздействия грунтов на бетонные и железобетонные конструкции
- •Литература
- •Варианты контрольных работ
- •Вопросы к зачёту для студентов заочной и заочно-ускоренной форм обучения
Раздел 4 физико-химические закомерности влияния литосферы на состояние объектов недвижимости Тема 4.1 Составляющие компоненты почв. Основные окислительно-восстановительные реакции в почве
Литосфера - внешняя твердая оболочка Земли, которая включает всю земную кору с частью верхней мантии Земли и состоит из осадочных, изверженных и метаморфических пород (см. рисунок 4.1.1)
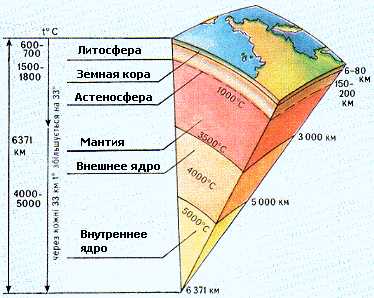
Рисунок 4.1.1 – Расположение литосферы в разрезе Земли
Верхняя часть литосферы называется педосфера и является поверхностной оболочкой суши Земли, образованная различными почвами.
Почва представляет собой систему, включающую твердую составляющую, почвенные растворы и почвенную атмосферу. В среднем на твердую часть почвы приходится 40—45 %, на почвенные растворы — до 35 % ее объема, а на почвенный воздух - остальное.
Органические вещества почвы, не входящие в состав живых организмов или образований, представлены гумусом, в составе которого различают специфические гумусовые вещества, неспецифические органические соединения и промежуточные продукты распада. К специфическим гумусовым веществам относят в основном гуминовые и фульвокислоты. Неспецифические соединения представлены органическими веществами почвы из разлагающихся растительных и животных остатков.
По определению, почва состоит из выветренного слоя минеральной породы с живыми организмами и продуктами их разложения. Она обладает рядом свойств, которых лишены атмосфера и гидросфера. Совокупность частиц почвы представляет своеобразный «фильтр», который весьма эффективно задерживает твердые частицы вод, проникающих в нее, и накапливает питательные вещества. Структуру почвы скрепляют частицы глины и гумуса, которые одновременно адсорбируют ряд веществ, например, тяжелые металлы, не давая последним возможности перейти в грунтовые воды. При превышении адсорбционной емкости почвы наступает проскок - загрязнение грунтовых вод вредными веществами.
Почвы обладают значительной способностью к регенерации. Многие их обитатели содержат ферменты, ускоряющие расщепление вредных веществ, и это определяет их замечательную способность к регенерации.
Перечисленные свойства почв определяют их буферную способность по отношению к антропогенным воздействиям.
Основные физико-химические процессы, протекающие в почвах. Одним из видов антропогенно-технического воздействия на почвы является их химическое загрязнение, которое может быть вызвано следующими причинами:
переносом загрязняющих веществ атмосферными осадками (тяжелые металлы, кислотные дожди, фтор, мышьяк, пестициды);
применением средств, повышающих урожайность и защищающих растения (удобрения, пестициды);
загрязнением земель отходами крупнотоннажных производств, отвалами топливно-энергетических комплексов, нефтью и нефтепродуктами.
Под химическим загрязнением почвы следует понимать изменение ее химического состава в результате антропогенной деятельности, сопровождающееся ухудшением или потерей ее естественных свойств. Основные физико-химические процессы, протекающие в почвах и определяющие изменение их химического состава и строения, - это адсорбция, ионный обмен.
Большую роль в изменении химического состава почвы играет катионный обмен, заключающийся в обмене катионами между твердой частью почвы и почвенным раствором, образующимся в результате растворения поверхностной влагой разного рода веществ.
Основным участником катионнообменного процесса является почвенно-поглощающий комплекс (ПК), который может быть охарактеризован как совокупность компонентов твердой фазы почвы, обладающих ионообменной способностью.
Наиболее важной характеристикой ПК и параметром почвы в целом является емкость катионного обмена (ЕКО) - это количество катионов одного рода, находящихся в ПК и способных к обмену в стандартных условиях на катионы раствора, контактирующего с ПК, другого рода. Для обломков кварца величина ЕКО≈ 6 мг-экв/100 г почвы, а для гуминовых кислот величина ЕКО доходит до 100 мг-экв/100 г почвы. Очень важная особенность почвы стоит в том, что она обладает способностью избирательно поглощать катионы одного сорта, отдавая эквивалентное количество ионов другого сорта в раствор, например:
ПК(Са2+) + Mg2+p-p ↔ ПК(Мg2+) + Са2+р-р
Предпочтительная адсорбция почвами различных элементов и их соединений влияет на кислотность почв, которая проявляется в различных формах. Различают следующие виды почвенной кислотности: актуальную и потенциальную.
Актуальная кислотность - это кислотность почвенного раствора, обусловленная присутствующими в нем компонентами.
По аналогии с раствором природных вод наибольший вклад в кислотность почв вносит растворенный углекислый газ:
СО2(р) + Н2О ↔ Н2СО3
Так как парциальное давление углекислого газа в почвенном воздухе в десятки раз больше, чем парциальное давление СО2 в атмосферном воздухе (в увлажненных, богатых органикой почвах концентрация углекислого газа достигает 15 % об.), то и величина рH почвенных растворов может опускаться до 4,0.
Потенциальная кислотность определяется концентрацией содержащихся в ПК ионов Н+ и А13+ и подразделяется на обменную и гидролитическую.
Обменная кислотность определяется содержанием связанного в ПК ионов Н+ и Аl3+. Ее определяют титрованием щелочью НС1 и А1С13, образующихся при взаимодействии ПК с раствором КС1:
ПК[Н+] + КС1 ↔ ПК[К+] + НС1
ПК[А13+] + ЗКС1 ↔ ПК[К+]3 + А1С13
Гидролитическая кислотность также определяется содержанием в ПК ионов водорода, но способ определения их концентрации основан на связывании ионов водорода ПК в слабую кислоту, вследствие чего достигается большая полнота перехода водорода в раствор:
ПК[Н+] + CH3COONa → ПК[Na+] + СН3СООН
В настоящее время существует устойчивая тенденция к уменьшению рH почв и увеличению их кислотности вследствие:
повышения разнообразия и массы вносимых в почву потенциально кислых минеральных удобрений;
обескальцивания почв (вымывание Са, связывающего СО2,) при их дренажировании и искусственном орошении;
кислых осадков (рH= 4 - 4,5).
Поведение тяжелых металлов и их соединений в почвах. Наиболее типичные тяжелые металлы, представляющие опасность, - свинец, кадмий, ртуть, хром, цинк, молибден, никель, кобальт, олово, титан, медь, ванадий. Пути поступления их в почву связаны с выбросами промышленных предприятий в атмосферу и последующим их осаждением на почвенный покров преимущественно в форме оксидов или солей. Последние постепенно растворяются, переходя в гидроксиды, карбонаты или в форму обменных катионов (см. рисунок 4.1.2).
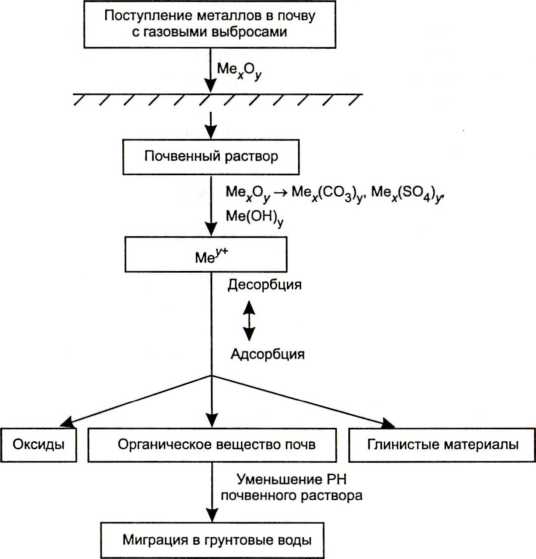
Рисунок 4.1.2 - Трансформация и миграция соединений тяжелых металлов в почвах
Если тяжелые металлы при этих взаимодействиях образуют в почве прочные нерастворимые соединения (обычно в тяжелосуглинистых и глинистых почвах), то это предотвращает загрязнение грунтовых и питьевых вод. Но в таком случае почва все больше накапливает загрязнения, и при превышении ее емкости по данным элементам может произойти выброс тяжелых металлов в почвенный раствор. Можно значительно снизить последствия этого процесса при повышении рH почвенного раствора известкованием почв или внесением большого количества таких органических удобрений, как торф.
Кислотные дожди снижают значение рH почв, увеличивают их кислотность и тем самым способствуют повышению содержания в почвах растворимых соединений токсичных элементов - свинца, алюминия, усилению разложения почвенных соединений.
Низкие значения рH способствуют присоединению анионов к железосодержащим коллоидным частицам в почве, так как протоны сообщают комплексам положительный заряд.
Для процессов, протекающих в почвах при контакте с почвенным раствором, весьма характерна реакция ионного обмена, в результате которой происходит фиксация твердыми частицами почвы растворенных катионов водорода, тяжелых металлов, анионов кислотных остатков.
(р-р)
Катионы тяжелых металлов селективно сорбируются на алюмосиликатных и других минеральных частицах, вытесняя в почвенный раствор катионы натрия, калия, кальция. У фосфатов возможен обмен их кислотных остатков с ОН-группами на поверхности коллоидных частиц, при этом фосфатные остатки связываются, и дальнейшее усвоение фосфора растениями становится невозможным.
Для свинца характерно стремление к накоплению в почве вследствие образования ионов малорастворимых соединений, адсорбции на глинистых частицах почв. Подвижность его ионов мала даже при низких значениях рH.
Количество кадмия, поступающего в почвы, оценивается гораздо меньшими значениями в сравнении с массой свинца и его соединений. В кислых почвах со значением рH < 6 наблюдается растворение соединений Cd, ионы которого весьма подвижны и мигрируют в составе почвенного раствора. При значениях рH > 6 кадмий аккумулируется в почвах вместе с гидроксидами железа, марганца и алюминия в основном в виде оксида, гидроксида, карбоната.
Соединения кадмия с гуминовыми кислотами значительно менее устойчивы, чем аналогичные соединения свинца. В условиях повышенных значений рH кадмий в почве может присутствовать в виде сульфида кадмия (CdS), который образуется из сульфатов при наличии восстановительной среды. Образование карбоната кадмия (CdCО3) возможно только при значениях рH > 8.
Подвижность ионов двухвалентной меди (Сu2+) очень высока. Она легко переходит из породы в почву, а оттуда в почвенный раствор и поверхностные воды. Надо отметить, что растворимость соединений меди заметно увеличивается при значениях рH <5. Подвижности меди препятствует наличие в почве сульфид-ионов, с которыми она образует нерастворимый сульфид CuS. В восстановительных условиях подвижность меди резко падает, так как соединения одновалентной меди практически нерастворимы.
Своей высокой подвижностью при рH < 6 цинк обязан хорошей растворимости своих минеральных солей и органических соединений. При более высоких значениях рH, и особенно в присутствии фосфатов, подвижность цинка ввиду образования труднорастворимых соединений сильно снижается. Накоплению цинка в почве способствуют процессы адсорбции в глинах и различных оксидных минералах, определяемые значениями рH. Из лесных гумусовых почв цинк быстро вымывается благодаря постоянному естественному поддержанию кислой среды.
Сера, находящаяся в почве в виде сульфата, может восстанавливаться микробиологическим путем до сульфид-ионов и образовывать с тяжелыми металлами (Си, Cd, Pb, Со и др.) трудно растворимые сульфиды.
Марганец обычно встречается в почве в виде пиролюзита МnO2. При восстановлении он переходит в растворимый ион Мn2+.
Так как марганец принадлежит к числу накапливающихся в почве элементов, ион Мn2+ встречается в воде только в малых концентрациях. Органические соединения (комплексы) марганца также неустойчивы и легко обменивают ионы Мn2+ на другие катионы, входящие в состав нерастворимых соединений. Похожее положение складывается и с соединениями железа. В обычных условиях железо накапливается в почве в виде Fe(OH)3. При малом содержании кислорода в восстановительных условиях понижается окислительно-восстановительный потенциал почвы, что способствует переводу Fe(III) в Fe(II):
Fe(OH)3 + ЗН+ + е → Fe2+ + ЗН2O
Ионы железа, марганца и ряда других металлов в восстановленной форме обладают повышенной подвижностью в почве, что способствует их переходу в раствор и обеднению почвы этими металлами.
