
- •Пероксидазный тип окисления
- •2. Современные представления о биологическом окислении, особенности аэробного метаболизма. Роль кислорода.
- •Опишите формулы окисленных и восстановленных форм пиридинзависимых коферментов (над). Какая часть структуры над является акцептором (донором) в переносе электронов и протонов?
- •6. Опишите механизм действия пиридинзависимых дегидрогеназ (механизм действия над в окислительно-восстановительных реакциях).
- •8. Опишите механизм действия флавинзависимых дегидрогеназ (механизм действия фад и фмн в окислительно-восстановительных реакциях).
- •9. Опишите формулу коэнзима q (убихинон) и механизм его действия в окислительно-восстановительных реакциях. Какова его роль в дыхательной цепи?
- •10. Цитохромная система (типы цитохромов) Химический состав и строение цитохромов. В какие комплексы входят цитохромы? Цитохромоксидаза. Функции цитохромов в дыхательной цепи.
Основные механизмы окисления веществ в тканях (оксидазный, оксигеназный, пероксидазный и перекисное окисление липидов).
Понятие об оксидазном типе окисления
80% кислорода используется на оксидазный тип – это первый тип окисления, т.е. когда атом кислорода восстанавливается 2 электронами, или молекула кислорода 4-мя электронами. Оксидазный тип окисления служит источником АТФ.
Оксигеназный тип окисления
20% О2 используется на другие типы окисления. II) Больше половины оставшегося кислорода используется на оксигеназный тип окисления, который идет по 2 путям – монооксигеназному и диоксигеназному. Монооксигеназный путь происходит в митохондриях и микросомах. В митохондриях происходит гидроксилирование (при участии НАДФН2, ЦхР450). При гидроксилировании образуется окисленный продукт, вода и НАДФ. Пример – формулами — фенàтир.
При митохондриальном гидроксилировании также происходит образование активных форм витамина Д, ХСН, ЖеЧ, КС.
Второй вид реакций монооксигеназного пути окисления объединяется под названием микросомальное окисление. Этот вид реакций происходит в микросомах, в основном в печени. В этом виде окисления участвует мультиферментная мембраносвязанная система, включающая НАДФН2, особые ФП и цхР450. В субстрат включается один атом кислорода. Второй атом О2 используется для образования воды. Этот тип окисления является защитной реакцией организма, т.к. происходит окисление различных чужеродных веществ. При этом они переходят в безвредные или становятся более растворимыми в воде и легко выводяться из организма
При диоксигеназном пути оксигеназного типа под влиянием оксигеназпроисходит включение обоих атомов кислорода в субстрат. Обычно это происходит с веществами, имеющими ненасыщенные связи по месту их разрыва, например, ненасыщенные жирные кислоты — S + О2à SО2
Пероксидный тип окисления. Понятие об АОС.
или перекисный, или свободно-радикальный — происходит при одноэлектронном восстановлении О2. Этому типу окисления подвергаются ПНЖК в составе ФЛ мембран. ПОЛ инициируется под действием АФК АФК делятся на 2 группы:
1 группа – свободные радикалы: супероксиданион радикал, гидроксипероксирадикал (НОО•), гидроксильный радикал, радикал оксида азота, алкилоксирадикал (LO•), липопероксирадикал (LOO•)
2 группа – нерадикальные вещества: гипохлорит-анион, перекись водорода, синглетный кислород (1О2), озон (О3), железокислородный комплекс (Fe++—О2) и ГПЛ (LOOH).
Третий фермент АОС – глутатионпероксидаза (ГПО). В нормальных (физиологических) условиях перекись водорода расщепляется не каталазой, а пероксидазой. В состав этого фермента входит селен и бывает неселеновая ГПО. Последняя называется глутатион-S-трансфераза (GST).
Пероксидазный тип окисления
происходит при участии ряда веществ, обладающих аутооксидабельностью. К таким веществам относятся некоторые ФП (ксантиноксидаза и др.) – ФПН2 + О2 à ФП + Н2О2.
Этот тип окисления является побочным путем окисления, обычно наблюдается при выходе из строя цитохромной системы или когда субстрат не окисляется другим путем, например, мочевая кислота.
2. Современные представления о биологическом окислении, особенности аэробного метаболизма. Роль кислорода.
Современные представления о биологическом окислении Согласно современной теории БО, окисление происходит как в аэробных, так и в анаэробных условиях. В аэробных организмах существует несколько путей использования О2. Реакции БО необходимы для получения энергии, синтеза новых веществ и разрушения чужеродных веществ. БО является сложным, многостадийным процессом, в котором ведущую роль играют ферменты оксидоредуктазы. Окислительно-восстановительные реакции (ОВР) – реакции, в которых меняется степень окисления субстрата за счет присоединения/отщепления: 1) 1 е-; 2) 2е- и 2Н+; 3) атомов кислорода. Биологическое окисление (БО) совокупность окислительно-восстановительных реакций, которые протекают во всех живых клетках. Основная функция БО - обеспечение организма энергией в доступной для использования форме (АТФ). Субстрат БО – вещество, способное отдавать электрон. Тканевое дыхание – окисление органических веществ в клетках, сопровождающееся потреблением О2 и выделением воды. Субстрат тканевого дыхания – это вещество, которое отдает электрон непосредственно в цепь окислительного фосфорилирования. Дыхательная цепь – цепь переноса электронов. В переносе электронов от субстратов БО к О2 принимают участие: 1) НАД и НАДФ зависимые ДГ; 2) ФАД и ФМН зависимые ДГ; 3) цитохромы; 4) коэнзим Q; 5) белки, содержащие негеминовое железо. Свободная энергия. Каждое органическое вещество обладает определенным запасом внутренней энергии (Е). Часть этой внутренней энергии может быть использована для совершения полезной работы, такую энергию называют свободной (G). Направление химической реакции определяется значением ∆G. У катаболических реакций ∆G отрицательно, эти реакции протекают самопроизвольно (экзергонические реакции). У анболических реакций ∆G положительно, они протекают только при поступлении свободной энергии извне (эндергонические реакции).
Объясните схему организации дыхательной цепи (ферментные комплексы, коферменты).
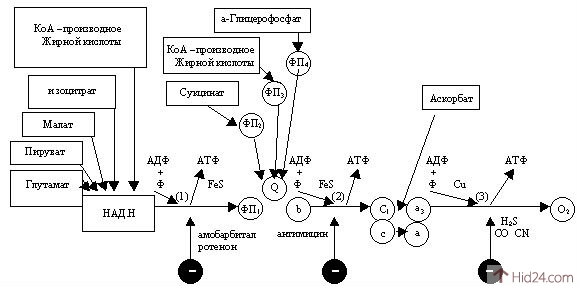
К числу ферментов дыхательной цепи относятся: 1. Пиридинзависимые дегидрогеназы с коферментом НАД + и НАДФ+; 2. Флавинзависимые дегидрогеназы (флавопротеиды), у которых простетической группой служат ФМН и ФАД; 3. Цитохромы и цитохромоксидаза, их простетической группой является гем.
Редокс-потенциалы и локализация компонентов дыхательной цепи.
Редокс-потенциалы. В каждой окислительно-восстановительной системе участвует окисленная и восстановленная формы одного соединения, которые образуют сопряженную окислительно-восстановительную или редокс-пару. Разные редокс-пары обладают различным сродством к электрону. Мерой сродства редокс-пары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Ео'), величина которого прямо пропорциональна изменению свободной энергии ∆G. Величину Ео' выражают в вольтах; чем она отрицательнее, тем меньше сродство вещества к электронам и наоборот. Самое низкое сродство к электрону -0,42В у водорода. Самое высокое сродство к электрону +0,82В у О2. Компоненты дыхательной цепи имеют редокс-потенциалы, занимающие промежуточное положение между -0,42В и +0,82В. В дыхательной цепи, вещества переносящие электрон, располагаются в порядке увеличения их редокс-потенциала. Электрон перемещается по дыхательной цепи от веществ с низким сродством к электрону к веществам с более высоким сродством к электрону, при этом происходит высвобождение свободной энергии, часть которой фиксируется в виде макроэргических соединений. Электроны в дыхательную цепь поставляют субстраты тканевого дыхания.
