
- •Часть II. Количественный анализ неорганических веществ
- •I. Введение в количественный анализ
- •2.Гравиметрический метод анализа
- •2.1. Этапы гравиметрического анализа.
- •2.1.1. Расчёт массы или объёма анализируемого вещества .
- •Неорганические и органические осадители и их гравиметрические факторы
- •2.1.2.Расчёт объёма или массы осадителя.
- •2.1.4. Растворение навески
- •2.1.5. Осаждение.
- •2.1.6. Фильтрование и промывание осадка
- •2.1.7. Получение гравиметрической формы
- •2.1.9. Расчёт содержания определяемого компонента в образце
- •2.2. Метод отгонки
- •2.3. Обработка результатов анализа с применением
- •2.4.1Лабораторная работа № 1: «Определение концентрации серной кислоты».
- •2.5. Вопросы и задачи по теме " гравиметрический метод анализа"
- •3.Титриметрические методы анализа
- •3.1.Сущность метода титриметрического анализа
- •3.2.Основные понятия титриметрического анализа
- •Стандартные растворы
- •3.3.Различные способы выражения концентрации растворов в титриметрическом методе анализа
- •4.Кислотно-основное титрование
- •4.1.Протолитическая теория Брёнстеда
- •4.2Типы кислотно-основного титрования
- •4.3.Методы установления конечной точки титрования
- •Интервал перехода некоторых кислотно-основных индикаторов
- •4.4.Расчёт и построение кривых титрования
- •4.4.1.Алкалиметрическое титрование
- •Расчет кривой титрования хлороводородной кислоты раствором гидроксида натрия
- •4.4.2.Ацидиметрическое титрование
- •4.5.Титрование солей слабых кислот
- •4.6.Титрование многоосновных кислот
- •4.7.Влияние различных факторов на величину скачка титрования
- •4.8. Лабораторная работа №3.
- •4.9. Вопросы и задачи к разделу ”Кислотно- основное титрование” Вопросы
- •5.Окислительно-восстановительное титрование (редоксиметрия)
- •5.1. Сущность метода окислительно-восстановительного титрования
- •5.2.Классификация редокс-методов
- •5.3.Требования, предъявляемые к окислительно-восстановительным реакциям, применяемым в титриметрии.
- •5.4.Индикаторы окислительно-восстановительного титрования
- •5.5.Кривые окислительно- восстановительного титрования
- •5.5.1Дихроматометрическое титрование
- •5.5.2.Перманганатометрическое титрование
- •5.5.3.Иодиметрия
- •5.5.4.Иодометрия
- •5.5.5.Другие методы окислительно–восстановительного титрования
- •5.5.6.Факторы, влияющие на величину скачка на кривой окислительно–восстановительного титрования
- •5.6. Лабораторная работа №4 «Определение концентрации железа в соли Мора методом перманганатометрии»
- •5.6.1.Установление титра перманганата калия по стандартному
- •5.6.2.Титрование соли Мора раствором перманганата калия
- •6.Комплексометрическое титрование
- •6.1.Классификация методов комплексометрического титрования
- •6.2.Комплексонометрия
- •6.3.Индикаторы комплексонометрии
- •6.4.Требования, предъявляемые к металлоиндикаторам
- •6.5.Кривые комплексонометрического титрования
- •6.6.Влияние различных факторов на величину скачка
- •6.7.Лабораторная работа№5 « Определения концентрации магния в гептагидрате сульфата магния.»
- •7.Осадительное титрование
- •7.1.Требования, предъявляемые к реакциям в методе осадительного титрования
- •7.2. Классификация методов осадительного титрования
- •7.3.Кривые осадительного титрования
- •7.4.Индикаторы метода осадительного титрования
- •7.5.Влияние различных факторов на величину скачка титрования
- •7.6.Вопросы к разделам ”Комплексометрическое и осадительное титрование”
- •8.Список литературы
- •Введение в количественный анализ-------------------------------------
4.4.2.Ацидиметрическое титрование
Титрование сильного основания сильной кислотой
При титровании сильного основания сильной кислотой, например, гидроксида натрия раствором хлороводородной кислоты, протекают процессы, аналогичные рассмотренным при титровании сильной кислоты сильной щёлочью, но только в обратном порядке. При прибавлении титранта к исходному раствору значение рН раствора уменьшается. Расчёт проводится по формулам. аналогичным рассмотренным выше (с. ) , для исходного раствора
рН =14 – рОН = 14 + lg cNaOH
В точке эквивалентности рН=7, так как гидролиз соли отсутствует, после точки эквивалентности величина рН обусловлена присутствием избыточного титранта, то есть сильной кислоты. Точка эквивлентности совпадает в данном случае с точкой нейтральности. На рис. 3 показана, в качестве примера, кривая титрования 0,1моль/л раствора гидроксида натрия 0,1 моль/л раствором хлороводородной кислоты.

Рис.4.3 Рассчитанная кривая титрования 20 мл 0,1 моль/л раствора NaOH 0,1 моль/л раствором HCl
Титрование слабого основания сильной кислотой
Рассмотрим титрование гидрата аммиака хлороводородной кислотой.
В растворе гидрата аммиака устанавливается следующее протолитическое равновесие:
NH3∙H2O + H2O NH4+ + OH- + H2O
Исходный раствор имеет рН больше 7 и значение рН рассчитывается по формулам:
![]() =
=
![]() =
=
![]()
=
![]()
![]() =
−lg
=
−lg![]()
![]() =
14 −
= 14 + lg
=
14 + lg
=
14 −
= 14 + lg
=
14 + lg![]()
Кк
=
![]() =
5,75∙ 10-10
=
5,75∙ 10-10
При прибавлении к раствору аммиака сильной кислоты, например, HCl
образуется соль, содержащая катион слабого основания :
NH3 ∙ H2O + HCl = NH4Cl + H2O
После начала титрования в растворе присутствует как само слабое основание, так и его соль, то есть раствор представляет собой буферную смесь.
Расчёт рН выполняется по формулам:
рН = 14 +
lg![]()
В точке эквивалентности источником оксония − иона является сопряжённая кислота, которая появляется в растворе в результате гидролиза хлорида аммония.
NH4Cl = NH4+ + Cl-
NH4+ + 2 H2O H3O+ + NH3∙ H2O
Константа кислотности протолитического равновесия равна :
![]() =
=
![]() =
=

Значение рН рассчитывается по формуле :
рН = − lg
[H3O+]
= − lg![]()
За точкой эквивалентности значение рН определяется только добавленной сильной кислотой, то есть рН = −lg cHCl
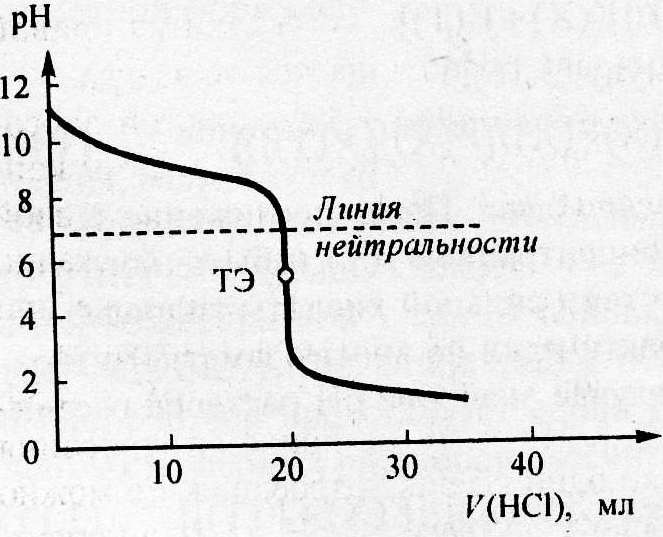
Рис.4.4 Рассчитанная кривая титрования 20 мл 0,1 моль/л раствора аммиака 0,1 моль/л раствором HCl
Рассматривая кривую титрования, мы видим, что точка эквивалентности лежит ниже линии нейтральности, величина скачка (от рН= 7,5 до рН= 3) значительно меньше, чем при титровании сильной щёлочи сильной кислотой (см. предыдущий рис.4.4).
Для определения конечной точки титрования могут быть использованы следующие индикаторы: метиловый оранжевый (рТ =4), метиловый красный (рТ= 5,5) и другие см. таблицу. Фенолфталеин в данном случае использовать нельзя, так как у него рТ =9, что выходит за пределы скачка.
4.5.Титрование солей слабых кислот
Как было отмечено выше на с. по теории Брёнстеда кислотные остатки слабых кислот являются основаниями, следовательно они могут присоединять протоны и могут быть оттитрованы растворами сильных кислот. Например, рассмотрим титрование раcтвора карбоната натрия раствором хлороводородной кислоты. При растворении карбоната натрия в воде происходят следующие процессы:
карбонат натрия как сильный электролит в воде диссоциирует нацело, а карбонат ион в растворе гидролизуется :
Na2CO3 = 2Na+ + CO32-
CO32- + H2O HCO3- + OH-
рН исходного раствора рассчитывается по формуле:
=
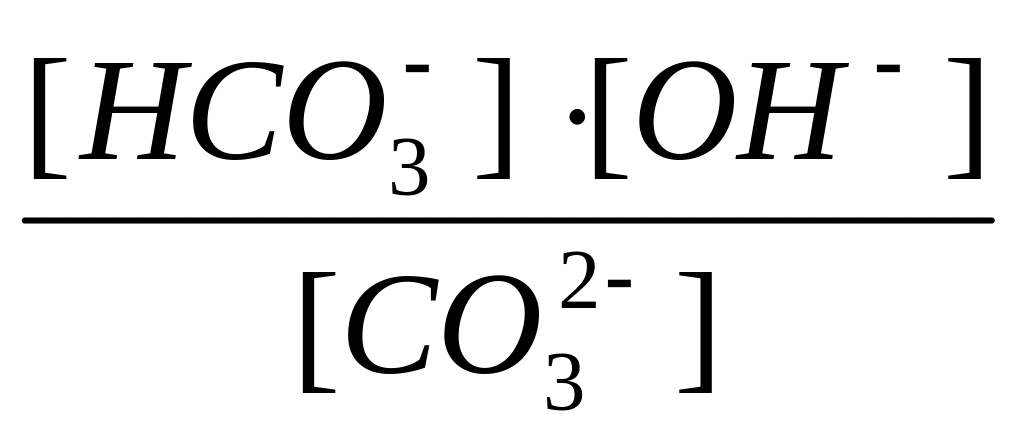 =
=
![]() рН = 14 − рОН = 14 + lg
рН = 14 − рОН = 14 + lg![]()
На кривой титрования фиксируется два скачка титрования(рис. 4.5), которым соответствуют две точки эквивалентности. Первая из них связана с образованием амфолита – гидрокарбоната натрия. Расчёт рН амфолита проводится по формуле:
рН = ½(pK1+ pK2)
где К1 = 4,27∙ 10-7 ; К2 = 4,68 ∙ 10-11 − константы кислотной диссоциации угольной кислоты по первой и второй ступени.
От первой до второй точки эквивалентности раствор представляет собой буферную смесь слабой угольной кислоты и недотитрованного
гидрокарбоната натрия. Расчёт проводится по формуле :
рН= рК1
− lg
Во второй точке эквивалентности карбонат натрия полностью оттитрован до угольной кислоты, рН в растворе определяется по первой ступени её диссоциации.
H2CO3 + H2O H3O+ + HCO3-
=
![]() =
=
 ; рН
= − lg
; рН
= − lg![]()
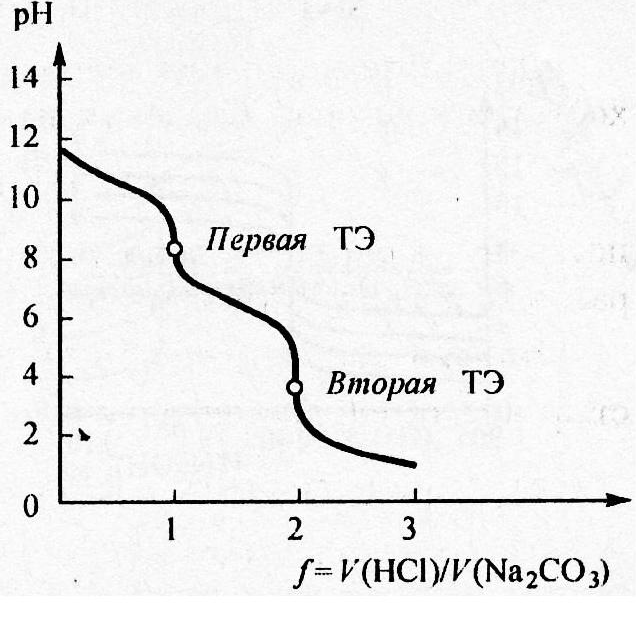
Рис.4.5.Расссчитанная кривая титрования раствора карбоната натрия Na2CO3 с молярной концентрацией эквивалента 0,1 моль/л раствором HCl с молярной концентрацией 0,1 моль/л; f – степень оттитрованности.
Величина рН после второй точки эквивалентности определяется значением избытка прибавленной кислоты (см. рис. ). Для фиксации конечной точки титрования первой точки используется фенолфталеин, для фиксации второй точки титрования – метиловый оранжевый.
