
3. Параметры электролиза
3.1. Составы промышленных электролитов
Как было показано выше для обеспечения качества никеля, концентрация его ионов в электролите должна быть тем выше, чем выше плотность тока. Тенденция развития электролиза никеля состояла в повышении плотности тока. Так, например, один из первых цехов электролиза – цех в Порт-Колборне имел плотность тока 130 А/м2, что примерно вдвое ниже плотностей тока на современных предприятиях, поэтому уже в 50-60-х годах электролиты промышленных предприятий содержали компоненты в следующих пределах (г/дм3): Ni2+ – 6075; Cl- – 3560; SO42- – 125180 и Н3ВО3 – 24.
Тенденция к использованию концентрированных по никелю электролитов привела к необходимости определения оптимального соотношения концентраций сульфат и хлорид-ионов в них. Многочисленными работами, выполненными в институте Гипроникель, под руководством проф. В.Л. Хейфеца было показано, что, чем выше плотность тока, тем выше должна быть концентрация хлорида никеля в электролите. Это объясняется тем, что хлорид никеля более растворим, имеет меньшую вязкость и более высокую электропроводность. Катодная и анодная поляризации в хлоридных растворах ниже, а выход по току никеля выше. Разница в падении напряжения на электролизере при применении хлоридного электролита и стандартного сульфат-хлоридного электролита, содержащего 60 г/дм3 Ni в виде сульфата, 40 г/дм3 Na2SO4 и 38 г/дм3 Cl- в виде NaCl иллюстрируют следующие данные, приведенные в таблице.
Таблица 3.
Статьи, составляющие баланс напряжения на электролизере
Статьи баланса |
Хлоридный электролит, при плотности тока, А/м2 |
Сульфат-хлоридный электролит при плотности тока А/м2 |
||||||
250 |
500 |
750 |
1000 |
250 |
500 |
750 |
1000 |
|
1. Потенциал катода 2. Потенциал анода 3. Падение напряжения в электролите и диафрагме 4. Сумма |
-0,37 -0,07
0,80 1,33 |
-0,37 0,15
1,6 2,12 |
-0,37 0,15
2,24 2,76 |
-0,37 0,16
2,72 3,26 |
-0,43 0,20
1,27 1,9 |
-0,46 0,24
2,53 2,23 |
0,48 0,29
3,8 4,57 |
-0,52 0,33
5,07 5,92 |
В настоящее время электролиты цехов ЭР компании « Норилскй Никель» имеют составы, показанные в таблице 2
Концентрация никеля в католите. Необходимо различать концентрации никеля в католите, поступающем на электролиз Ск и концентрацию в католите диафрагмы (Ся). Наличие диафрагмы приводит к необходимости циркуляции электролита. Как рассмотрен в главе «Материальный баланс» эти концентрации связаны друг с другом следующим выражением
Ск = ся + q .Вт/ (1) ,
где - удельная скорость циркуляции.
Отсюда при n =75 мл/ А.час, получим С=(Ск – Ся) = 1000/75 =13,3 г/дм3, приято qВт=1г/Ачас. Иначе говоря 1 дм3 поступающего католита выделяется на катоде 13,3г никеля.
![]()
3.2Плотность тока
Концентрация никеля ся должна обеспечить получение никеля с бездефектной поверхностью. Обобщая практику промышленного производства никеля, Т.В. Грань сформулировала эмпирическое правило для оценки ся, гарантирующей получение бездефектного металла:
ся = 25 + 0,1 j,
где j - плотность (А/м2), размерность ск – г/дм3.
Концентрацию сп можно определить с используя уравнение (1) :
сп=
ск +![]() = 25 +0,1 j + С
= 25 +0,1 j + С
и предельно допустимую (техническую) плотность тока j:
j = 10(сп-(25 +С)
Так например, при Сп=70г/дм3, n=75 мл/А.час, а предельно допустимая плотность тока равна 320 А/м2. Следовательно, повышение технической плотности тока возможно за счет повышения Сп и n.
Далее выполняют расчеты экономичной плотности тока и определяют рабочую плотность тока. Используя эти принципы были определены плотности тока цехов ЭР компании « НН»250- 280 А/м
Скорость циркуляции электролита.
Для повышения предельно допустимой плотности тока необходимо увеличить скорость циркуляции электролита. Однако этот способ интенсификации электролиза крайне не эффективен так как повышение циркуляции приводит к увеличению затрат на очистку и перекачку растворов. Для оценки скорости циркуляции, рассмотрим как связана скорость циркуляции с чистотой катодного никеля (рис.3 .
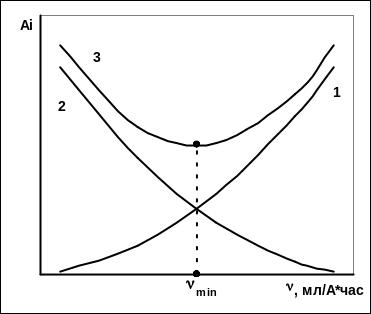
Рис. 3 Зависимость содержания примеси в металле от скорости циркуляции электролита
При электролитическом рафинировании в катодное пространство примеси поступают с питающим раствором и переносятся из анодного пространства. Для оценки связи между чистотой металла и скоростью циркуляции составим материальный баланс примесей для электролизера с диафрагмой для двух гипотетических случаев
Первый случай. Перенос примесей из анодного пространства не учитываем , то есть считаем, что анод чистый. Обозначим :
Сп – концентрацию примеси в поступающем растворе – католите (г/л),
Ся – концентрацию примеси в катодном пространстве;
Са – концентрацию примеси в анолите
Vм – скорость циркуляции
А – содержание примеси в никеле (г/г или ррм);
Уравнение баланса примеси по катодному пространству, если скорость циркуляции принять как удельную скорость, отнесенную к 1г никеля, можно записать в виде
СпVм = А + Ся V (1)
Из теории совместного разряда металла и примеси следует, что А=к Ся ,потому получим следующее выражение для А:
А= Сп V/(1 +V/к)= Сп/(1/V +1/к) (2)
Обозначив через Ап= кСп , перепишем это выражение в виде
А = Ап/(к/V- 1) (3)
из которого следует, что содержание примеси в металле возрастает от 0 до предельной величины Ап= к Сп (кривая1 рис. 3)
Второй случай. В катодное пространство поступает раствор, не содержащий примеси, Cп =0.Примем, количество металла примеси, растворившегося из анодов - В (кг/ч). Из этого количества часть (В1) проходит через поры диафрагмы навстречу потоку католита в катодное пространство и разряжается на катоде, остальная часть (В2) растворившейся примеси выходит из электролизера с анолитом. Выражение для баланса примеси по всему электролизеру имеет следующий вид:
В= Са V +А
Для выполнения расчетов нужна модель, связывающая поток примеси из анодного пространства в катодное со скоростью циркуляции, а точнее со скорость течения электролита в порах диафрагмы. Существует несколько моделей обратного переноса. В частности одна из них состоит в следующем.
Перенос примеси
из анодного пространства происходит
по пристеночным зонам пор диафрагмы,
где скорость течения католита (wк)
меньше скорости переноса катионов –
примесей к катоду (wа) за счет
миграции и диффузии. Если представить
пору в виде цилиндрического капилляра
с радиусом r0 и длинной S, то
распределение скорости течения католита
по сечению капилляра описывается
параболическим законом, следовательно,
на определенном расстоянии от оси
капилляра r <r0
скорость wк <
wа. Сечение, по которому реализуется
обратный перенос равно S =![]() (r02-r2), причем
(r02-r2), причем
 .
.
В
реальных диафрагмах сечение обратного
переноса зависит от скорости течения
более сложным образом. Установлено, что
до определенных скоростей течения
![]() – постоянна, свыше этих скоростей S ~
– постоянна, свыше этих скоростей S ~
![]() .
.
Количественная зависимость содержания примеси в никеле от скорости циркуляции электролита, учитывающая перенос примесных ионов из анодного пространства была получена в следующем виде:

где a1= j/м, a2 = qi. i , ка - поток переноса примесных ионов из анодного пространства, учитывающий величину сечения обратного переноса, Ci – концентрация ионов примеси в католите, Ра– масса примеси, растворяющаяся с анода в единицу времени, qi - электрохимический эквивалент примеси, V- скорость циркуляции.
Из этой модели следует видно , что скорость обратного переноса пропорциональна (Са – Ся)≈ Са , а площадь сечения поры, по которому происходит перенос обратно пропорциональна скорости циркуляции. Аналогичный результат дают и иные более точные модели.
Поэтому, если поток В1~ Са/ V =А ,то уравнение баланса можно переписать в виде
В= А(V2 +1)
Так как при V=0 В =Аа ( содержанию примеси в анодах ) , то во втором случае содержание примеси в никеле следующим образом связано со скоростью циркуляции электролита
А = Аа /(V2 +1) (4)
Иначе говоря, содержание примеси в никеле уменьшается с увеличением скорости цир куляции электролита от величины Аа до 0 (кривая 2, рис.3).
Третий случай относится к реальной ситуации и объединяет оба случая. В этом случае зависимость содержания примеси в никеле от скорости циркуляции изображается кривой с минимумом (крива3). Если скорость циркуляции меньше точки минимума, то примеси включаются в никель в основном за счет переноса из анодного пространства, тогда как при превышении скорости циркуляции точки минимума основной вклад в уровень загрязнения металла вносит поток примесей с католитом.
Анализ выражения для Vmin показал, что чем выше отношение Аа/СП тем при более высоких скоростях циркуляции достигается минимальное содержание примесей. Показано, например, что для макропримесей (железо, медь, кобальт), содержащихся в анодах на уровне 1-5% и в католите 0,5-5мг/дм3, Vmin примерно на порядок ниже, чем для микропримесей (цинк, свинец), содержащихся в анодах и католите в значительно меньших количествах (0,01% и 0,1 мг/дм3 соответственно).
На практике скорость циркуляции выбирают, в основном, руководствуясь обеспечением необходимой концентрации никеля в катодном пространстве или же обеспечивая минимальную скорость циркуляции по макропримесям. Эта скорость циркуляции оказывается меньше скорости минимума для микропримесей, поэтому микропримеси включаются в катодный осадок из питающего раствора, а не вследствие диффузии из анодного пространства, и повышение чистоты металла может быть достигнута только более глубокоочисткой католита.
4. Практика ЭР никеля
4.1 Электролизеры и их элементы . Порядок обслуживания электролизеров
Рис.70,71 Стр 169-173, 182 -183
Производство основ стр 174
