
Э Л Е К Т Р О Л И З Н И К Е Л Я
1. Электрохимические свойства никеля.
Стандартный потенциал реакции Ni0 Ni2+ +2e при 250С по данным М. Пурбэ равен -0,250В и находится в первой зоне диаграммы устойчивости воды. Стандартный ток обмена по измерениям в сернокислых растворах составляет 5.10-7 А/см2, т.е. никель относится к металлам, имеющим высокие перенапряжения катодной и анодной реакций. При контакте металла с водными растворами его солей на границе устанавливается компромиссный потенциал окислительно-восстановительных реакций с участием никеля и водорода:
Ni0 – 2e Ni2+, (1)
0,5 H2 – 2e 2H+ (2)
2 H2O -4e 4H+ + 0,5O2 (3)
Ni2+ +2e Ni0 (4),
2H+ +2e H2 (5)
4H+ + 0,5O2 +4e 2H2O (6)
Величина компромиссного потенциала устанавливается такой, чтобы сумма скоростей первых трех реакций окисления равнялась сумме скоростей реакций восстановления (4)- (6). Причем, скорости прямых и обратных реакций не равны. Очевидно, что бестоковый потенциал никелевого электрода может находится в диапазоне значений от равновесного потенциала кислородного электрода до равновесного потенциала никеля, а его величина определяется реакций, имеющих преобладающую скорость. Так как характерной особенностью никеля является то, что скорости реакций (4) и (1) сильно зависят от чистоты растворов, наличия оксидных пленок, адсорбции чужеродных частиц на поверхности и других трудно контролируемых факторов, то величина бестокового потенциала никеля плохо воспроизводится, не постоянна во времени и часто расходится при выполнении измерений в одинаковых условиях.
Ю.В. Баймаков и Л.М. Евланников установили, что потенциал никелевого электрода, измеренный в растворах 1-н сульфата никеля при 200 С в интервале рН 2 -6 совпадает с равновесным потенциалом водородного электрода и равен Е =- 0,012 - 0,058рН. Это означает, что в изученных условиях на никелевом электроде преимущественно протекают реакции (2) и (5).
Как было показано А.Т Ваграмяном, при увеличение температуры до 2000С потенциалы никеля становятся равновесными, т.е. при этой температуре скорость реакций (1) и (4) намного выше остальных.
Перенапряжения катодной и анодной реакций
Зависимость потенциала под током от плотности тока реакции (1) при температурах 20 – 700С хорошо описывается уравнением Тафеля, (рис.1)
 .
.
Рис. 1. Поляризационные кривые восстановления ионов никеля из растворов 0,86 н. NiSO4, pH = 4,5, t =55C0, c различным содержанием хлор ионов: 1- 0,86 н., 2 – 0,6 н., 3- 0,3 н.
Перенапряжение уменьшается с увеличением температуры, концентрации ионов хлора в электролите и увеличением рН (рис.2,3).
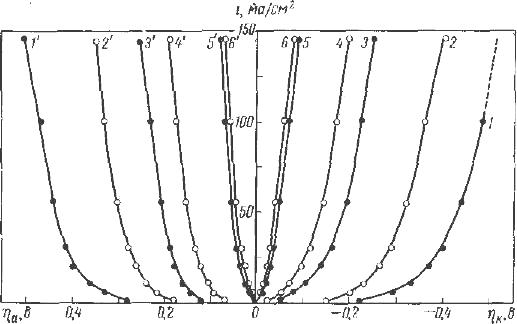
Рис. 2. Поляризационные кривые осаждения и растворения никеля в 1н. растворах NiSO4 и NiCl2 (pH 1,5)
1,1' - NiSO4, 25 и 50º; 2,2' - NiCl2, 25 и 50°; 3,3' – NiSO4, 100°; 4,4' – NiCl2, 100°; 5,5' — NiSO4, 200°; 6, 6' — NiCl2, 200°С
Перенапряжение анодной реакции (4) также связано с плотностью тока Тафелевской зависимостью, однако постоянная “ a “ для анодной реакции выше чем для катодной. Особенностью анодной реакции окисления никеля является наличие пассивного состояния в сульфатных растворах при потенциалах + 0.4 – 0.45В. Плотность тока перехода в пассивное состояние сильно зависит от рН раствора, уменьшаясь с возрастанием рН
В растворах хлорида никеля пассивация не наблюдается. Более того, даже при небольшой концентрации ионов хлора (0,05 н.) в электролите пассивация отсутствует (рис.5
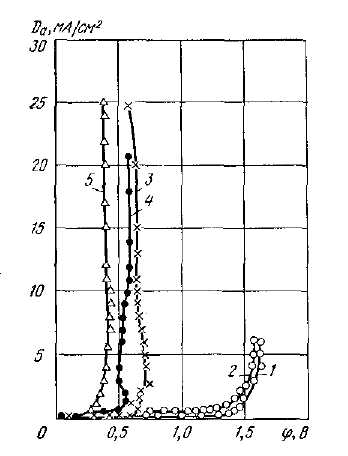
Рис. 3. Анодные поляризационные кривые, снятые при растворении электролитического никеля в 1 н. растворе NiSO4, температуре 25°С, рН = 4 и различной концентрации ионов хлора в растворе:
1 - 0,0 н. CI-; 2 - 0,015 н. С1-; 3 - 0,05 н. С1-; 4 - 0,3 н. С1-; 5 -1,0 н. С1-
Как и для катодной реакции, повышение температуры снижает перенапряжение анодной реакции, уменьшает влияние рН и хлор ионов. При температуре 2000С не происходит пассивации анодной реакции.
Все вышеизложенные факты позволяют утверждать правильность выводов А.Т. Ваграмяна о том, что никель как и другие металлы группы железа обладает высокой способностью к адсорбции чужеродных частиц, ингибирующих скорости как катодной, так и анодной реакций. В тщательно очищенных растворах и в инертной атмосфере такими частицами могут быть ионы и молекулы водорода, пленки гидрооксида никеля, образующиеся за счет повышения рН в прикатодном слое или пленки гидрооксидных соединений никеля высших степеней окисления, образующиеся при анодном окислении никеля. В недостаточно чистых растворах могут содержаться органические поверхностно активные соединения, способные адсорбироваться никелем. Повышение температуры снижает адсорбционную способность никеля и тем самым увеличивает скорости анодной и катодной реакций до величин, обеспечивающих равновесное значение бестокового потенциала.
2.Совместный разряд ионов никеля и водорода.
Из сопоставления величин стандартных равновесных потенциалов водорода и никеля следует, что совместное выделение компонентов на катоде возможно из растворов, имеющих рН4.2. В промышленных условиях совместный разряд наблюдается при рН 1.0. объясняется это тем, что , рН в прикатодном слое электролита за счет выделения водорода превосходит рН в объеме на 2-3 ед.
Перенапряжение выделения водорода на никеле не высоко. оно описывается уравнением Тафеля = а + в lg j, величины констант при температуре 200С равны а = 0,63В, в = 0,11В. Вследствие низкого перенапряжения выделения водорода электролиз никеля возможно вести с высоким выходом по току (Вт) только из слабокислых растворов. При рН = 4 равновесные потенциалы никелевого и водородного электродов совпадают, поэтому максимальный выход по току должен наблюдаться в этом диапазоне рН.
В более кислых растворах выход по току снижается с увеличением концентрации ионов водорода (рис.4).
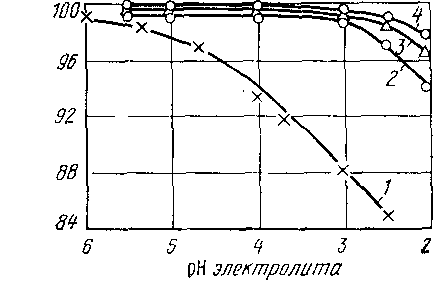
Рис. 4. Зависимость выхода по току Вт от рН и содержания С1- в электролите при плотности тока 150 А/м2,, t = 60° С. Электролит во всех опытах содержал 0,3 н. Н3ВО3.
1 - 2 н. Ni2+ + 1 н. Na+ + 2,56 н. SO42- + 0,44 н. Cl-;
2 - 2 н. Ni2+ + 1,5 н. Na+ + 2 н. SO42- + 1,5 н. Cl-;
3- 2 н. Ni2+ + 2 н. Na+ + 2 н. SO42- + 2 н. Cl-;
4 - 2 н. Ni2+ + 2 н. Na+ + 1 н. SO42- + 3 н. Cl-
3. Структура и свойства катодных осадков.
Высокое перенапряжение является причиной также того, что никель кристаллизуется с образованием осадков мелкокристаллической структуры, построенных столбчатыми зернами, (поперечный размер зерен 10-3-10-4 см), причем, при высоких температурах структура осадков резко изменяется – осадок никеля формируется крупными кристаллами изоморфной формы с правильными ограничениями.
Адсорбция чужеродных частиц различного происхождения и включение их в осадок, часто является причиной высоких внутренних напряжений, приводящих к деформации катодов в процессе наращивания металла, а также причиной образования осадков с питтингом.
При наращивании осадков толщиной свыше 1 мм возможно образование наростов глобулярной формы, получивших не совсем правильное название дендриты. Размеры дендритов сопоставимы с толщиной осадка. Согласно теории дендритообразования установлено, что дендриты возникают при попадании электропроводных частиц на поверхность растущего осадка. Такими частицами могут быть металлическая или графитовая пыль, анодный шлам и порошок никеля, образовавшийся в случае даже кратковременной работы участков поверхности катодов в режиме диффузной кинетики.
