- •Химическое равновесие введение
- •1. Теоретические основы химического равновесия
- •1.1. Типы равновесий в химических системах
- •Типы обратимых химических и физико-химических процессов
- •1.2. Условия химического равновесия
- •Термодинамическое условие химического равновесия
- •1.3. Закон действующих масс
- •1.4. Уравнение изотермы химической реакции. Влияние состава системы на направление химической реакции
- •1.5. Уравнения изобары и изохоры химической реакции. Влияние температуры на константу химического равновесия и направление химической реакции
- •Влияние температуры на величину константы равновесия и направление смещения равновесия на основе уравнения изобары химической реакции
- •1.6. Влияние давления на константу химического равновесия и направление химической реакции
- •Влияние давления на величину константы равновесия
- •1.7. Смещение химического равновесия
- •1.7.1. Определение направления смещения равновесия по принципу Ле Шателье
- •Смещение равновесия по принципу Ле Шателье
- •1.7.2. Определение направления смещения равновесия на основе термодинамических уравнений
- •1.8. Методы определения константы химического равновесия
- •Соотношение между величиной константы равновесия и выходом продукта реакции
- •Теоретические методы расчета константы равновесия
- •Экспериментальные методы определения константы равновесия
- •1.8.1. Термодинамический расчет константы химического равновесия
- •Термодинамические уравнения, необходимые для расчета
- •Уравнения расчета δg (т) при разных приближениях расчета δСр
- •1.8.2. Расчет константы химического равновесия в статистической термодинамике
- •1.8.3. Экспериментальное определение константы химического равновесия
- •Выбор анализируемого вещества на примере предлагаемых обратимых процессов
- •Выбор метода определения концентрации анализируемого вещества на примере предлагаемых в табл. 1.12 процессов
- •Алгоритм расчета равновесного состава системы объемом V м3
- •1.9. Задания для обучения и самоконтроля
- •Тест 1.9.1. Признаки химического равновесия
- •Тест 1.9.2. Типы равновесий в обратимых процессах
- •Тест 1.9.3. Термодинамические уравнения, отражающие влияние давления, температуры, состава системы на состояние химического равновесия
- •Тест 1.9.4. Выражение константы равновесия для реакции типа
- •Тест 1.9.5. Соотношение между константами равновесия Кр и Кс для реакции
- •Тест 1.9.6. Термодинамические уравнения, характеризующие состояние равновесия
- •2. Экспериментальные работы
- •Общие правила работы и техники безопасности в лаборатории
- •Основные правила проведения эксперимента
- •Правила оформления отчета
- •2.1. Тесты открытой формы для допуска студентов к работе
- •2.2. Лабораторные работы
- •Работа 1. Изучение химического равновесия гомогенной реакции в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Варианты заданий к работе 1
- •Задание к работе 1
- •Экспериментальные данные к работе 1
- •3. Обработка экспериментальных данных
- •Алгоритм расчета равновесных концентраций
- •Объединенные экспериментальные и расчетные данные
- •4. Выводы по работе
- •В растворе гидролизующейся соли
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •5 Мл раствора во 2-ю колбу,
- •2,5 Мл раствора в 3-ю колбу,
- •0,5 Мл раствора в 4-ю колбу;
- •3. Обработка экспериментальных данных
- •Экспериментальные и расчетные данные
- •Характеристика процесса гидролиза соли
- •4. Выводы по работе
- •Работа 3. Изучение химического равновесия в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Экспериментальные и расчетные данные к работе
- •3. Обработка экспериментальных данных
- •4. Выводы по работе
- •Контрольные вопросы
- •3. Задания для самостоятельной работы
- •3.1. Примеры решения задач
- •0,83 Моль.
- •3.2. Многовариантные задачи
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Значения коэффициентов уравнения
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •4. Тесты итогового контроля
- •Образец теста первого вида
- •Образец теста второго вида
- •Библиографический список
- •Приложения
- •1. Ответы на тесты для обучения и самоконтроля в разделе 1.9
- •Фундаментальные физические постоянные
- •Соотношения между единицами физических величин
- •Приставки для образования кратных и дольных единиц
- •Предельная молярная электрическая проводимость ионов в воде
- •Произведение растворимости малорастворимых солей при 25 оС
- •Константы диссоциации кислот и оснований в водных растворах при 25 оС
- •Оглавление
1.5. Уравнения изобары и изохоры химической реакции. Влияние температуры на константу химического равновесия и направление химической реакции
На основе уравнений
Гиббса – Гельмгольца, определяющих
влияние температуры на изменение
термодинамических потенциалов (ΔGr
и ΔAr),
и уравнений изотермы химической реакции
Я. Вант-Гофф вывел уравнения изобары и
изохоры химической реакции в
дифференциальной форме.
Уравнение
изобары
![]() .
(1.8)
.
(1.8)
Уравнение изохоры
![]() .
(1.9)
.
(1.9)
Наиболее часто используется уравнение изобары химической реакции (1.8), анализ которого представлен в табл. 1.6.
Таблица 1.6
Влияние температуры на величину константы равновесия и направление смещения равновесия на основе уравнения изобары химической реакции
Тип реакции
|
Знак Нr |
Знак
|
Изменение температуры |
Изменение Кр |
Направление смещения равновесия |
Экзо- термическая |
Н < 0 |
|
T ↑
T ↓ |
Kp ↓
Kp ↑ |
|
Эндо- термическая |
Н > 0
|
> 0 |
Т ↑
Т ↓ |
Кр ↑
Кр ↓ |
|
Без выделения или поглощения теплоты |
Н 0 |
0 |
Т ↑
Т ↓ |
Кр = const
Kp = const |
Нет смещения равновесия |
Уравнения (1.8) и (1.9) устанавливают связь между константой равновесия (Кр или Кс), температурой и изменениями энтальпии ΔHr (при
Р = const) или внутренней энергии ΔUr (при V = const) химической реакции. Поэтому уравнения (1.8) и (1.9) применяют для установления влияния температуры на величину константы равновесия и на направление смещения равновесия в сторону прямой () или в сторону обратной () реакции (см. табл. 1.6).
Для расчета константы равновесия при заданной Т или теплового эффекта реакции в интервале температур дифференциальное уравнение изобары химической реакции (1.8) интегрируют. Для более точных расчетов ΔHr(Т) используют уравнение Кирхгофа, учитывающее влияние температуры на величину ΔHr(Т).
При интегрировании уравнения изобары химической реакции (1.8) можно получить два вида интегральных уравнений:
![]() ;
(1.10)
;
(1.10)
![]() .
(1.11)
.
(1.11)
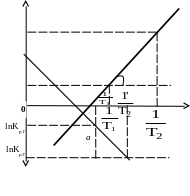
Уравнение (1.10) используют для построения графика в координатах
ln Кр = f(1/T), имеющего вид прямой линии, по тангенсу угла наклона кото- рого определяют ΔHr реакции графическим методом (рис. 1.1).
2 ln Kp2
1 a
ln Kp1 b
1 ’ b’ 2
|
|
Рис. 1.1. Зависимость ln
Kp
от
![]() для экзотермических (12)
для экзотермических (12)
и эндотермических (12) реакций
Из уравнения (1.10)
следует, что ![]() = tg
или
= tg
или ![]() = tg
′,
которые рассчитываются по уравнениям
= tg
′,
которые рассчитываются по уравнениям
tg
=
![]() =
=
![]() =
или
=
или
tg
′
=
![]() =
=
![]() =
= ![]() .
.
Величины tg или tg ′ всегда определяют по отношению отрезков
а и b или а′ и b′, взятых в единицах масштаба на рис. 1.1.
Уравнение (1.11) используют для расчета Нr, если известны константы равновесия при двух температурах, или для расчета константы равновесия при одной температуре, если известны константа равновесия при другой температуре и изменение энтальпии реакции.
Уравнение изохоры химической реакции (1.9) интегрируют, а затем применяют подобно уравнению изобары химической реакции, только вместо изменения энтальпии Нr используют изменение внутренней энергии Ur, рассчитываемое по уравнению Ur = Hr RT.