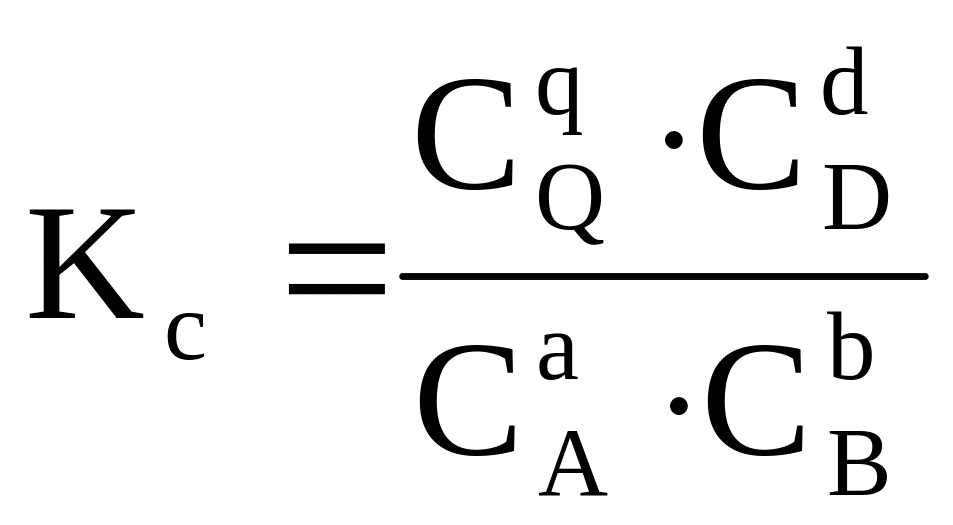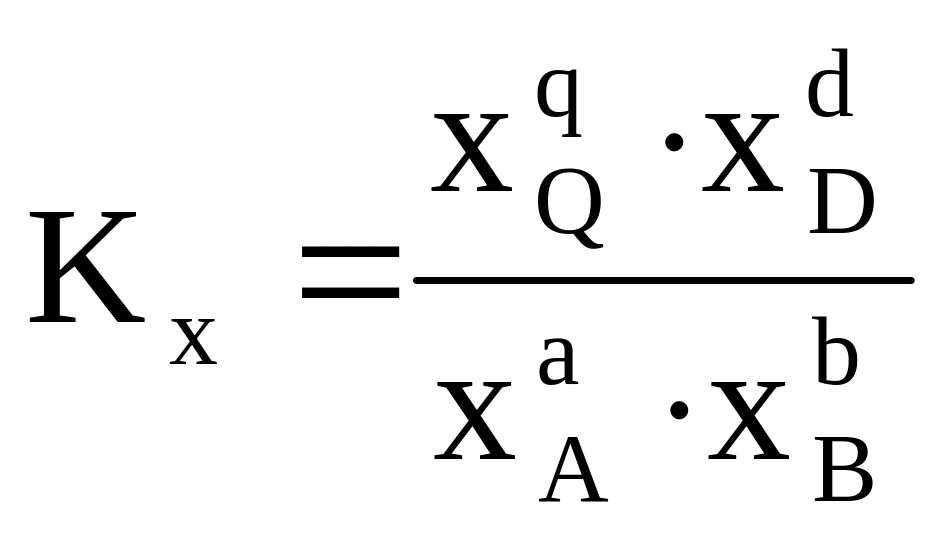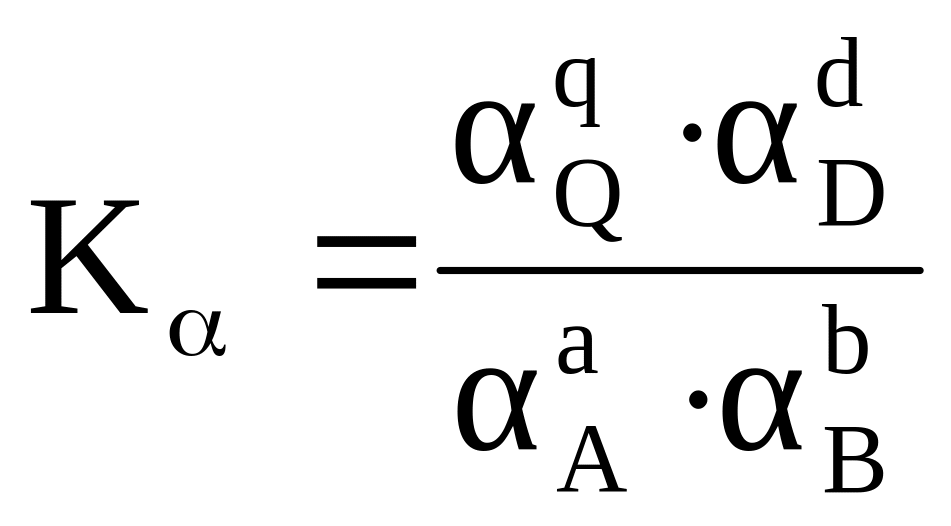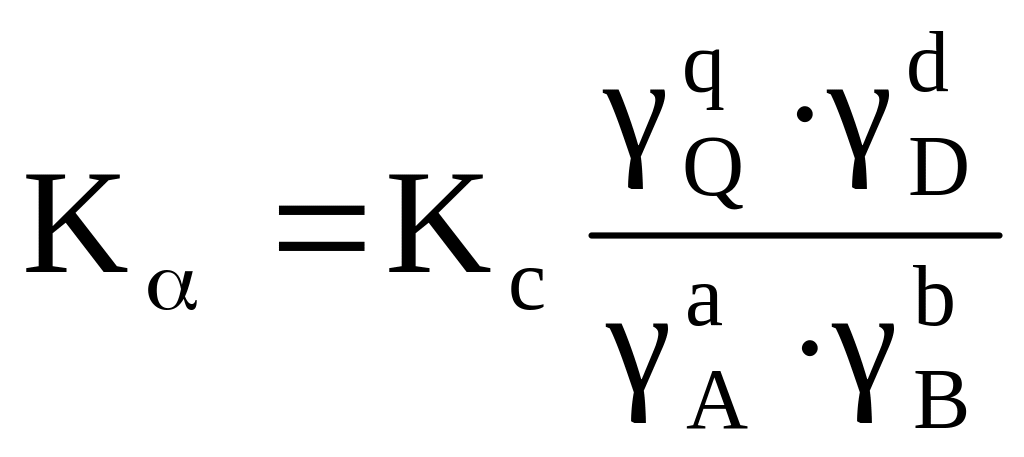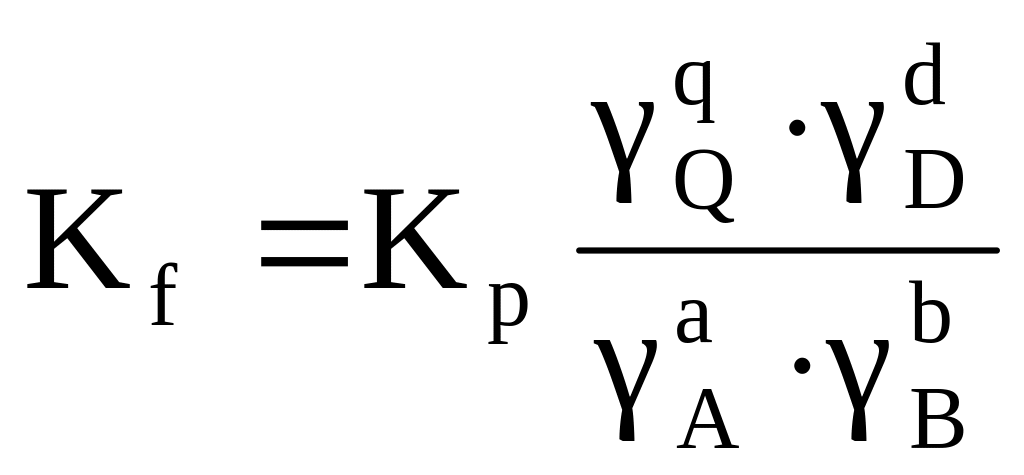- •Химическое равновесие введение
- •1. Теоретические основы химического равновесия
- •1.1. Типы равновесий в химических системах
- •Типы обратимых химических и физико-химических процессов
- •1.2. Условия химического равновесия
- •Термодинамическое условие химического равновесия
- •1.3. Закон действующих масс
- •1.4. Уравнение изотермы химической реакции. Влияние состава системы на направление химической реакции
- •1.5. Уравнения изобары и изохоры химической реакции. Влияние температуры на константу химического равновесия и направление химической реакции
- •Влияние температуры на величину константы равновесия и направление смещения равновесия на основе уравнения изобары химической реакции
- •1.6. Влияние давления на константу химического равновесия и направление химической реакции
- •Влияние давления на величину константы равновесия
- •1.7. Смещение химического равновесия
- •1.7.1. Определение направления смещения равновесия по принципу Ле Шателье
- •Смещение равновесия по принципу Ле Шателье
- •1.7.2. Определение направления смещения равновесия на основе термодинамических уравнений
- •1.8. Методы определения константы химического равновесия
- •Соотношение между величиной константы равновесия и выходом продукта реакции
- •Теоретические методы расчета константы равновесия
- •Экспериментальные методы определения константы равновесия
- •1.8.1. Термодинамический расчет константы химического равновесия
- •Термодинамические уравнения, необходимые для расчета
- •Уравнения расчета δg (т) при разных приближениях расчета δСр
- •1.8.2. Расчет константы химического равновесия в статистической термодинамике
- •1.8.3. Экспериментальное определение константы химического равновесия
- •Выбор анализируемого вещества на примере предлагаемых обратимых процессов
- •Выбор метода определения концентрации анализируемого вещества на примере предлагаемых в табл. 1.12 процессов
- •Алгоритм расчета равновесного состава системы объемом V м3
- •1.9. Задания для обучения и самоконтроля
- •Тест 1.9.1. Признаки химического равновесия
- •Тест 1.9.2. Типы равновесий в обратимых процессах
- •Тест 1.9.3. Термодинамические уравнения, отражающие влияние давления, температуры, состава системы на состояние химического равновесия
- •Тест 1.9.4. Выражение константы равновесия для реакции типа
- •Тест 1.9.5. Соотношение между константами равновесия Кр и Кс для реакции
- •Тест 1.9.6. Термодинамические уравнения, характеризующие состояние равновесия
- •2. Экспериментальные работы
- •Общие правила работы и техники безопасности в лаборатории
- •Основные правила проведения эксперимента
- •Правила оформления отчета
- •2.1. Тесты открытой формы для допуска студентов к работе
- •2.2. Лабораторные работы
- •Работа 1. Изучение химического равновесия гомогенной реакции в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Варианты заданий к работе 1
- •Задание к работе 1
- •Экспериментальные данные к работе 1
- •3. Обработка экспериментальных данных
- •Алгоритм расчета равновесных концентраций
- •Объединенные экспериментальные и расчетные данные
- •4. Выводы по работе
- •В растворе гидролизующейся соли
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •5 Мл раствора во 2-ю колбу,
- •2,5 Мл раствора в 3-ю колбу,
- •0,5 Мл раствора в 4-ю колбу;
- •3. Обработка экспериментальных данных
- •Экспериментальные и расчетные данные
- •Характеристика процесса гидролиза соли
- •4. Выводы по работе
- •Работа 3. Изучение химического равновесия в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Экспериментальные и расчетные данные к работе
- •3. Обработка экспериментальных данных
- •4. Выводы по работе
- •Контрольные вопросы
- •3. Задания для самостоятельной работы
- •3.1. Примеры решения задач
- •0,83 Моль.
- •3.2. Многовариантные задачи
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Значения коэффициентов уравнения
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •4. Тесты итогового контроля
- •Образец теста первого вида
- •Образец теста второго вида
- •Библиографический список
- •Приложения
- •1. Ответы на тесты для обучения и самоконтроля в разделе 1.9
- •Фундаментальные физические постоянные
- •Соотношения между единицами физических величин
- •Приставки для образования кратных и дольных единиц
- •Предельная молярная электрическая проводимость ионов в воде
- •Произведение растворимости малорастворимых солей при 25 оС
- •Константы диссоциации кислот и оснований в водных растворах при 25 оС
- •Оглавление
Термодинамическое условие химического равновесия
№ п/п |
Условия протекания реакции |
Термодинамическая функция |
Критерии самопроизвольной реакции |
Критерий равновесия |
1 |
Т = const P = const |
Энергия Гиббса
|
G
|
= O |
2 |
Т = const V = const |
Энергия Гельмгольца
|
А
|
= О |
В практике изучения
химического равновесия наиболее часто
рассчитывается изменение энергии Гиббса
![]() по
следующим причинам:
по
следующим причинам:
- химические реакции чаще протекают в системах при Т = const,
P = const, чем при Т = const, V = const;
- термодинамические свойства многих веществ, приведенные в спра- вочниках, рассчитаны при Т = 298 К; Р = 1,01 · 105 Па;
- константа химического равновесия связана с изменением энергии Гиббса ΔGr простой зависимостью.
Таким образом, общими условиями устойчивого химического равновесия являются следующие:
1. Динамичность равновесия, т. е. протекание прямой и обратной ре-
акций с равными скоростями: это кинетическое условие химичес- кого равновесия;
2. Неизменность равновесного состава системы Сi = const при посто- янстве внешних параметров Т, Р, V = const – это концентрационное усло- вие химического равновесия;
3. Минимальное постоянное значение энергии Гиббса Gr или энергии Гельмгольца Ar: ΔGr = 0 или ΔAr = 0 – это термодинамическое условие химического равновесия;
4. Подвижность равновесия, т. е. возможность смещения равновесия при изменении параметров системы: Т, Р, Сi, pi;
5. Возможность подхода к состоянию равновесия с двух противопо-
ложных сторон: со стороны прямой и со стороны обратной реакции.
1.3. Закон действующих масс
На основе изучения кинетики обратимых химических реакций, протекающих при постоянной температуре, К. Гульдберг и П. Вааге сформулировали закон действующих масс для химического равновесия:
Соотношение равновесных концентраций реагирующих веществ с учетом их стехиометрических коэффициентов в уравнении реакции равно константе равновесия при Т = const.
Математически закон действующих масс записывается в виде константы равновесия, выраженной через равновесные концентрации или другие величины, характеризующие состав системы, при достижении равновесия как со стороны прямой (Кпр), так и со стороны обратной (Кобр) реакции (табл. 1.3).
Таблица 1.3
Выражение закона действующих масс для реакции типа аА + bB ⇄ qQ + dD
Путь достижения равновесия |
Константа равновесия |
Соотношение констант равновесия |
Прямая реакция
Обратная реакция |
Kпр =
Кобр =
|
|
Константы равновесия, выраженные любым способом, зависят от температуры и природы реагирующих веществ и не зависят от равновесного состава системы. Однако способ выражения состава системы влияет на численное значение константы равновесия (табл. 1.4).
Таблица 1.4
Влияние способа выражения состава системы на вид константы равновесия при Т = const для гомогенной реакции типа аА + bB ⇄ qQ + dD
Тип системы |
Равновесный состав системы |
Выражение константы равновесия |
Соотношение констант равновесия |
|
Способ выражения состава |
Соотношение составов |
|||
Идеальная система |
Концентрация Сi, моль/м3 |
рi = Сi · R T
рi = хi · P |
|
Kp = Kc(R T)
Kp = Kx · Р |
Парциальное давление рi, Па |
|
|||
Молярная доля хi |
|
|||
Реальная система |
Активность аi, моль/м3 |
i = i · Ci
fi = i pi
|
|
|
Фугитивность fi, Па |
|
|||
Примечания: 1. = (q + d) – (a + b) изменение числа молей газообразных ве- ществ в ходе реакции.
2. i – коэффициент активности или фугитивности вещества.
3. Р – общее давление в системе.
Все уравнения для констант равновесия (см. табл. 1.4) являются мате-
матическим выражением закона действующих масс.
Константы химического равновесия Кс и Кр (К и Кf) безразмерны для реакций, идущих без изменения числа молей газообразных реагирующих веществ: = 0. При 0 единицами измерения Кр (Кf )являются единицы давления, Кс (К) – единицы концентрации, взятые в степени .
Константа химического равновесия Кх безразмерна, так как молярные доли являются относительными величинами, и в отличие от констант, выраженных другим способом, зависит от общего давления в системе.
В случае гетерогенных обратимых реакций в выражение константы химического равновесия входят равновесные парциальные давления или концентрации газов, или концентрации растворённых веществ, участвующих в реакции, так как активности твердых веществ или жидкостей при одновременном участии газов принимаются равными единице.
Например, для
реакции С(графит)
+ СО2(г) ⇄
2СО(г)
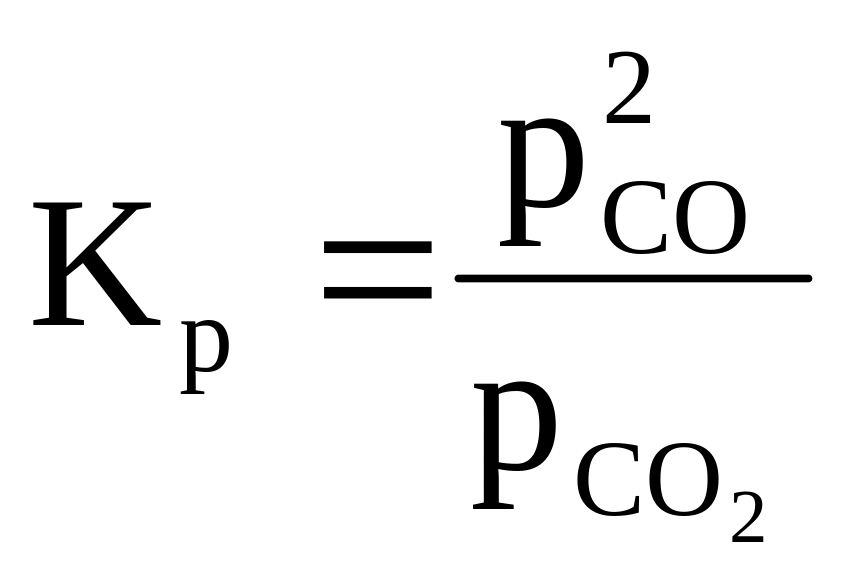 .
.
Закон действующих масс имеет большое значение в учении о химическом равновесии. Из него следует, что в системе, в которой протекает обратимая реакция:
- соотношение равновесных величин, характеризующих состав системы при Т = const, является постоянным и равным константе равновесия;
- константа равновесия не зависит от того, какие из реагирующих ве- ществ будут исходными веществами, а какие – продуктами реакции;
- константа равновесия не зависит от начального состава исходных ве-
ществ;
- для расчета константы равновесия достаточно экспериментально оп- ределить равновесную концентрацию одного из реагирующих веществ.