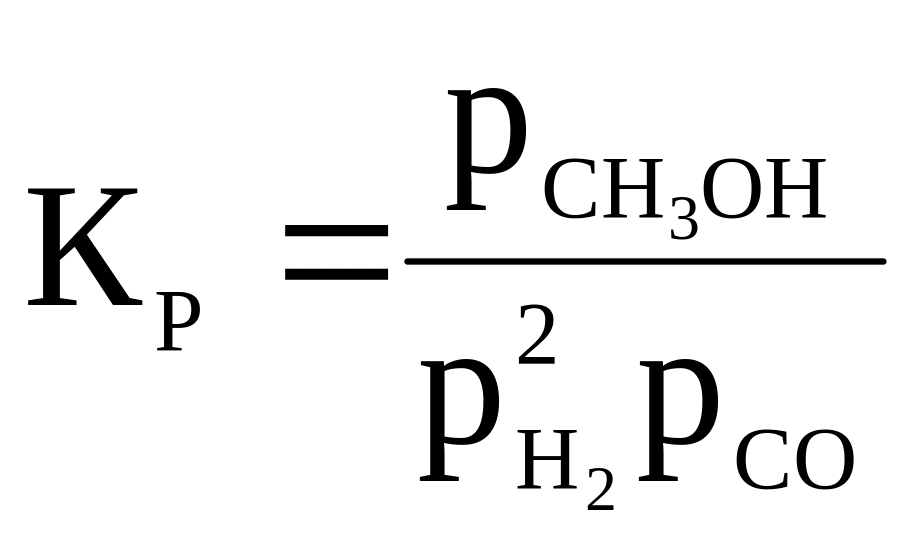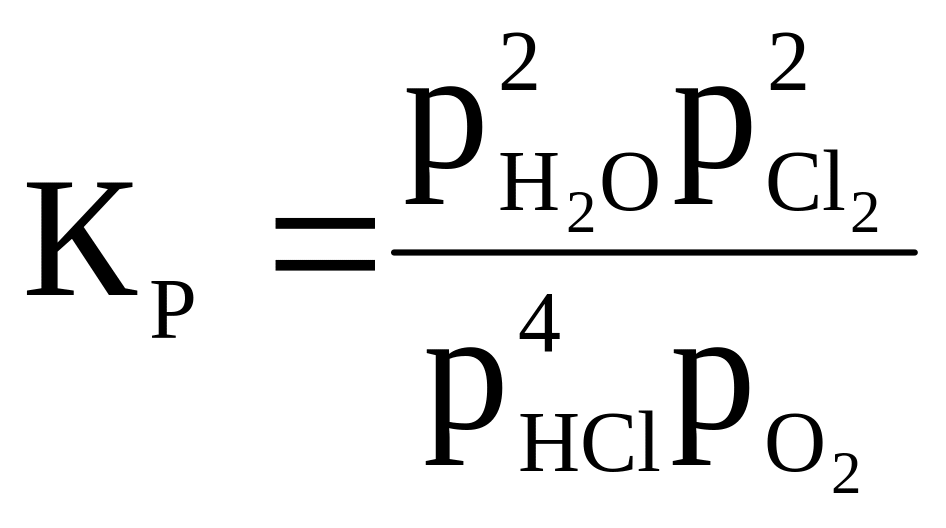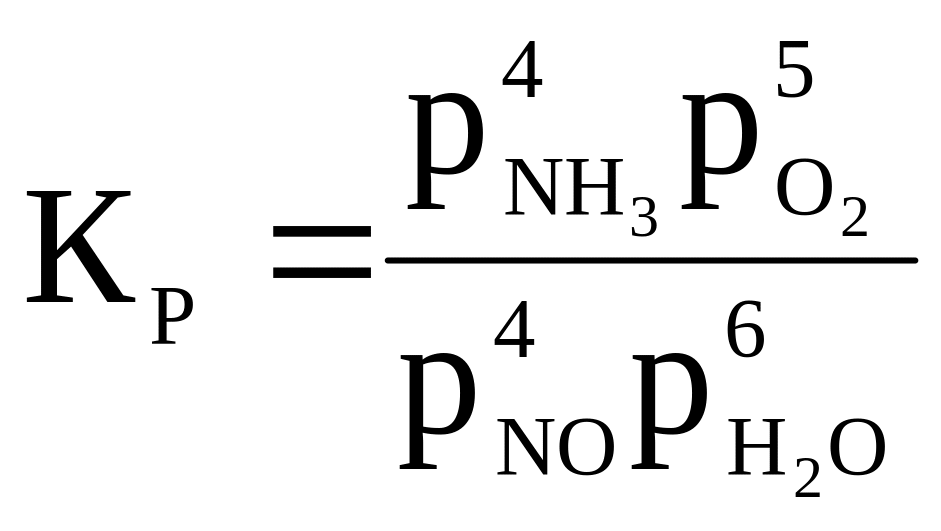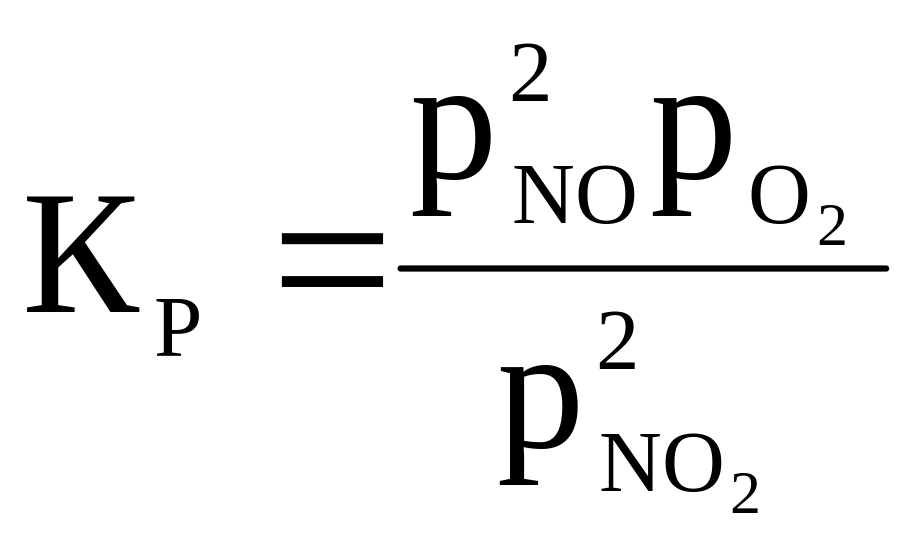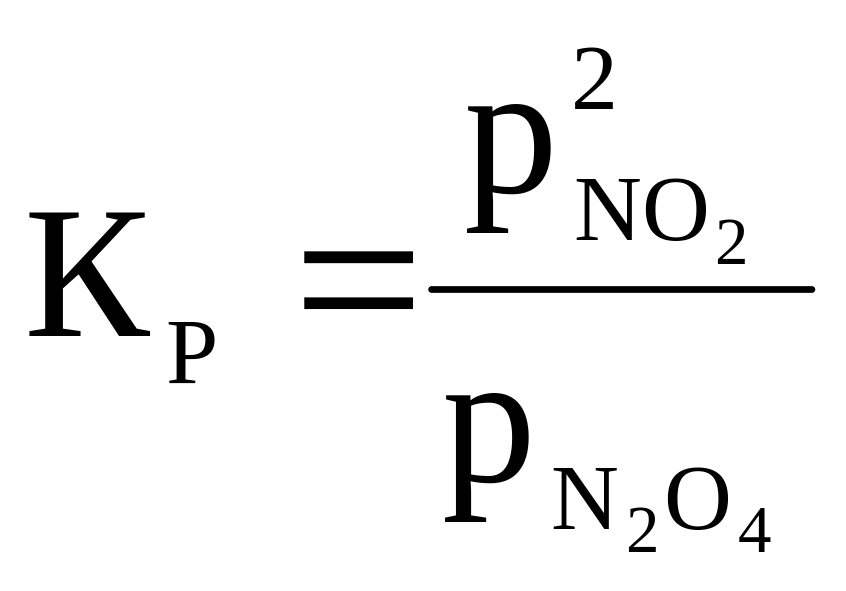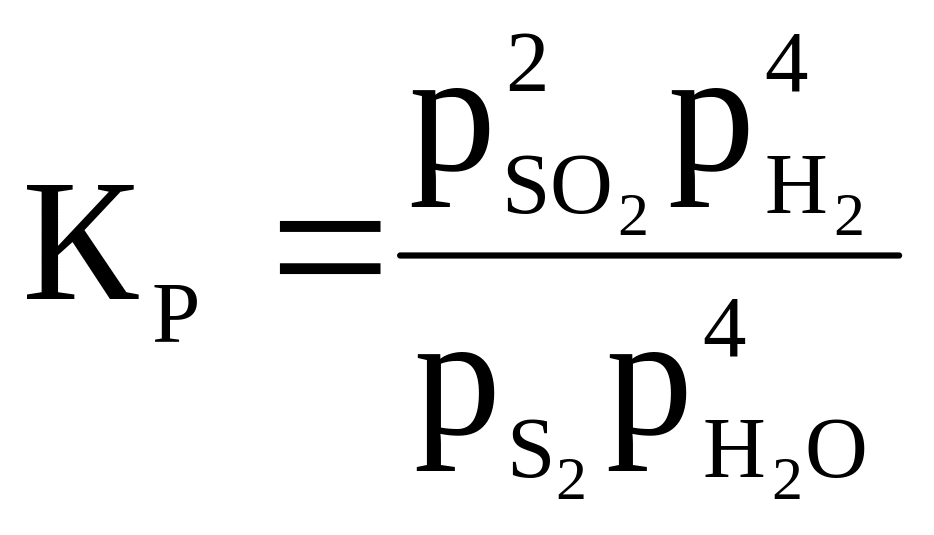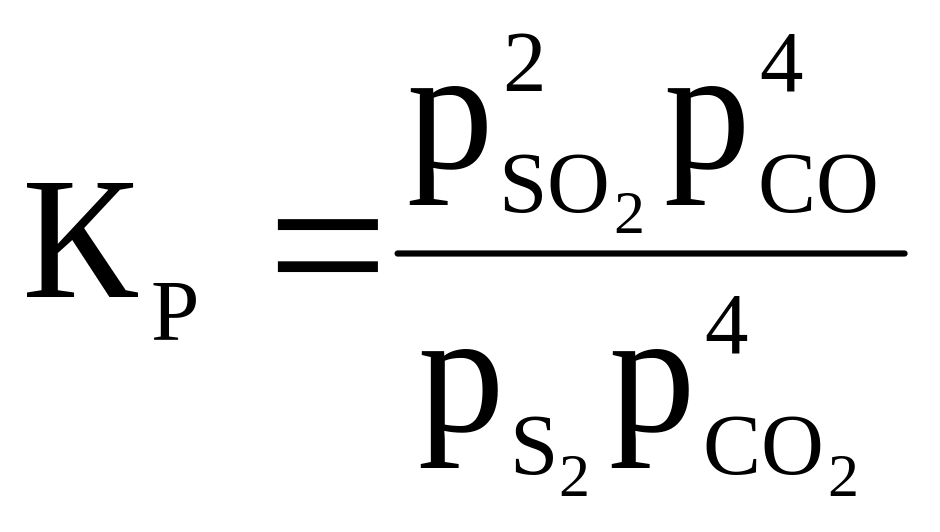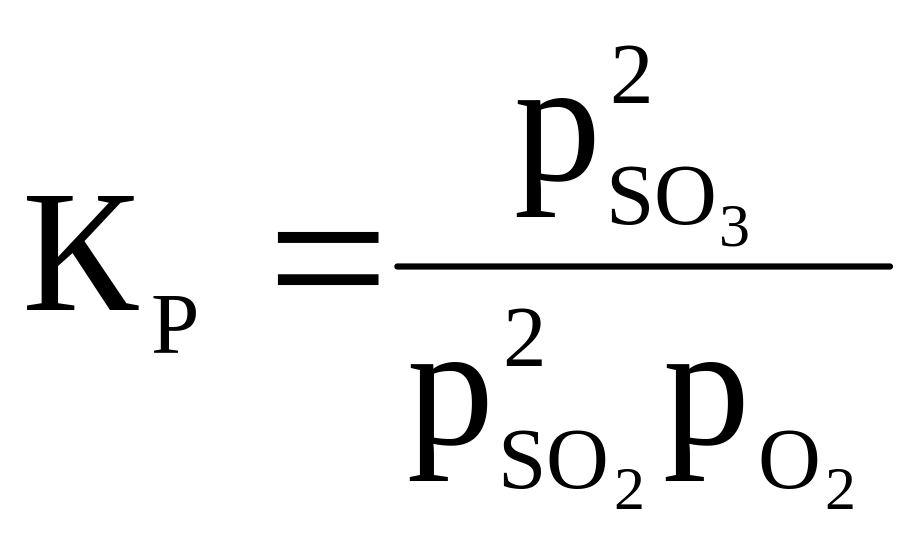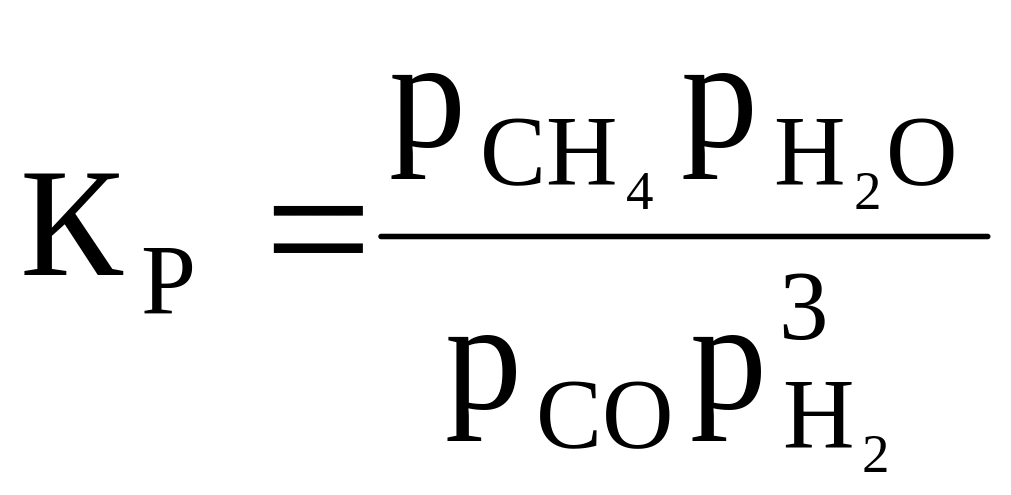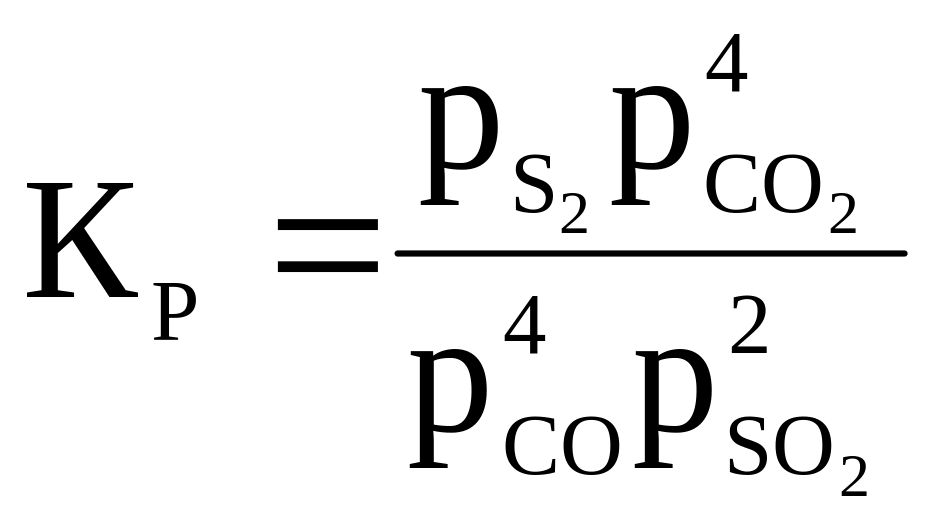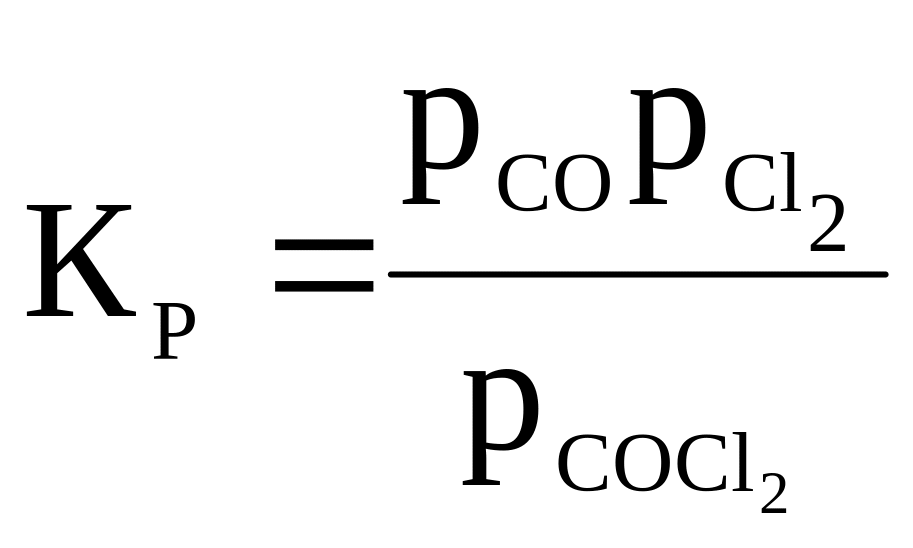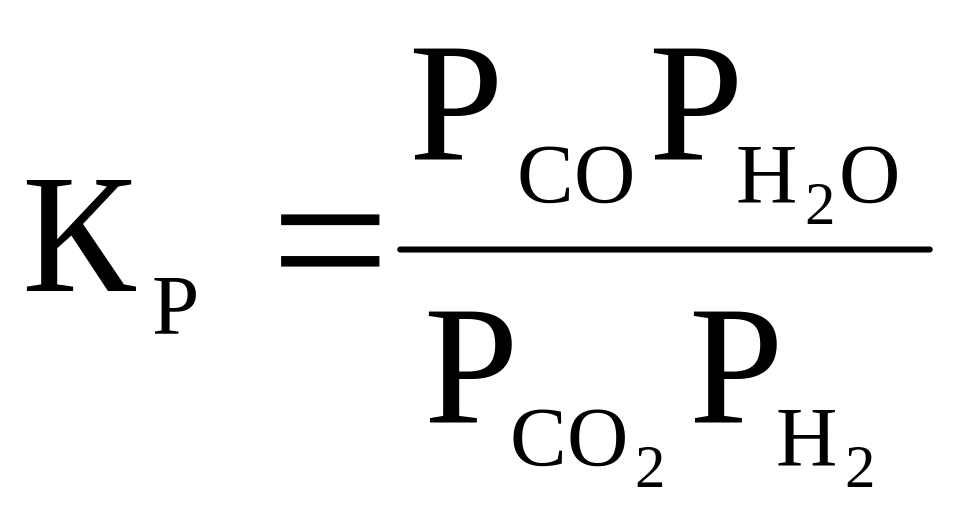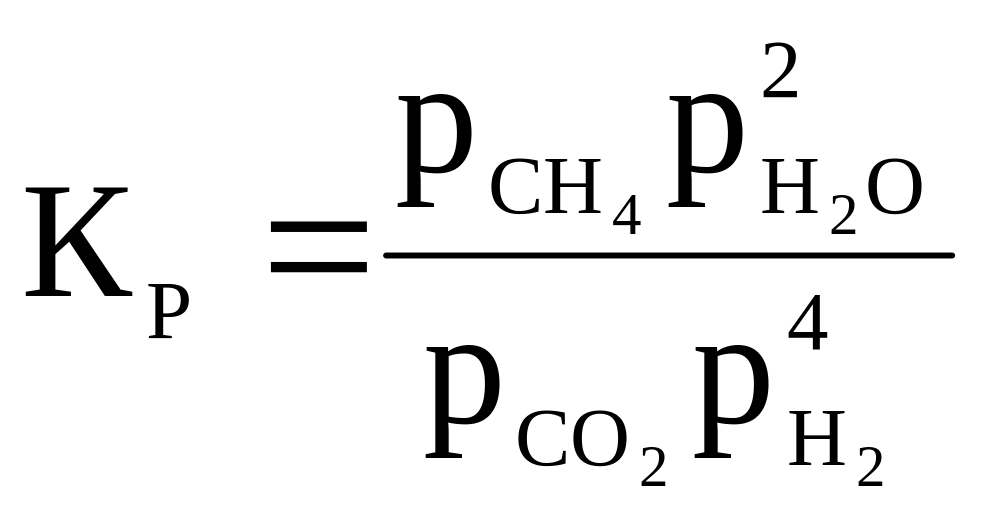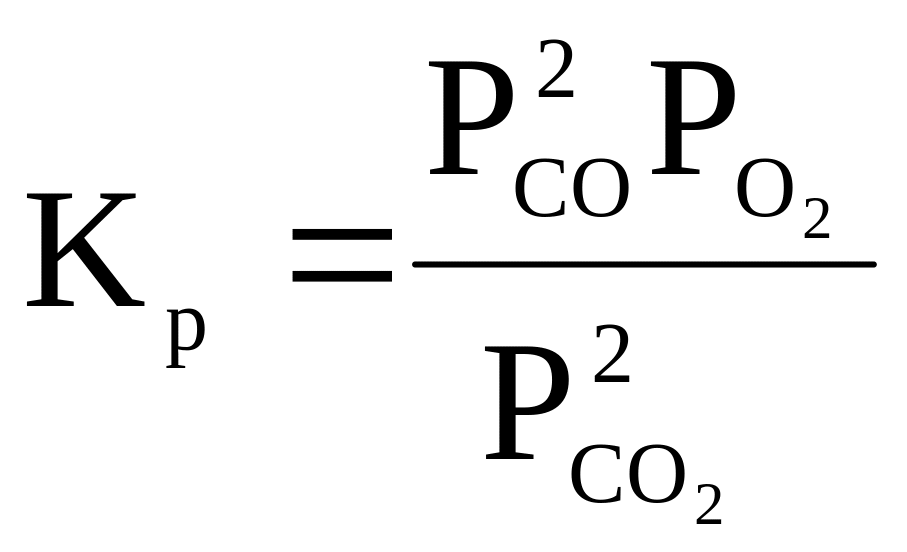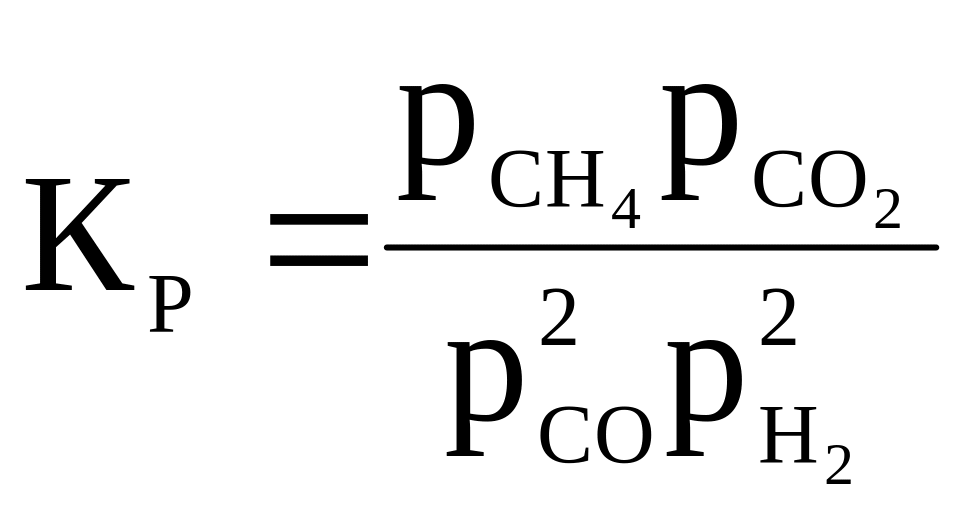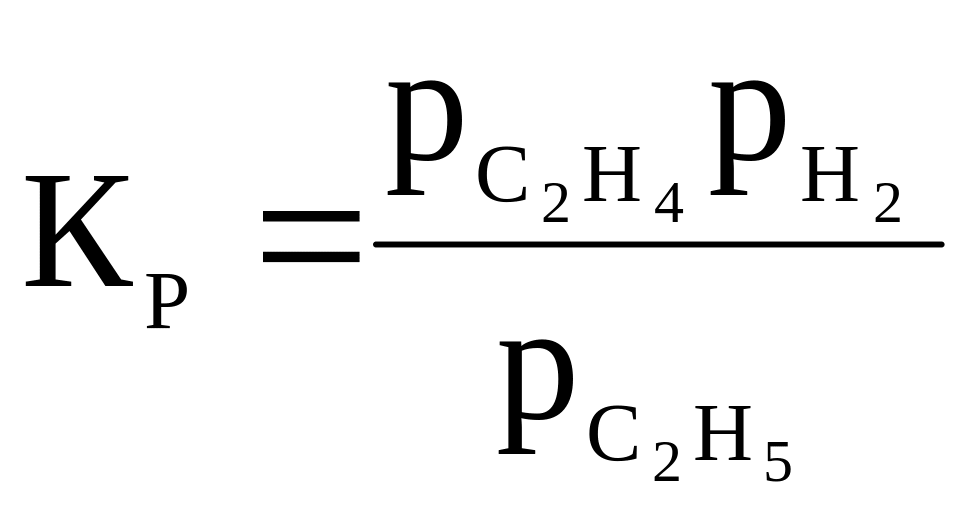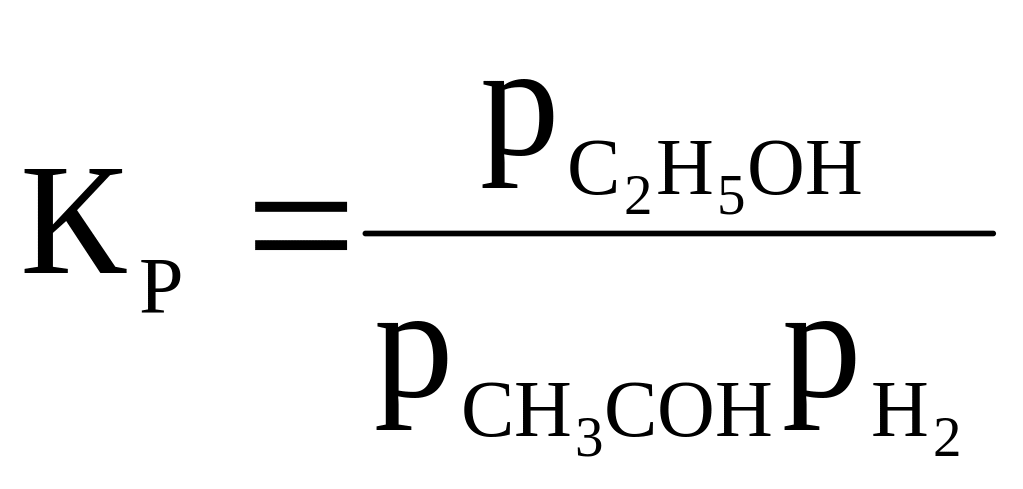- •Химическое равновесие введение
- •1. Теоретические основы химического равновесия
- •1.1. Типы равновесий в химических системах
- •Типы обратимых химических и физико-химических процессов
- •1.2. Условия химического равновесия
- •Термодинамическое условие химического равновесия
- •1.3. Закон действующих масс
- •1.4. Уравнение изотермы химической реакции. Влияние состава системы на направление химической реакции
- •1.5. Уравнения изобары и изохоры химической реакции. Влияние температуры на константу химического равновесия и направление химической реакции
- •Влияние температуры на величину константы равновесия и направление смещения равновесия на основе уравнения изобары химической реакции
- •1.6. Влияние давления на константу химического равновесия и направление химической реакции
- •Влияние давления на величину константы равновесия
- •1.7. Смещение химического равновесия
- •1.7.1. Определение направления смещения равновесия по принципу Ле Шателье
- •Смещение равновесия по принципу Ле Шателье
- •1.7.2. Определение направления смещения равновесия на основе термодинамических уравнений
- •1.8. Методы определения константы химического равновесия
- •Соотношение между величиной константы равновесия и выходом продукта реакции
- •Теоретические методы расчета константы равновесия
- •Экспериментальные методы определения константы равновесия
- •1.8.1. Термодинамический расчет константы химического равновесия
- •Термодинамические уравнения, необходимые для расчета
- •Уравнения расчета δg (т) при разных приближениях расчета δСр
- •1.8.2. Расчет константы химического равновесия в статистической термодинамике
- •1.8.3. Экспериментальное определение константы химического равновесия
- •Выбор анализируемого вещества на примере предлагаемых обратимых процессов
- •Выбор метода определения концентрации анализируемого вещества на примере предлагаемых в табл. 1.12 процессов
- •Алгоритм расчета равновесного состава системы объемом V м3
- •1.9. Задания для обучения и самоконтроля
- •Тест 1.9.1. Признаки химического равновесия
- •Тест 1.9.2. Типы равновесий в обратимых процессах
- •Тест 1.9.3. Термодинамические уравнения, отражающие влияние давления, температуры, состава системы на состояние химического равновесия
- •Тест 1.9.4. Выражение константы равновесия для реакции типа
- •Тест 1.9.5. Соотношение между константами равновесия Кр и Кс для реакции
- •Тест 1.9.6. Термодинамические уравнения, характеризующие состояние равновесия
- •2. Экспериментальные работы
- •Общие правила работы и техники безопасности в лаборатории
- •Основные правила проведения эксперимента
- •Правила оформления отчета
- •2.1. Тесты открытой формы для допуска студентов к работе
- •2.2. Лабораторные работы
- •Работа 1. Изучение химического равновесия гомогенной реакции в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Варианты заданий к работе 1
- •Задание к работе 1
- •Экспериментальные данные к работе 1
- •3. Обработка экспериментальных данных
- •Алгоритм расчета равновесных концентраций
- •Объединенные экспериментальные и расчетные данные
- •4. Выводы по работе
- •В растворе гидролизующейся соли
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •5 Мл раствора во 2-ю колбу,
- •2,5 Мл раствора в 3-ю колбу,
- •0,5 Мл раствора в 4-ю колбу;
- •3. Обработка экспериментальных данных
- •Экспериментальные и расчетные данные
- •Характеристика процесса гидролиза соли
- •4. Выводы по работе
- •Работа 3. Изучение химического равновесия в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Экспериментальные и расчетные данные к работе
- •3. Обработка экспериментальных данных
- •4. Выводы по работе
- •Контрольные вопросы
- •3. Задания для самостоятельной работы
- •3.1. Примеры решения задач
- •0,83 Моль.
- •3.2. Многовариантные задачи
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Значения коэффициентов уравнения
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •4. Тесты итогового контроля
- •Образец теста первого вида
- •Образец теста второго вида
- •Библиографический список
- •Приложения
- •1. Ответы на тесты для обучения и самоконтроля в разделе 1.9
- •Фундаментальные физические постоянные
- •Соотношения между единицами физических величин
- •Приставки для образования кратных и дольных единиц
- •Предельная молярная электрическая проводимость ионов в воде
- •Произведение растворимости малорастворимых солей при 25 оС
- •Константы диссоциации кислот и оснований в водных растворах при 25 оС
- •Оглавление
Варианты заданий
Номер варианта |
Реакция |
Выражение константы химического равновесия |
Т, К |
1 |
2H2 + CO ⇄ CH3OH |
|
800 |
2 |
4HCl + O2 ⇄ 2H2O + 2Cl2 |
|
750 |
3 |
NH4Cl ⇄ NH3 + HCl |
|
455 |
4 |
2N2 + 6H2O ⇄ 4NH3 + 3O2 |
|
1 300 |
5 |
4NO + 6H2O ⇄ 4NH3 + 5O2 |
|
1 000 |
6 |
2NO2 ⇄ 2NO + O2 |
|
700 |
Продолжение табл. 3.4
Номер варианта |
Реакция |
Выражение константы химического равновесия |
Т, К |
7 |
N2O4 ⇄ 2NO2 |
|
400 |
8 |
Mg(OH)2 ⇄ MgO + H2O |
|
500 |
9 |
CaCO3 ⇄ CaO + CO2 |
|
1 000 |
10 |
Ca(OH)2 ⇄ CaO + H2O |
|
500 |
11 |
S2 + 4H2O ⇄ 2SO2 + 4H2 |
|
1 000 |
12 |
S2 + 4CO2 ⇄ 2SO2 + 4CO |
|
900 |
13 |
2SO2 + O2 ⇄ 2SO3 |
|
700 |
14 |
SO2 + Cl2 ⇄ SO2Cl2 |
|
400 |
15 |
CO + 3H2 ⇄ CH4 + H2O |
|
1 000 |
16 |
4CO + 2SO2 ⇄ S2 + 4CO2 |
|
900 |
17 |
COCl2 ⇄ CO + Cl2 |
|
400 |
18 |
CO2 + H2 ⇄ H2O + СO |
|
1 200 |
19 |
CO2 + 4H2 ⇄ CH4 + 2H2O |
|
1 000 |
20 |
2CO2 ⇄ 2CO + O2 |
|
700 |
21 |
2CO + 2H2 ⇄ CH4 + CO2 |
|
900 |
22 |
C2H6 ⇄ C2H4 + H2 |
|
400 |
Окончание табл. 3.4
Номер варианта |
Реакция |
Выражение константы химического равновесия |
Т, К |
23 |
C2H5OH ⇄ C2H4 + H2O |
|
400 |
24 |
CH3CHO + H2 ⇄ C2H5OH |
|
500 |
25 |
C6H6 + 3H2 ⇄ C6H12 |
|
600 |
Таблица 3.4а
Значения коэффициентов уравнения
Номер варианта |
a |
b |
c |
d |
1 |
3 724 |
9,129 8 |
0,003 08 |
3,401 |
2 |
5 750 |
2,136 |
0,000 857 |
4,710 |
3 |
9 650 |
1,83 |
0,003 24 |
28,239 |
4 |
66 250 |
1,75 |
0 |
10,206 |
5 |
–47 500 |
1,75 |
0 |
13,706 |
6 |
5 749 |
1,75 |
0,000 5 |
7,899 |
7 |
2 692 |
1,75 |
0,004 83 |
1,944 |
8 |
4 600 |
0,623 |
0,001 02 |
17,776 |
9 |
9 680 |
1,385 |
0,000 219 |
17,756 |
10 |
5 650 |
0,67 |
0,000 414 |
9,616 |
11 |
13 810 |
0,877 |
0,002 67 |
8,386 |
12 |
23 000 |
4,34 |
0,001 62 |
2,576 |
13 |
10 373 |
1,222 |
0 |
18,806 |
14 |
2 250 |
1,75 |
0,000 455 |
7,206 |
15 |
9 874 |
7,14 |
0,001 88 |
1,371 |
16 |
23 000 |
4,34 |
0,000 000 2 |
2,576 |
17 |
5 020 |
1,75 |
0 |
3,748 |
18 |
2 203 |
0 |
0,000 051 6 |
2,3 |
19 |
7 674 |
6,23 |
0,000 906 |
1,291 |
20 |
29 500 |
1,75 |
0,001 215 |
3,29 |
21 |
11 088 |
3,113 |
0,002 852 4 |
1,483 |
22 |
6 365 |
2,961 |
0,000 766 |
2,344 |
23 |
1 485 |
7,54 |
0,004 25 |
7,006 |
24 |
1 522 |
5,42 |
0,002 29 |
2,810 |
25 |
9 590 |
9,919 4 |
0,002 285 |
6,452 |
Задача 3.5. В гомогенной системе протекает обратимая химическая реакция при температуре Т (табл. 3.5) в соответствии c уравнением вида
aA
+ bB
qQ + dD.
1. Вычислите изменение
энтальпии
![]() ,
изменение энтропии
,
изменение энтропии
![]() и изменение энергии Гиббса
и изменение энергии Гиббса
![]() реакции при 298 К.
2. Дайте
термодинамическую характеристику
реакции при 298 К.
3. Рассчитайте
константу равновесия Кр
и Кс при
температуре Т, прини-мая, что
реакции при 298 К.
2. Дайте
термодинамическую характеристику
реакции при 298 К.
3. Рассчитайте
константу равновесия Кр
и Кс при
температуре Т, прини-мая, что
![]() .
4. Рассчитайте константы равновесия
Кр
и Кс
при температуре Т мето- дом Темкина
Шварцмана.
5. Рассчитайте по уравнению изотермы
химической реакции энергию Гиббса
.
4. Рассчитайте константы равновесия
Кр
и Кс
при температуре Т мето- дом Темкина
Шварцмана.
5. Рассчитайте по уравнению изотермы
химической реакции энергию Гиббса
![]() ,
если начальные давления реагирующих
газов равны ро(A)
, ро(B),
ро(Q),
ро(D),
и определите направление протекания
реакции.
,
если начальные давления реагирующих
газов равны ро(A)
, ро(B),
ро(Q),
ро(D),
и определите направление протекания
реакции.
Таблица 3.5