
- •Химическое равновесие введение
- •1. Теоретические основы химического равновесия
- •1.1. Типы равновесий в химических системах
- •Типы обратимых химических и физико-химических процессов
- •1.2. Условия химического равновесия
- •Термодинамическое условие химического равновесия
- •1.3. Закон действующих масс
- •1.4. Уравнение изотермы химической реакции. Влияние состава системы на направление химической реакции
- •1.5. Уравнения изобары и изохоры химической реакции. Влияние температуры на константу химического равновесия и направление химической реакции
- •Влияние температуры на величину константы равновесия и направление смещения равновесия на основе уравнения изобары химической реакции
- •1.6. Влияние давления на константу химического равновесия и направление химической реакции
- •Влияние давления на величину константы равновесия
- •1.7. Смещение химического равновесия
- •1.7.1. Определение направления смещения равновесия по принципу Ле Шателье
- •Смещение равновесия по принципу Ле Шателье
- •1.7.2. Определение направления смещения равновесия на основе термодинамических уравнений
- •1.8. Методы определения константы химического равновесия
- •Соотношение между величиной константы равновесия и выходом продукта реакции
- •Теоретические методы расчета константы равновесия
- •Экспериментальные методы определения константы равновесия
- •1.8.1. Термодинамический расчет константы химического равновесия
- •Термодинамические уравнения, необходимые для расчета
- •Уравнения расчета δg (т) при разных приближениях расчета δСр
- •1.8.2. Расчет константы химического равновесия в статистической термодинамике
- •1.8.3. Экспериментальное определение константы химического равновесия
- •Выбор анализируемого вещества на примере предлагаемых обратимых процессов
- •Выбор метода определения концентрации анализируемого вещества на примере предлагаемых в табл. 1.12 процессов
- •Алгоритм расчета равновесного состава системы объемом V м3
- •1.9. Задания для обучения и самоконтроля
- •Тест 1.9.1. Признаки химического равновесия
- •Тест 1.9.2. Типы равновесий в обратимых процессах
- •Тест 1.9.3. Термодинамические уравнения, отражающие влияние давления, температуры, состава системы на состояние химического равновесия
- •Тест 1.9.4. Выражение константы равновесия для реакции типа
- •Тест 1.9.5. Соотношение между константами равновесия Кр и Кс для реакции
- •Тест 1.9.6. Термодинамические уравнения, характеризующие состояние равновесия
- •2. Экспериментальные работы
- •Общие правила работы и техники безопасности в лаборатории
- •Основные правила проведения эксперимента
- •Правила оформления отчета
- •2.1. Тесты открытой формы для допуска студентов к работе
- •2.2. Лабораторные работы
- •Работа 1. Изучение химического равновесия гомогенной реакции в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Варианты заданий к работе 1
- •Задание к работе 1
- •Экспериментальные данные к работе 1
- •3. Обработка экспериментальных данных
- •Алгоритм расчета равновесных концентраций
- •Объединенные экспериментальные и расчетные данные
- •4. Выводы по работе
- •В растворе гидролизующейся соли
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •5 Мл раствора во 2-ю колбу,
- •2,5 Мл раствора в 3-ю колбу,
- •0,5 Мл раствора в 4-ю колбу;
- •3. Обработка экспериментальных данных
- •Экспериментальные и расчетные данные
- •Характеристика процесса гидролиза соли
- •4. Выводы по работе
- •Работа 3. Изучение химического равновесия в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Экспериментальные и расчетные данные к работе
- •3. Обработка экспериментальных данных
- •4. Выводы по работе
- •Контрольные вопросы
- •3. Задания для самостоятельной работы
- •3.1. Примеры решения задач
- •0,83 Моль.
- •3.2. Многовариантные задачи
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Значения коэффициентов уравнения
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •4. Тесты итогового контроля
- •Образец теста первого вида
- •Образец теста второго вида
- •Библиографический список
- •Приложения
- •1. Ответы на тесты для обучения и самоконтроля в разделе 1.9
- •Фундаментальные физические постоянные
- •Соотношения между единицами физических величин
- •Приставки для образования кратных и дольных единиц
- •Предельная молярная электрическая проводимость ионов в воде
- •Произведение растворимости малорастворимых солей при 25 оС
- •Константы диссоциации кислот и оснований в водных растворах при 25 оС
- •Оглавление
3. Обработка экспериментальных данных
. При титровании протекает реакция
I2
+ 2Na2S2O3
![]() Na2S4O6
+ 2NaI.
Na2S4O6
+ 2NaI.
Из уравнения реакции следует, что 1 моль I2 реагирует с 2 моль Na2S2O3,
поэтому C(I2) = 1/2C(Na2S2O3).
. Рассчитайте равновесную концентрацию йода по уравнению
![]() .
.
3.3. Рассчитайте равновесные концентрации всех реагирующих веществ на основании уравнения исследуемой реакции по алгоритму, представленному в виде табл. 2.4.
3.4. Рассчитайте константу равновесия Кс в соответствии с законом действующих масс по уравнению
Kc
=
![]() .
.
Таблица 2.4
Алгоритм расчета равновесных концентраций
Уравнение реакции |
2 Fe3+ + 2 I– ⇄ I2 + 2 Fe2+ |
|||
Молярные соотношения реагирующих веществ |
2(Fe3+) : 2(I–) : 1(I2) : 2(Fe2+) |
|||
Начальные концентрации ионов в растворе |
= |
= |
– |
– |
Концентрации продуктов реакции |
|
|
С(I2) |
C(Fe2+) = 2C(I2) |
Концентрации веществ, вступивших в реакцию |
Cх(Fe3+) = 2C(I2) |
Cх(I–) = 2C(I2) |
|
|
Концентрации веществ при равновесии |
С(Fe3+) = = Со(Fe3+) – Cх(Fe3+) |
C(I–) = = Co(I–) – Cх(I–) |
C(I2) |
C(Fe2+) |
Примечание: V(FeCl3)
+ V(KI) = 100 мл;
![]() С(FeCl3); С(I–)
= C(KI).
С(FeCl3); С(I–)
= C(KI).
3.5. Занесите в табл. 2.5 рассчитанные равновесные концентрации реагирующих веществ и константу равновесия.
Таблица 2.5
Расчетные данные
Реагирующие вещества |
Fe3+
|
I–
|
I2
|
Fe2+
|
Равновесные концентрации С(В), моль/л |
|
|
|
|
Константа равновесия Кc, л/моль |
|
|||
3.6. Представьте в виде табл. 2.6 результаты экспериментальных и рас-
четных данных реакции, полученных всеми исследователями.
3.7. Рассчитайте:
- среднее значение константы равновесия исследуемой реакции Ксср(T) при заданной температуре по формуле
 ,
,
где
![]() (Т)
– экспериментальная
величина константы равновесия при
задан- ной температуре Т; n
– число экспериментальных величин
константы рав-новесия;
(Т)
– экспериментальная
величина константы равновесия при
задан- ной температуре Т; n
– число экспериментальных величин
константы рав-новесия;
- тепловой эффект
исследованной реакции
![]() по интегральному урав- нению изобары
химической реакции
по интегральному урав- нению изобары
химической реакции
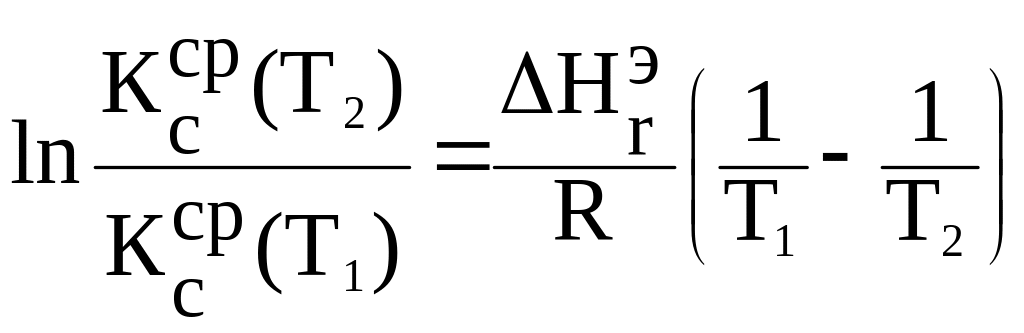 ;
;
- погрешность
определения теплового эффекта
![]() по
формуле
по
формуле
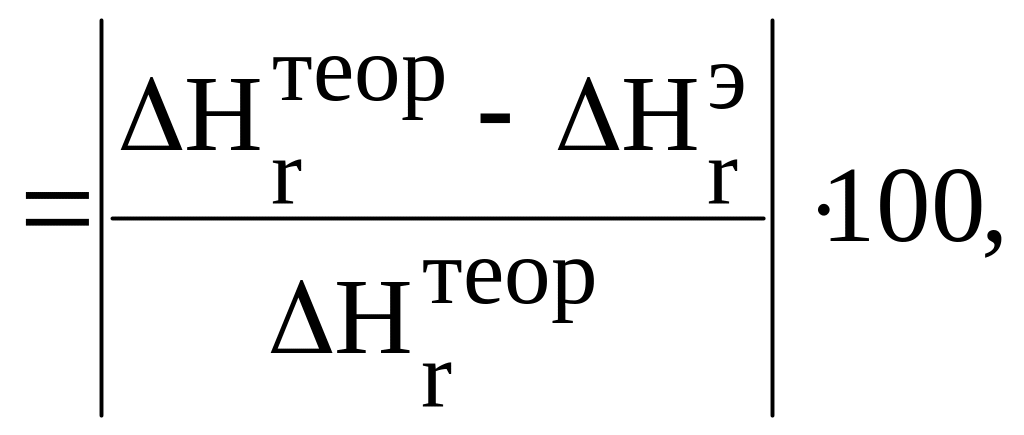
где
![]() – теоретическое значение теплового
эффекта реакции при тем- пературе 298 К,
рассчитанное на основе справочных
термодинамических величин.
– теоретическое значение теплового
эффекта реакции при тем- пературе 298 К,
рассчитанное на основе справочных
термодинамических величин.
Таблица 2.6
