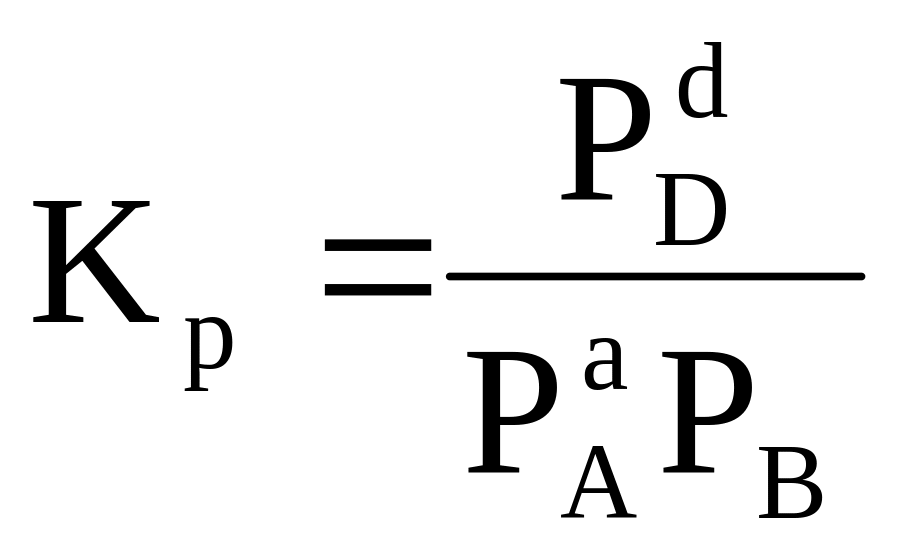- •Химическое равновесие введение
- •1. Теоретические основы химического равновесия
- •1.1. Типы равновесий в химических системах
- •Типы обратимых химических и физико-химических процессов
- •1.2. Условия химического равновесия
- •Термодинамическое условие химического равновесия
- •1.3. Закон действующих масс
- •1.4. Уравнение изотермы химической реакции. Влияние состава системы на направление химической реакции
- •1.5. Уравнения изобары и изохоры химической реакции. Влияние температуры на константу химического равновесия и направление химической реакции
- •Влияние температуры на величину константы равновесия и направление смещения равновесия на основе уравнения изобары химической реакции
- •1.6. Влияние давления на константу химического равновесия и направление химической реакции
- •Влияние давления на величину константы равновесия
- •1.7. Смещение химического равновесия
- •1.7.1. Определение направления смещения равновесия по принципу Ле Шателье
- •Смещение равновесия по принципу Ле Шателье
- •1.7.2. Определение направления смещения равновесия на основе термодинамических уравнений
- •1.8. Методы определения константы химического равновесия
- •Соотношение между величиной константы равновесия и выходом продукта реакции
- •Теоретические методы расчета константы равновесия
- •Экспериментальные методы определения константы равновесия
- •1.8.1. Термодинамический расчет константы химического равновесия
- •Термодинамические уравнения, необходимые для расчета
- •Уравнения расчета δg (т) при разных приближениях расчета δСр
- •1.8.2. Расчет константы химического равновесия в статистической термодинамике
- •1.8.3. Экспериментальное определение константы химического равновесия
- •Выбор анализируемого вещества на примере предлагаемых обратимых процессов
- •Выбор метода определения концентрации анализируемого вещества на примере предлагаемых в табл. 1.12 процессов
- •Алгоритм расчета равновесного состава системы объемом V м3
- •1.9. Задания для обучения и самоконтроля
- •Тест 1.9.1. Признаки химического равновесия
- •Тест 1.9.2. Типы равновесий в обратимых процессах
- •Тест 1.9.3. Термодинамические уравнения, отражающие влияние давления, температуры, состава системы на состояние химического равновесия
- •Тест 1.9.4. Выражение константы равновесия для реакции типа
- •Тест 1.9.5. Соотношение между константами равновесия Кр и Кс для реакции
- •Тест 1.9.6. Термодинамические уравнения, характеризующие состояние равновесия
- •2. Экспериментальные работы
- •Общие правила работы и техники безопасности в лаборатории
- •Основные правила проведения эксперимента
- •Правила оформления отчета
- •2.1. Тесты открытой формы для допуска студентов к работе
- •2.2. Лабораторные работы
- •Работа 1. Изучение химического равновесия гомогенной реакции в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Варианты заданий к работе 1
- •Задание к работе 1
- •Экспериментальные данные к работе 1
- •3. Обработка экспериментальных данных
- •Алгоритм расчета равновесных концентраций
- •Объединенные экспериментальные и расчетные данные
- •4. Выводы по работе
- •В растворе гидролизующейся соли
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •5 Мл раствора во 2-ю колбу,
- •2,5 Мл раствора в 3-ю колбу,
- •0,5 Мл раствора в 4-ю колбу;
- •3. Обработка экспериментальных данных
- •Экспериментальные и расчетные данные
- •Характеристика процесса гидролиза соли
- •4. Выводы по работе
- •Работа 3. Изучение химического равновесия в растворе
- •1. Теоретические основы работы
- •2. Методика выполнения работы
- •Экспериментальные и расчетные данные к работе
- •3. Обработка экспериментальных данных
- •4. Выводы по работе
- •Контрольные вопросы
- •3. Задания для самостоятельной работы
- •3.1. Примеры решения задач
- •0,83 Моль.
- •3.2. Многовариантные задачи
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Значения коэффициентов уравнения
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •Варианты заданий
- •4. Тесты итогового контроля
- •Образец теста первого вида
- •Образец теста второго вида
- •Библиографический список
- •Приложения
- •1. Ответы на тесты для обучения и самоконтроля в разделе 1.9
- •Фундаментальные физические постоянные
- •Соотношения между единицами физических величин
- •Приставки для образования кратных и дольных единиц
- •Предельная молярная электрическая проводимость ионов в воде
- •Произведение растворимости малорастворимых солей при 25 оС
- •Константы диссоциации кислот и оснований в водных растворах при 25 оС
- •Оглавление
Тест 1.9.2. Типы равновесий в обратимых процессах
Схема процесса |
Название процесса |
1 |
2 |
1. NH3(г) + H2O(ж) ⇄ NH4OH(p)
|
А. Гидратация вещества |
2. СаСОз(к) ⇄
Са
|
Б. Дегидратация вещества |
3. [Cu(NH3)4] (р)2+ + H2O(ж) ⇄ [Cu(NH3)3]2+(р) + NH4OH(р) |
В. Гидролиз по катиону |
4. [Pt(NH3)2Cl2]
(p) ⇄
[Pt(NH3)2Cl] |
Г. Гидролиз по аниону |
5. H2(г) + Cl2(г) ⇄ 2HCl(г)
|
Д. Гетерогенная хими- ческая реакция |
6. Mg + H2O(ж) ⇄ MgOH + H |
Е. Гомогенная хими- ческая реакция |
7. CuSO4 5H2O(к) ⇄ СuSО4(к)+5H2O(г) |
Ж. Электролитическая диссоциация |
8. CaCl 2(к) + 6H2O(ж) ⇄ СaCl2 6H2O(к) |
З. Растворение и дис- социация мало- растворимого в-ва |
9.
H3PO4(p)
⇄ H
+ H2PO |
И. Диссоциация комп- лексного соединения |
10. PO |
К. Диссоциация комплексного иона |
Тест 1.9.3. Термодинамические уравнения, отражающие влияние давления, температуры, состава системы на состояние химического равновесия
Воздействие на систему путем изменения параметра |
Термодинамическое уравнение |
1 |
2 |
1. Температуры при P = const |
А.
|
2. Tемпературы при V = const |
Б.
|
3. Давления при T = const |
В.
|
4. Состава при T = const, P = const |
Г.
|
5. Состава при T = const, V = const |
Д.
|
Тест 1.9.4. Выражение константы равновесия для реакции типа
aA + bB ⇄ qQ + dD
Уравнение реакции |
Выражение константы |
1 |
2 |
1. Fe2O3(к) + 3Н2(г) ⇄ 2Fe(к) + 3Н2О(г) |
А.
|
2. 2СO(г) + SO2(г) ⇄ S(ромб) + 2СО2(г) |
Б.
|
3. СS2(ж) + 3O2(г) ⇄ CO2(г) + 2SO2(г) |
В.
|
4. 2CrCl3(к) + 3H2(г) ⇄ 6HCl(г) + 2Cr(к) |
Г.
|
5. 4NH3(г) + 5O2(г) ⇄ 6H2O(г) + 4NO(г) |
Д.
|
6. H2(г) + 3Fe2O3(к) ⇄ 2Fe3O4(к) + H2O(г) |
Е.
|
7. H2O(г) + CO(г) ⇄ CO2(г) + H2(г) |
Ж. Кр = 1 |
8. SiO2(к) + 2Mg(к) ⇄ 2MgO(к) + Si(к) |
З.
|
9. СH3OH(ж) + СH3COOH(ж) ⇄ CH3COOCH3(p) + H2O(ж) |
И.
|
10. CHCl3(ж) + Cl2(г) ⇄ CCl4(ж) + HCl(г) |
К.
|