
- •1. Метрологические характеристики анализа. Ход анализа
- •2. Погрешности в анализе. Классификация погрешностей. Правильность, воспроизводимость и точность анализа.
- •3. Общая характеристика реакций в растворах. Активность, коэффициент активности.
- •4. Протолитическая теория диссоциации. Кислоты и основания, амфолиты. Автопротолиз.
- •11. Техника приготовления растворов. Стандартизация растворов. Расчеты в титриметрическом анализе.
- •12. Кривые кислотно-основного титрования. Скачок на кривой титрования. Зависимость величины скачка от различных факторов.
- •13. Кислотно-основные индикаторы. Ионно-хромофорная теория индикаторов. Принцип выбора индикаторов.
- •14. Рабочие и стандартные растворы в кислотно-основном титровании.
- •15. Определение слабых многоосновных кислот, смесей кислот и солей слабых многоосновных кислот.
- •16. Окислительно-восстановительных потенциал. Зависимость потенциала от различных факторов.
- •17. Стандартный и формальный окислительно-восстановительный потенциалы. Константа равновесия Red-Ox реакций.
- •18. Расчет и построение кривых окислительно-восстановительного титрования.
- •19. Способы фиксации точки эквивалентности в red-ox титровании. Red-Ox индикаторы.
- •21. Йодометрия. Рабочие и стандартные растворы.
- •22. Условия йодометрических определений. Йодометрическое определение окислителей и восстановителей с примерами.
11. Техника приготовления растворов. Стандартизация растворов. Расчеты в титриметрическом анализе.
Рабочий раствор – раствор, который готовится с приблизительной концентрацией. Стандартные растворы – растворы с точной концентрацией. Способы приготовления стандартных растворов – 1) По навеске, с щелочью нельзя приготовить. Требования к веществам – 1. Иметь кристаллическую структуру, 2. Вещество должно соответствовать своей химической формуле, 3. Вещество должно быть химически чистым, 4. Вещество должно быть химически устойчивым при хранении, 5. Вещества должно иметь большую молярную массу, чтобы уменьшить погрешность при взвешивании. 2) Из фиксанала; 3) Из более концентрированных стандартных растворов.
12. Кривые кислотно-основного титрования. Скачок на кривой титрования. Зависимость величины скачка от различных факторов.
Кривая
кислотно-основного титрования –
графическая зависимость рН от объема
или количества прилитого титранта.
Рассчитываются и строятся – 1) Чтобы
рассчитать точку эквивалентности
(продукты реакции); 2) Для правильного
выбора индикатора; 3) Для расчета
погрешности при титровании. Скачок на
кривой титрования – резкое изменение
рН вблизи точки эквивалентности. Чем
больше скачок тем меньше погрешность.
Величина скачка зависит – 1) от силы
электролита (чем сильнее, тем больше);
2) от концентрации реагирующих веществ
(чем больше, тем больше); 3) от температуры
(чем больше, тем меньше)
 .
.
13. Кислотно-основные индикаторы. Ионно-хромофорная теория индикаторов. Принцип выбора индикаторов.
Ионная теория индикаторов – слабые
органические кислоты или основания.
Индикаторы – сложные органические
соединения из класса красителей,
содержащие в своей структуре определенные
группы. Молекулярная и ионная форма
имеют разную окраску – 1) Н+ -
красный; 2) ОН- - желтый. Если
равновесие реакции сдвинуто вправо –
преобладает ионная форма индикатора и
наоборот. Окраска заметна, если
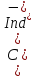 ,
тогда
,
тогда
 (желтый/красный). Окраска индикатора
зависит от рН среды. Показатель титрования
(рТ) – величина рН, при которой заканчивается
титрование с данным индикатором.
Приблизительно равны с рК. Хромофорная
теория – в молекуле индикатора содержаться
группы – 1) сопряженные связи; 2) бензольные
или нафталиновые кольца; 3) хромофорные
группы, несущие цвет (азо-, нитро-,
нитрозо-); 4) аулсохранные группы,
усиливающие цвет (гидроксо-, метильные,
карбонильные). Индикатор выбирают так,
чтобы интервал перехода окраски попадал
на скачок кривой титрования. Метиловый
красный – титрование сильной кислоты
сильным основанием. Фенолфталеин – то
же, что и метиловый красный + титрования
слабой кислоты сильным основанием. При
выборе индикатора следует – 1) Использовать
спиртовые растворы, т.к. они более
чувствительны к изменению окраски; 2)
Для 1-цветных индикаторов следует строго
соблюдать количество добавленного
индикатора; 3) Всегда нужно титровать
до появления 1-го и того же оттенка
окраски раствора; 4) Нужно выбирать
индикатор, который изменяется свой цвет
вблизи точки эквивалентности.
(желтый/красный). Окраска индикатора
зависит от рН среды. Показатель титрования
(рТ) – величина рН, при которой заканчивается
титрование с данным индикатором.
Приблизительно равны с рК. Хромофорная
теория – в молекуле индикатора содержаться
группы – 1) сопряженные связи; 2) бензольные
или нафталиновые кольца; 3) хромофорные
группы, несущие цвет (азо-, нитро-,
нитрозо-); 4) аулсохранные группы,
усиливающие цвет (гидроксо-, метильные,
карбонильные). Индикатор выбирают так,
чтобы интервал перехода окраски попадал
на скачок кривой титрования. Метиловый
красный – титрование сильной кислоты
сильным основанием. Фенолфталеин – то
же, что и метиловый красный + титрования
слабой кислоты сильным основанием. При
выборе индикатора следует – 1) Использовать
спиртовые растворы, т.к. они более
чувствительны к изменению окраски; 2)
Для 1-цветных индикаторов следует строго
соблюдать количество добавленного
индикатора; 3) Всегда нужно титровать
до появления 1-го и того же оттенка
окраски раствора; 4) Нужно выбирать
индикатор, который изменяется свой цвет
вблизи точки эквивалентности.
